7种十字花科种子中黑芥子酶降解油菜籽饼粕中硫苷的产物比较分析
丁 艳,李丽倩,顾振新,韩永斌
(南京农业大学食品科技学院,江苏 南京 210095)
油菜籽饼粕富含蛋白质和氨基酸,是一种潜在的食用蛋白源。但是硫代葡萄糖苷(简称硫苷)等抗营养因子的存在,限制了其在食品和饲料的利用,大部分作为肥料造成资源的浪费[1]。现有研究[2-5]表明硫苷降解产物之一——异硫氰酸酯类物质不仅是形成十字花科蔬菜和调味品风味的化合物,还具有参与植物防御、生长素动态平衡及人类癌症预防等生物活性,受到国内外学者广泛关注。
黑芥子酶(EC3.2.3.1)是一种可以降解硫苷的水解酶,主要分布于十字花科植物体内[6-7],可将硫苷降解成硫氰酸酯、异硫氰酸酯、恶唑烷硫酮和腈等物质[8],这些降解产物的组成和比例受黑芥子酶性质、硫苷侧链、pH值及金属离子的影响[9-12]。由于亚基、分子质量及糖基化程度不同,植物中形成不同形式和结构的黑芥子酶。黑芥子酶的三维结构,以及黑芥子酶结合蛋白和协助蛋白对硫苷降解的影响,主要表现在不同来源的黑芥子酶对相同硫苷的降解率[13]和硫苷的降解产物组分[14]存在差异。Shen Lianqing等[15]添加西兰花种子黑芥子酶能提高西兰花种子异硫氰酸酯含量,减少腈类等物质的产生,但关于不同来源的黑芥子酶对硫苷降解产物组分的研究鲜有报道。本研究比较了十字花科种子中黑芥子酶对油菜籽饼粕中硫苷降解组分的影响,以期获得能减少有毒副作用的恶唑烷酮及腈类物质产生、尽可能多的生成异硫氰酸酯的黑芥子酶,为油菜籽饼粕的合理利用提供基础。
1 材料与方法
1.1 材料与试剂
油菜籽、油菜籽饼粕 南京隆盛油脂有限公司;白菜籽(抗病北京3号大白菜)、萝卜籽(夏秋白萝卜)、西兰花籽(绿玉80 d)、芥蓝籽(香港白花芥蓝)、芥菜籽(花叶香芥菜)、甘蓝籽(精选8132F1甘蓝) 南京金盛达种子公司。
磷酸二氢钾、磷酸氢二钾、乙二胺四乙酸二钠、二硫苏糖醇、甘油、硫酸铵、二氯甲烷、聚乙二醇均为分析纯 国药集团化学试剂有限公司;黑芥子硫苷酸钾(>99%)标准品 美国Sigma公司。
1.2 仪器与设备
12~14 kD透析袋 美国Pharmacia公司;FSD-100A型电动粉碎机 台州市新恩精密粮仪有限公司;JA2003电子天平 上海沪粤明科学仪器有限公司;AUY120精密天平 日本Shimadzu公司;Orion818型pH测定仪日本Orion公司;HH-2数显恒温水浴锅 常州国华电器有限公司;TG16-WS台式高速离心机 长沙湘智离心机仪器有限公司;TDL-40B离心机 上海安亭科学仪器厂;DHG-9030A电热恒温鼓风干燥箱 上海一恒科技有限公司;UV-2802型紫外-可见分光光度计 尤尼柯(上海)仪器有限公司;RE-52AA旋转蒸发器 上海亚荣生化仪器厂;Agilent 7890/5975C气质联用仪 美国安捷伦公司。
1.3 方法
1.3.1 黑芥子酶的提取
黑芥子酶(西兰花籽、油菜籽、白菜籽、萝卜籽、芥蓝籽、甘蓝籽和芥菜籽黑芥子酶分别简写为BSm、RPSm、WCSm、RDSm、KSm、CSm、MSm)提取方法参照文献[16],6 g种子经电动粉碎机碎成粉末,加入60 mL 10 mmol/L磷酸钾缓冲液(其中添加1 mmol/L EDTA、3 mmol/L二硫苏糖醇、5%甘油)(pH 7.2),冰浴研磨,冰浴条件下超声破碎20 min,4 层纱布过滤除滤渣,滤液在4 ℃、16 000 r/min离心30 min,取上清液50 mL,加入固体硫酸铵使上清液饱和度达到55%,4 ℃放置1 h,16 000 r/min冷冻离心30 min,使黑芥子酶聚集,取沉淀溶于4 mL去离子水中,并用去离子水透析4 ℃过夜,透析袋取出后表面擦干,放入盛有聚乙二醇的烧杯内,4 ℃放置0.5 h,得到黑芥子酶提取浓缩液,0.066 7 mol/L 磷酸钾缓冲液定容至30 mL。
1.3.2 黑芥子酶活力的测定
在Eylen等[17]的基础上改进,1.50 mL 0.066 7 mol/L磷酸钾缓冲液(pH 6.5)、500 μL抗坏血酸溶液(1 mmol/L)、50 μL黑芥子硫苷酸钾溶液(25.18 mmol/L)和20 μL酶液,分别在37 ℃条件下保温,混合平衡1 min。置于1 cm光路石英比色皿中,37 ℃反应30 min,测定227 nm波长处吸光度计算酶活力。分别取25.18 mmol/L黑芥子硫苷酸钾标品0、12.5、25、37.5、50、70 μL,用缓冲液将其定容至2.07 mL,测定其在227 nm波长处的吸光度,以浓度(mmol/L)为横坐标,吸光度为纵坐标绘制标准曲线,得到标准曲线方程为Y=0.948 4X-0.002 8(R2=0.999 4)。
酶活力单位定义[16]:在pH 6.5、37 ℃条件下,1 min催化1 μmol的黑芥子硫苷酸钾所需要的酶量称为1 个活力单位(U)。酶比活力(U/mg)单位定义为每毫克蛋白质中黑芥子酶的活力。

式中:N为反应时间内黑芥子酶降解黑芥子硫苷酸钾的量/μmol;t为反应时间/min;VE为酶液体积/mL;VEX为提取液体积/mL。
1.3.3 总蛋白的测定
参照考马斯亮蓝G-250染色法[18]。
1.3.4 硫苷降解产物的制备与提取
油菜籽饼粕粉碎后过60 目筛,90 ℃干燥4 h至恒质量。
取1.3.1节黑芥子酶提取液5 mL,与5 mL 0.066 7 mol/L磷酸钾缓冲液(pH 6.5)混合,加入1.00 g油菜籽饼粕,40 ℃水浴反应2 h,100 ℃灭酶15 min。加入5 mL二氯甲烷提取30 min,5 000 r/min离心15 min,取有机层过0.45 μm膜,35 ℃旋转真空浓缩,得到降解产物提取物。
同时制得黑芥子酶提取液和不加酶的油菜籽饼粕的降解产物提取物。
1.3.5 GC-MS分析条件
色谱柱:Hp-5ms石英毛细管柱;载气:氦气;流速:1.0 mL/min;进样口温度:250 ℃;程序升温条件:起始35 ℃保持5 min,以10 ℃/min升温至210 ℃保持5 min。
质谱条件:EI离子源温度:240 ℃;接口温度:250 ℃;四极杆温度:150 ℃;EI能量:70 eV;扫描范围m/z:50~240。
1.4 数据统计与分析
GC-MS数据通过化学工作站数据处理软件分析谱图,检索NIST08谱图库,结合人工图谱解析及资料分析,确定挥发性物质的各个化学成分的结构式,按峰面积归一化法求得各成分相对百分含量,仅当匹配度大于80%(完全匹配为100%)的鉴定结果才予以报道。
2 结果与分析
2.1 7种十字花科植物种子黑芥子酶比活力比较

图1 7种十字花科植物种子黑芥子酶活性比较Fig.1 Myrosinase activities in seven cruciferous seeds
由图1可知,7 种十字花科植物种子黑芥子酶的比活力从高到低依次为,西兰花籽、油菜籽、白菜籽、萝卜籽、芥蓝籽、甘蓝籽、芥菜籽。其中BSm酶比活力最高,为69.4 U/mg,显著高于其他酶比活力(P<0.05)。RPSm次之,为59.8 U/mg,MSm酶比活力最低,为14.5 U/mg。
2.2 不同来源黑芥子酶对油菜籽饼粕中硫苷降解产物组分的影响
对7 种来源不同的黑芥子酶液及其酶解油菜籽饼粕中的硫苷降解产物GC-MS总离子流图进行计算机谱库检索,总离子流图见图2。
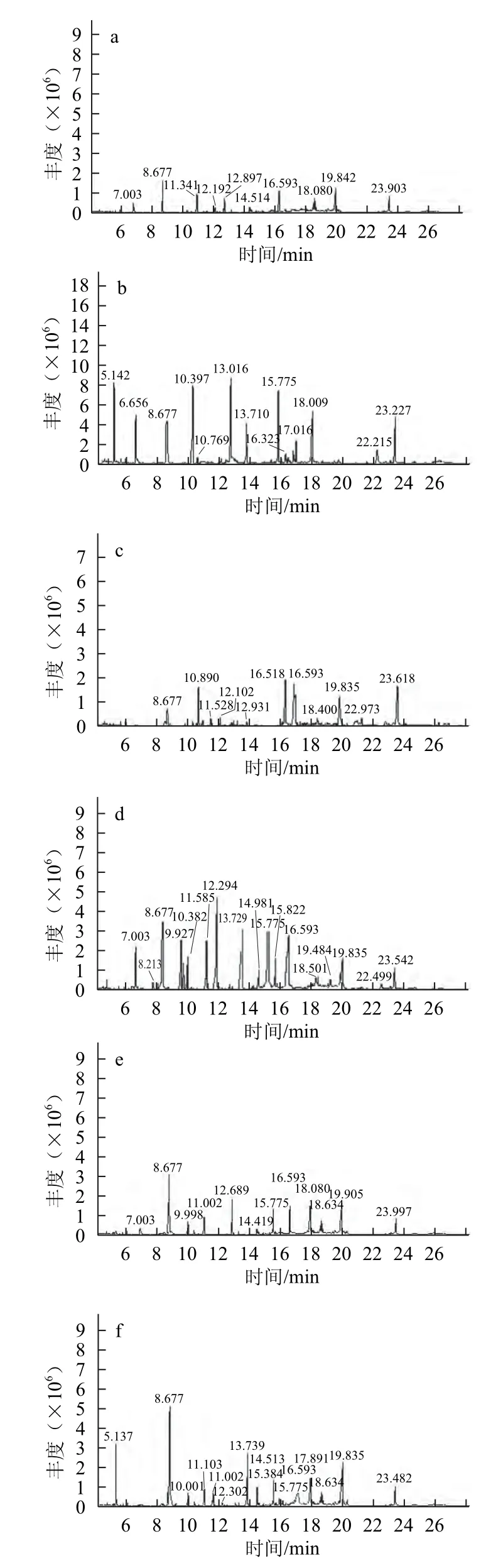
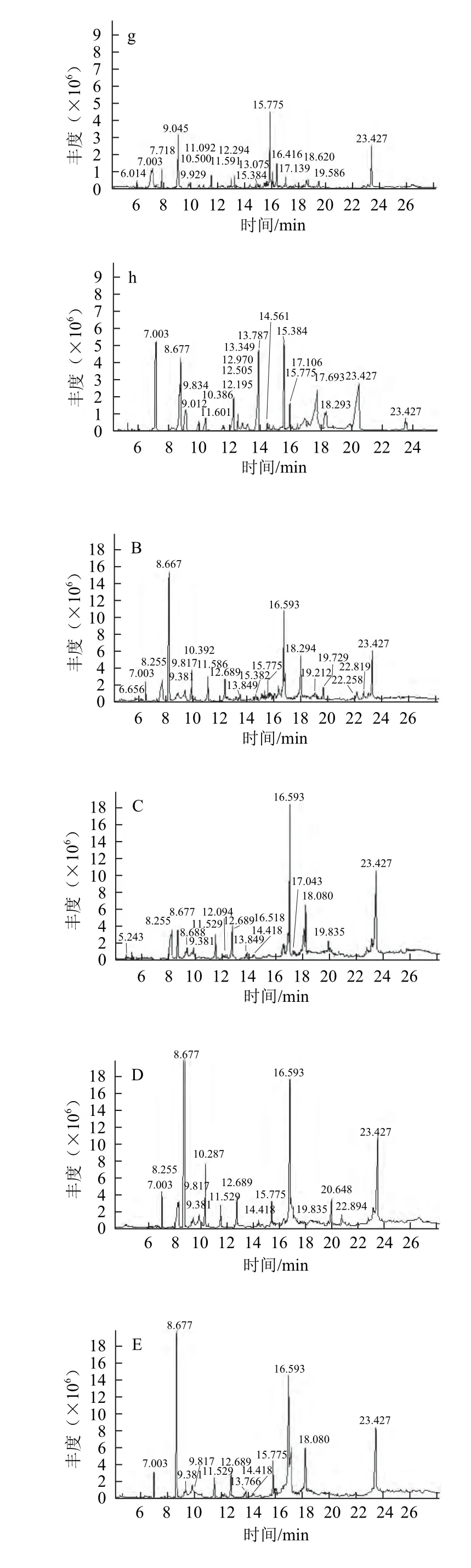

图2 不同来源黑芥子酶酶解硫苷产物及黑芥子酶提取物总离子流图Fig.2 Total ion chromatograms of hydrolysates of glucosinolates by myrosinases from different cruciferous seeds and compounds in the extract of myrosinase
2.2.1 添加外源RPSm降解油菜籽饼粕中硫苷的产物
由表1可知,油菜籽饼粕中的硫苷经RPSm降解后的产物(称为基本产物)主要包括6 种,即3种异硫氰酸酯:1-丁烯基-4-异硫氰酸酯(31.20%)、烯丙基异硫氰酸酯(1.46%)、2-苯乙基异硫氰酸酯(1.04%);1 种腈类物质:苯丙腈(3.90%)和2 种恶唑:致甲状腺肿素(28.59%)、2,1-苯并异恶唑(2.11%)。而对照只检测到4 种物质:烯丙基异硫氰酸酯(0.13%)、1-丁烯基-4-异硫氰酸酯(1.73%)、致甲状腺肿素(2.38%)、2,1-苯并异恶唑(0.14%)。与对照相比,外加RPSm后,1-丁烯基-4-异硫氰酸酯相对含量从1.73%增至31.20%,致甲状腺肿素相对含量从2.11%增至28.59%,烯丙基异硫氰酸酯从0.13%升至1.46%,2,1-苯并异恶唑从0.14%升至2.11%。可以看到,外加RPSm不仅能增加产物组分种类,还增大了各组分的相对含量。
2.2.2 6种其他来源的黑芥子酶降解油菜籽饼粕中硫苷生成产物的组成差异
与基本产物相比,6 种其他来源的黑芥子酶降解产物中新物质的种类明显增加。WCSm降解油菜籽饼粕中的硫苷不仅产生基本产物,还产生了1-丁基异硫氰酸酯(0.93%)、1-戊烯基,5-腈(0.62%)和3-吲哚乙腈(1.16%)3 种新物质。RDSm的降解产物中有丁腈(0.3%)、硫杂环戊烷-3,4-二腈(9.67%)、2,4-二甲基恶唑(4.05%)和5-甲氧基-4-甲基-2,1,3-苯并恶唑(11.35%)。BSm降解产物中同样产生3 种新产物:硫杂环戊烷-3,4-二腈(3.82%)、2-乙基-4甲基-恶唑(5.94%)、3-吲哚乙腈(1.56%)。KSm和CSm产生1-丁基异硫氰酸酯、3-吲哚乙腈、2-氰基甲基-1,3-苯并恶唑等3 种新产物。添加来自MSm产生2 种新物质,即1-丁基异硫氰酸酯(3.75%)和3-吲哚乙腈(2.74%)。

表1 十字花科植物种子黑芥子酶降解油菜籽饼粕中硫苷产物组分Table 1 Glucosinolate degradation products in rapeseed meal hydrolyzed by myrosinases from different cruciferous seeds
添加外源黑芥子酶,降解产物中出现了新物质,同时减少了基本产物的组成和含量。RDSm降解产物中未检测到烯丙基异硫氰酸酯和2-苯乙基异硫氰酸酯,MSm中未检测到1-丁烯基-4-异硫氰酸酯。这6 种黑芥子酶均未检测到2,1-苯并异恶唑。推测是不同来源的黑芥子酶影响硫苷降解产物的组成[13]。
2.2.3 6种其他来源的黑芥子酶对基本产物相对含量的影响
1-丁烯基-4-异硫氰酸酯是主要降解产物,在CSm、RPSm、WCSm、BSm和KSm 5 种黑芥子酶降解产物中含量较高,相对含量分别为33.22%、32.20%、29.46%、26.91%和26.61%;RDSm含量最低为0.54%,而MSm未检测到。但MSm和RDSm降解产物中苯丙腈含量显著高于其他黑芥子酶的产生量,分别为7.94%和7.01%。此外,MSm降解产物中致甲状腺肿素含量最高,为29.35%;WCSm与RPSm生成量相近,分别为28.83%和28.59%;CSm、BSm、KSm和RDSm生成致甲状腺肿素相对含量分别为17.50%、15.94%、13.59%和12.59%。MSm不产生1-丁烯基-4-异硫氰酸酯,但致甲状腺肿素含量高于其他黑芥子酶的生成量,可能与黑芥子酶降解硫苷的特异性有关[23]。
RDSm降解产物中未检测到烯丙基异硫氰酸酯和2-苯乙基异硫氰酸酯,其他6 种十字花科种子黑芥子酶降解产物中均检测到。这2 种产物在KSm降解产物中含量最高,分别为1.86%和2.18%;CSm相对含量最小,分别为1.12%和1.45%。不同黑芥子酶生成这2 种异硫氰酸酯在的含量差别较小。
3 讨 论
3.1 7种黑芥子酶活性差异分析
本实验比较了7 种黑芥子酶比活力,不同来源的黑芥子酶比活力存在显著差异。朱磊[16]研究本实验7 种黑芥子酶活性,BSm的活性最高,KSm活性最低。Bones[19]测定RPSm、WCSm和RDSm活力,发现RPSm活性最低。以上报道均与本实验结果不同,可能与黑芥子酶的活性与植物种类、品种和器官有关[3]。据报道,黄芥籽中的内生黑芥子硫苷酸钾含量较高,其内源黑芥子酶对黑芥子硫苷酸钾的比活力很低,但对于4-甲基亚磺酰丁基芥子油苷的降解率较高[16],说明酶的底物也是影响黑芥子酶活性的重要因素[9]。
3.2 7 种黑芥子酶对油菜籽饼粕中硫苷降解产物组分差异分析
不同来源的黑芥子酶降解油菜籽饼粕中的硫苷,同一种产物的相对含量存在差异。实验中BSm的活性最高,显著高于CSm,但CSm产生1-丁烯基-4-异硫氰酸酯高于BSm生成量,在相同硫苷含量的前提下,硫苷降解产物相对含量并未随酶活的增加而增加,不同来源的黑芥子酶对同一底物硫苷的降解率存在差异[16],有研究发现在植物体内硫苷含量与黑芥子酶活性无直接关系[19]。可见,酶活不是决定硫苷降解产物含量的必要条件。不同植物种类、器官的存在不同黑芥子酶形式的同工酶,是影响硫苷降解产物含量和种类的重要因素之一[14]。此外,Halkier等[20]研究表明,不同来源的黑芥子酶对硫苷的特异性不同,同时朱磊[16]在研究中指出亲缘性较近的植物中黑芥子酶性质基本相似。
RDSm产物中未检测到烯丙基异硫氰酸酯和2-苯乙基异硫氰酸酯,在关于萝卜中风味物质的研究中[21-22],相关物质也未见报道。MSm降解产物中未检测到1-丁烯基-4-异硫氰酸酯,在芥菜中[23-24]未检测到或相对峰面积在0.11%。主要是由于萝卜和芥菜的亲缘性与油菜较低,酶的专一性影响黑芥子酶与硫苷的结合[16]。WCSm、KSm、MSm和CSm降解油菜籽饼粕中硫苷后产生丁基异硫氰酸酯,研究表明这4 种黑芥子酶具有降解硫苷生成丁基异硫氰酸酯的特性,这种特性在植物的不同形态下选择性表达[25-26]。
与基本产物相比,6 种其他来源的黑芥子酶降解产物中腈类和恶唑类种类增加。7 种黑芥子酶降解产物中均检测到苯丙腈和甲状腺肿素,但是相对含量不同,这可能与黑芥子酶对前体硫苷降解率不同相关[13]。3-吲哚乙腈是WSm、BSm、KSm、MSm和CSm降解硫苷的产物,是黑芥子酶、黑芥子酶协助蛋白和pH值等共同作用的结果,也有硫苷代谢途径研究表明3-吲哚-乙腈途径是植物中的黑芥子酶遭遇胁迫(如缺硫)产生[27-28],参与生长素合成以及植物的防御反应。丁腈(0.3%)、硫杂环戊烷-3,4-二腈(9.67%)、2,4-二甲基恶唑(4.05%)和5-甲氧基-4-甲基-2,1,3-苯并恶唑(11.35%)是RDSm产生的新物质。以上4 种新产物在刘贤娴[21]、Blažević[22]等关于多品种萝卜及萝卜叶的研究中并未检测到。RDSm产生腈类和恶唑种类比其他来源的黑芥子酶多,可能是萝卜与油菜的物种的亲缘性较低,还与RDSm相关蛋白会将硫苷酰基化[29-30]有关,但这些还未被完全证实。
4 结 论
7 种十字花科植物种子中黑芥子酶的比活力由高到低的顺序依次为BSm、RPSm、WCSm、RDSm、KSm、CSm和MSm;BSm酶比活力最高,为69.4 U/mg,而RPSm为59.8 U/mg,MSm酶比活力最低,为14.5 U/mg。不同来源黑芥子酶的比活力存在显著差异。
添加不同来源黑芥子酶会使油菜籽饼粕中硫苷降解产物的种类和相对含量产生明显差异。WCSm、KSm、MSm及CSm降解产物检测到新组分丁基异硫氰酸酯,相对含量分别为0.93%、1.35%、1.18%和1.36%。CSm产生1-丁烯基-4-异硫氰酸酯含量最高(33.22%),RPSm产生1-丁烯基-4-异硫氰酸酯相对含量为32.20%;RDSm生成量较少(0.54%),而MSm产物中未检测到。除RPSm外,其他6 种降解产物中几乎不产生2,1-苯并异恶唑,但其他恶唑类及腈类产物种类增加,恶唑类有4 种:2,4-二甲基恶唑,2-乙基-4甲基-恶唑,5-甲氧基-4-甲基-2,1,3-苯并恶唑,2-氰基甲基-1,3-苯并恶唑。腈类主要有3 种:丁腈、1-戊烯基,5-腈和3-吲哚乙腈。不同来源的黑芥子酶在相同实验条件下降解油菜籽饼粕中硫苷产生的产物种类和相对含量存在明显差异。在油菜籽饼粕中添加RPSm,能有效减少硫苷转化为恶唑类和腈类物质。
[1]ROSENTHAL A, PYLE D L, NIRANJAN K, et al.Combined effect of operational variables and enzyme activity on aqueous enzymatic extraction of oil and protein from soybean[J].Enzyme and Microbial Technology, 2001, 28(6): 224-228.
[2]林旭辉, 李荣, 姜子涛.辣根挥发油化学成分的研究[J].食品科学,2001, 22(3): 73-75.
[3]WINDE I, WITTSTOCK U.Insect herbivore counteradaptations to the plant glucosinolate-myrosinase system[J].Phytochemistry, 2011, 72:1566-1575.
[4]AGERBIRK N, de VOS M, KIM J H, et al.Indole glucosinolate breakdown and its biological effects[J].Phytochemistry Review, 2009,8: 101-120.
[5]KEUM Y S, JEONG W S, KONG A N.Chemoprevention by isothiocyanates and their underlying molecular signaling mechanisms[J].Mutation Research, 2004, 555(1/2): 191-202.
[6]WALLACE S K, EIGENBRODE S D.Changes in the glucosinolatemyrosinase in theBrassica junceacotyledons during seedling development[J].Journal of Chemical Ecology, 2001, 28: 243-256.
[7]WITTSTOCK U, HALKIER B A.Glucosinolate research in theArabidopsis era[J].Trends in Plant Science, 2002, 7: 263-270.
[8]MCGREGOR D I.Glucosinolate content of developing rapeseed(Brassica napusL.Midas) seedlings[J].Canadian Journal of Plant Science, 1988, 68: 367-380.
[9]RASK L, ANDREASSON E, EKBOM B, et al.Myrosinase: gene family evolution and hethivore defense in Brassieaeeae[J].Plant Molecular Biology, 2000, 42: 93-113.
[10]BONES A M, ROSSITER J T.The enzymic and chemically induced decomposition of glucosinolates[J].Phytochemistry, 2006, 67: 1053-1067.
[11]BURMEISTER W P, COTTAZ S, DRIGUEZ H, et al.The crystal structures ofSinapis albamyrosinase and a covalent glycosyl-enzyme intermediate provide insights into the substrate recognition and activesite machinery of anS-glycosidase[J].Structure, 1997, 5: 663-675.
[12]TAIPALENSUU J, ANDREASSON E, ERIKSSON S, et al.Regulation of the wound-induced myrosinase-associated protein transcript inBrassica napusplants[J].European Journal of Biochemistry, 1997, 247: 963-971.
[13]ANDERSSON D, CHAKRABARTY R, BEJAI S, et al.Myrosinases from root and leaves ofArabidopsis thalianahave different catalytic properties[J].Phytochemistry, 2009, 70: 1345-1354.
[14]MATUSHESKI N V, JEFFERY E H.Comparison of the bioactivity of two glucoraphanin hydrolysis products found in broccoli, sulforaphane and sulforaphane nitrile[J].Journal of Agricultural and Food Chemistry, 2001, 49: 5743-5749.
[15]SHEN Lianqing, SU Guangyao, WANG Xiangyang, et al.Endogenous and exogenous enzymolysis of vegetable-sourced glucosinolates and in fl uencing factors[J].Food Chemistry, 2010, 199: 987-994.
[16]朱磊.十字花科植物种子黑芥子酶酶学性质研究[D].北京: 北京化工大学, 2011.
[17]van EYLEN D, INDRAWATI, HENDRICKX M, et al.Temperature and pressure stability of mustard seed(Sinapis albaL.) myrosinase[J].Food Chemistry, 2006, 97: 263-271.
[18]李合生.植物生理生化实验原理和技术[M].北京: 高等教育出版社,2000: 184-185.
[19]BONES A M.Distribution ofβ-thioglucosidase activity in intact plants, cell and tissue cultures and regenerant plants ofBrassica napusL.[J].Journal of Experimental Botany, 1990, 41: 737-744.
[20]HALKIER B A, GERSHENZON J.Biology and biochemistry of glucosinolates[J].Annual Review of Plant Biology, 2006, 57: 303-333.
[21]刘贤娴.萝卜营养及风味物质积累规律研究[D].泰安: 山东农业大学, 2009.
[22]BLAŽEVIĆ I, MASTELIĆ J.Glucosinolate degradation products and other bound and free volatiles in the leaves and roots of radish(Raphanus sativusL.)[J].Food Chemistry, 2009, 113: 96-102.
[23]刘明春.榨菜加工过程中挥发性风味物质的形成及变化研究[D].重庆: 重庆大学, 2009.
[24]肖华志, 牛丽影, 廖小军, 等.芥末油、青芥辣、冲菜的挥发性风味成分的SPME/GC/MS测定[J].中国调味品, 2004(6): 42-45.
[25]吴春燕, 何启伟, 宋廷宇, 等.大白菜风味物质的气相色谱-质谱分析[J].食品科学, 2009, 30(4): 145-148.
[26]吴春燕, 何启伟, 宋廷宇, 等.白菜挥发性组分的气相色谱-质谱分析[J].食品科学, 2012, 33(20): 252-256.
[27]KENDREW S G.YUCCA: a flavin monooxygenase in auxin biosynthesis[J].Trends Biochemistry Science, 2001, 26(4): 218.
[28]COHEN J D, SLOVIN J P, HENDRICKSON A M.Two genetically discrete pathways convert tryptophan to auxin: more redundancy in auxin biosynthesis[J].Trends Plant Science, 2003, 8: 197-199.
[29]TAIPALENSUU J, ERIKSSON S, RASK L.The myrosinase-binding protein fromBrassica napusseeds possesses lectin activity and has a highly similar vegetatively expressed wound inducible counterpart[J].European Journal of Biochemistry, 1997, 250: 680-688.
[30]TAIPALENSUU J, FALK A, RASK L.A wound- and methyl jasmonate-inducible transcript coding for a myrosinase associated protein with similarities to an early nodulin[J].Plant Physiology, 1996,110: 483-491.

