聚酰胺色谱法分离油茶蒲提取物中抑制5α-还原酶的活性部位
郑茜茜,夏博能,沈 骏,吴晓琴,沈建福
(浙江大学生物系统工程与食品科学学院,浙江 杭州 310058)
5α-还原酶(5 alpha-reductase,EC1.3.99.5)是定位于靶细胞微粒体上的膜蛋白,依赖还原型辅酶ⅡNADPH作为供氢体,催化还原雄激素睾酮(T)转变为活性更强的双氢睾酮(dihydrotestosterone,DHT)[1]。5α-还原酶异常表达将会导致组织中DHT积聚,DHT含量过高会引起某些疾病如良性前列腺增生(benign prostatic hyperplasia,BPH)、多毛症、男性脱发等,其中BPH 的发病率在60岁男性中为50%,80岁以上男性中高达90%[2]。目前国内外临床上广泛使用非那雄胺(finasteride)、度他雄胺(dutasteride)[3]等作为治疗药物。该类药物的作用机制是通过抑制5α-还原酶活性,阻断DHT合成来治疗BPH,作为合成药物不仅价格较昂贵而且会产生一定副作用。近些年研究结果发现植物性多酚类、三萜类、甾体类等化合物对5α-还原酶有较强抑制活 性,目前临床已应用的天然5α-还原酶抑制剂有锯叶提取物棕(伯泌松)、非洲臀果木提取物(通尿灵)、油菜花粉提取物(前列康)、黑麦提取物(舍尼通)[4-6]等,从天然植物中筛选高效低毒的5α-还原酶抑制剂逐渐成为研究开发的热点。
油茶(Camellia oleiferaAbel.)是山茶科(Theaceae)山茶属(Camellia)木本植物,为我国重要的木本油料作物,油茶蒲为油茶果的外壳,约占油茶果总质量的2/3,为油茶加工废弃物[7],在振兴油茶产业的同时有效地开发利用油茶蒲等副产物具有积极的意义。本实验前期研究证实油茶蒲提取物(oiltea camellia extracts,OCE)对5α-还原酶具有很强的抑制活性[8],动物实验也证实OCE能有效改善大鼠前列腺增生症状[9],是5α-还原酶的高效抑制剂。
目前从天然植物中分离提取5α-还原酶抑制活性部位的研究大多数采用硅胶色谱法[10-14],采用聚酰胺色谱法进行活性部位筛选的研究国内外还未见相关报道。聚酰胺色谱法[15]是指以聚酰胺为吸附剂的吸附色谱法,包括薄层色谱法(thin layer chromatography,TLC)和柱色谱(column chromatography,CC)两大类。聚酰胺(polyamide)是通过聚酰胺基聚合而成的一类高分子化合物,分子中含有丰富的酰胺基,可与酚类、酸类、醌类、硝基化合物等形成氢键结合而被吸附,与不能形成氢键的化合物分离[16]。聚酰胺具有“双重色谱”的性能,特别适合用于分离黄酮、酚类和醌类等化合物,对鞣质具有极强的几乎不可逆的吸附作用,故可作为脱鞣方法[17]。本实验以5α-还原酶的抑制率为指针,采用TLC和CC分离,通过HPLC检测,筛选抑制5α-还原酶的活性部位,旨在为OCE中抑制5α-还原酶的关键化合物制备,及天然植物类5α-还原酶抑制剂开发提供科学依据。
1 材料与方法
1.1 材料与试剂
普通白花油茶蒲 浙江省常山县芳村镇;AB-8型大孔树脂 沧州宝恩树脂有限公司;聚酰胺(100~200 目) 上海源叶生物科技有限公司;聚酰胺薄层板(10 cm×20 cm,10 cm×10 cm) 北京京京未来科技发展有限公司;没食子酸标准品(纯度>99%)国药集团化学试剂有限公司;鞣花酸标准品(纯度>97%) 比利时Acros公司;3-O-甲基鞣花酸-4’-O-β-D-吡喃葡萄糖(3-O-methyl-D-glucopyranose,MEAG,纯度>95%) 实验室自制;乙腈、甲醇(色谱纯)美国Merk公司;其他试剂均为国产分析纯。
雌性SD大鼠3 只,体质量250~300 g 浙江大学紫金港动物中心。
睾酮(T)、烟酰胺腺嘌呤二核苷酸磷酸(nicotinamide adenine dinucleotide phosphate,NADPH)美国Sigma公司;1,4-二硫代苏糖醇(DL-dithiothreitol,DTT) 国药集团化学试剂有限公司;考马斯亮蓝试剂盒 南京建成生物科技有限公司。
1.2 仪器与设备
BS124S万分之一电子分析天平 德国Sartorius公司;RE-52A旋转蒸发仪 上海亚荣生化仪器厂;FD-1-50真空冷冻干燥机 北京博医康实验仪器有限公司;玻璃层析柱(Φ3.6 cm×40 cm)、BSZ-100自动部分收集器上海沪西分析仪器厂;XY层析缸(10 cm×20 cm)上海畅辉化工仪器有限公司;玻璃点样毛细管(内径0.3 mm) 华西医科大学仪器厂;Waters 2695高效液相色谱仪(配有2996 PDA检测器) 美国沃特世公司;Unitary Luna C18色谱柱(250 mm×4.60 mm,5 μm)北京华谱新创科技有限公司;Centrifuge 5810R高速离心机 德国Eppendorf公司;Himac CP-80β超高速离心机日本日立公司;T10BS25匀浆机 德国IKA公司;TU-1810型紫外-可见分光光度计 北京普析通用仪器有限责任公司。
1.3 方法
1.3.1 油茶蒲提取物的分离纯化
1.3.1.1 油茶蒲提取物的制备
将油茶蒲干燥,粉碎至60 目,用50%(V/V)乙醇溶液85 ℃(料液比1∶10)热回流提取2 h,过滤,滤液减压浓缩去除乙醇后上AB-8大孔树脂柱,以40%(V/V)乙醇溶液洗脱,收集洗脱液,减压浓缩,冷冻干燥,即可制得油茶蒲提取物(oiltea camellia extracts,OCE),总酚含量为(37.58±1.68)%。
1.3.1.2 聚酰胺薄层层析
聚酰胺薄层层析采用的展开剂为正丁醇-甲醇-水-冰醋酸(体积比为3∶2∶2∶1);显色剂为0.5 g/100 mL FeCl3-乙醇溶液。
将新鲜配制的展开剂加入到层析缸中,密闭放置15 min。用毛细管分别吸取适量供试液,以垂直方向小心接触薄层板面,做条带状点样,点样基线距底边1 cm,样品原点之间距离1.5 cm。将点样后的薄层板放入已达预平衡的层析缸中,密闭,上行展开,薄层板浸入展开剂中的深度要求溶剂的液面距原点约5 mm,展开至8 cm展距后,立即取出薄层板,晾干,以备检测。将已晾干的薄层板放入装有显色剂的容器中,待充分显色后取出晾干[18]。根据比移值Rf合并相近组分,分离部位分别减压浓缩干燥,称量Fr干基质量,进而计算各Rf值相近组分的得率。

式中:L为原点中心到谱带中心的距离/cm;L0为原点中心到溶剂前沿的距离/cm。

1.3.1.3 聚酰胺柱层析
聚酰胺预处理:用95%(V/V)乙醇溶液浸泡聚酰胺粉24 h,溶胀后湿法上柱。用3~4 倍柱体积的95%乙醇溶液洗至流出液透明为止,再依次用2.5 倍柱体积的5 g/100 mL NaOH水溶液、1 倍柱体积的蒸馏水、2.5 倍柱体积的10%(V/V)醋酸水溶液洗脱,最后用蒸馏水洗至流出液pH值呈中性,备用。
装柱:将颗粒状聚酰胺混悬于水中,使其充分膨胀,湿法上柱,装柱后液面必须高于树脂20~40 mm,让聚酰胺自由沉降,待稳定后用适量洗脱液冲洗树脂柱。
上样:将OCE充分溶解于适量洗脱 剂中,上样至经过预处理的聚酰胺树脂柱。
洗脱:用正丁醇-甲醇-水-冰醋酸(3∶2∶2∶1)混合液洗脱,流速1 mL/min,流出液每5 min分管自动收集。
1.3.2 高效液相色谱法(high performance liq uid chromatography,HPLC)检测
1.3.2.1 进样液制备
OCE及Fr1~Fr7用蒸馏水配成1 mg/mL溶液,用甲醇配制没食子酸标准贮备液(0.216 mg/mL),用二甲基亚砜配制鞣花酸标准贮备液(0.223 mg/mL),用甲醇配制MEAG标准贮备液(0.226 mg/mL),过0.45 μm滤膜后进样检测。
1.3.2.2 检测色谱条件
色谱柱:Luna C18(250 mm×4.60 mm,5 μm);柱温:25 ℃;进样量:10 μL;流速:1.0 mL/min;检测波长254 nm;流动相A:乙腈;流动相B:1%乙酸水溶液;梯度洗脱:0~8 min,5%~10% A;8~16 min,10% A;16~25 min,10%~15% A;25~30 min,15% A;30~35 min,15%~20% A;35~40 min,20% A;40~45 min,20%~5% A;45~50 min,5% A。
1.3.3 5α-还原酶的抑制活性检测
1.3.3.1 试剂的配制
睾酮溶液:精密称取36 mg睾酮,无水乙醇定容至25 mL,浓度为5 mmol/L。
NADPH四钠盐溶液:精密称取NADPH四钠盐42.5 mg,用蒸馏水溶解并定容至25 mL,浓度2 mmol/L。
提酶缓冲液:0.32 mol/L蔗糖,0.1 mmol/L DTT,1 mmol/L EDTA,20 mmol/L磷酸钠,pH 6.5。
反应液:1 mmol/L DTT,40 mmol/L磷酸钠,pH 6.5。
1.3.3.2 大鼠5α-还原酶的制备方法
取清洁级雌性SD大鼠3 只,禁食不禁水过夜后脱颈椎处死,取出肝脏冰台上剪碎。用预冷的缓冲液和玻璃匀浆器制成1∶5匀浆,4℃、10 000×g条件下离心15 min,取胞浆部分100 000×g条件下离心1 h,倒掉上清,沉淀即为粗微粒提取物。加入一定体积缓冲液,并用匀浆器进行匀浆悬浮。分装,-80 ℃冰箱保存。
1.3.3.3 5α-还原酶蛋白质含量测定
利用考马斯亮蓝试剂盒测定5α-还原酶悬浊液蛋白质的质量浓度(g/L)。
1.3.3.4 5α-还原酶抑制活性测定
2 mL反应体系中,睾酮20 μmol/mL,NADPH 40 μmol/mL,酶260 μg,在37 ℃反应液中反应4 min,248 nm波长处检测(睾酮溶液最大吸收波长,标准曲线y=0.009 9x+0.003 5,R2=0.999 6),抑制率的计算见下式。
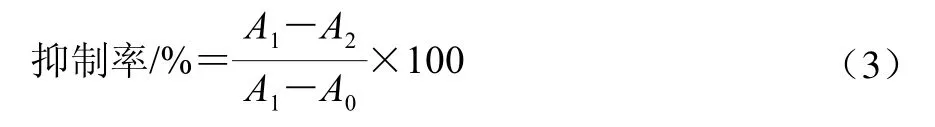
式中:A0为空白斜率(乙醇+NADPH+酶);A1为反应斜率(T+NADPH+酶);A2为样品斜率(T+NADPH+样品+酶)。
2 结果与分析
2.1 聚酰胺薄层层析结果
在薄层层析条件的摸索过程中,由于硅胶比聚酰胺对极性大的化合物吸附作用更强,样品TLC检测容易出现分离度不够(Rf≤0.48)、拖尾严重、谱带黏连等情况,故选择聚酰胺色谱法。当向展开剂体系中添加一定比例的冰醋酸后,可明显减少拖尾并改善谱带形状。原因在于冰醋酸的添加增加了展开剂的极性,抑制了化合物中羧基解离,从而有利于羧酸类化合物的展开[15],考虑到OCE总酚含量较高(37.58±1.68)%,所以推测OCE中含有一定量的酚酸类化合物。
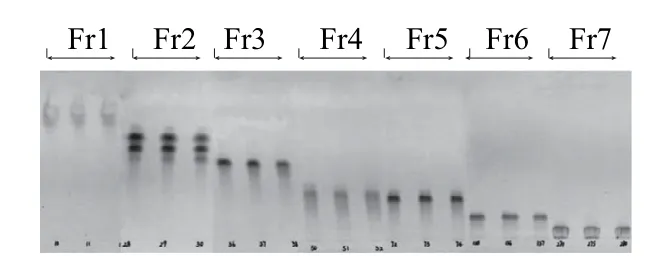
图1 油茶蒲提取物柱层析分离产物Fr1~Fr7的TLC图Fig.1 TLC pro file of Fr1 through FFrr7
参照1.3.1.3节柱层析方法,OCE上样8.00 g,柱层析洗脱后共收集410 管,总体积3 026 mL,回收率36.62%,经聚酰胺柱层析后得到7 个分离部位Fr1~Fr7。由薄层层析结果(图1)可知,OCE分离度显著,谱带清晰,无明显拖尾现象;Fr3、Fr5、Fr6只含单一谱带,Fr2含3 条谱带,Fr1、Fr4、Fr7所含化合物未得到有效分离。此外由表1可知,Fr1得率(20.02%)显著高于其他分离部位,Fr2得率(6.11%)次之,Fr4得率最低(仅为0.62%)。样品回收率较低是因为聚酰胺对鞣质具有极强的吸附作用,所以OCE中含有的大量鞣质被吸附在聚酰胺柱上未被洗脱,由5α-还原酶抑制率检测结果可知鞣质类化合物对5α-还原酶无显著抑制作用,因此用聚酰胺进行脱鞣处理,以利于OCE中活性成分的有效富集。
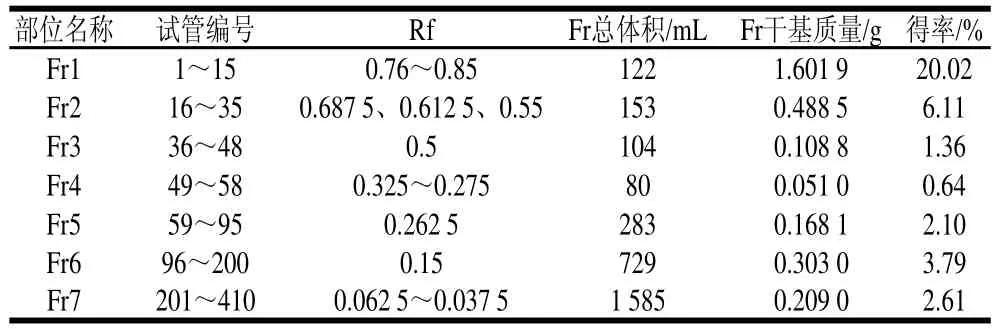
表1 油茶蒲提取物柱层析分离产物Fr1~Fr7Table 1 Column chromatographic separation of fractions Fr1 through Fr7 of OOCCEE
2.2 HPLC检测结果
2.2.1 标准品HPLC图
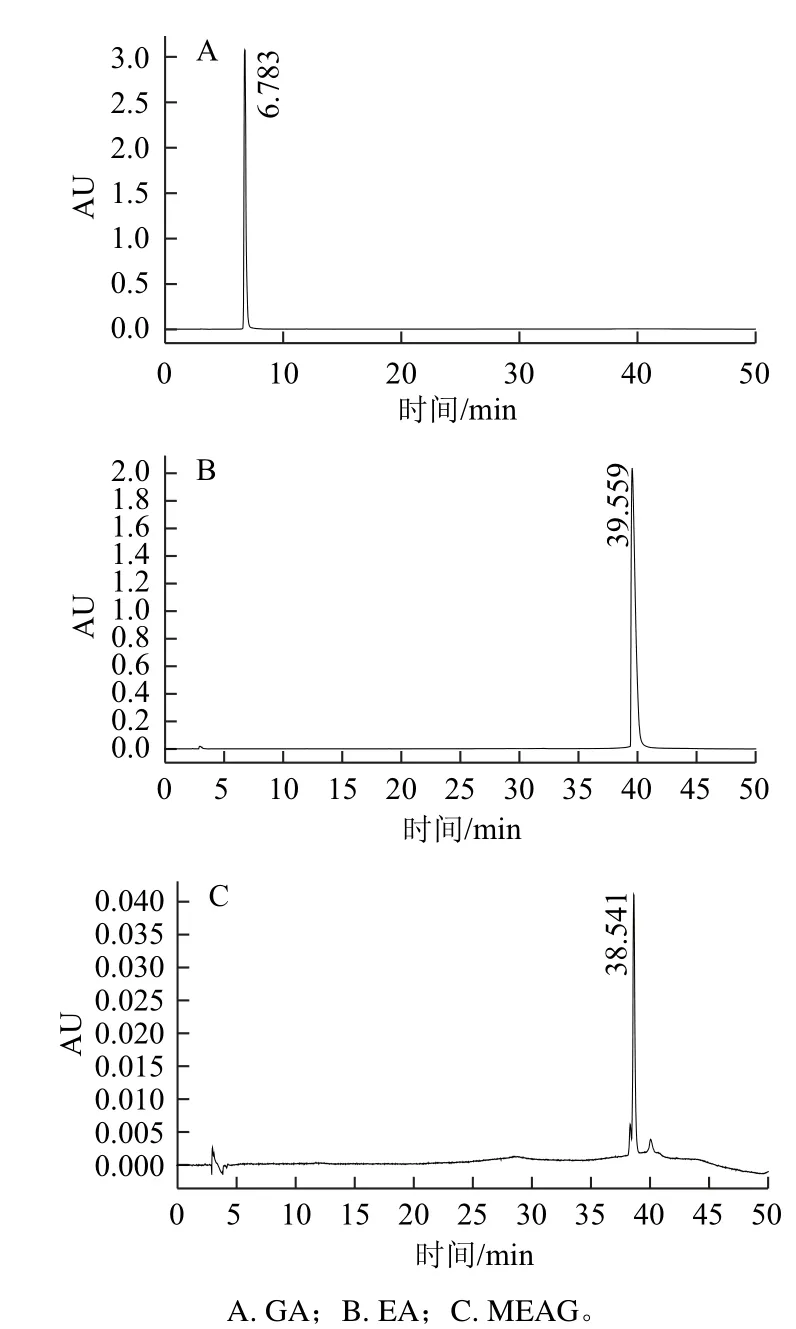
图2 标准品HPLC图Fig.2 HPLC pro file of standard substances
由图2所知,没食子酸(gallic acid,GA)、鞣花酸(ellagic acid,EA)、MEAG为OCE中主要特征酚类化合物,出峰时间分别为6.783、39.559、38.541 min。
2.2.2 Fr1~Fr7的HPLC图谱
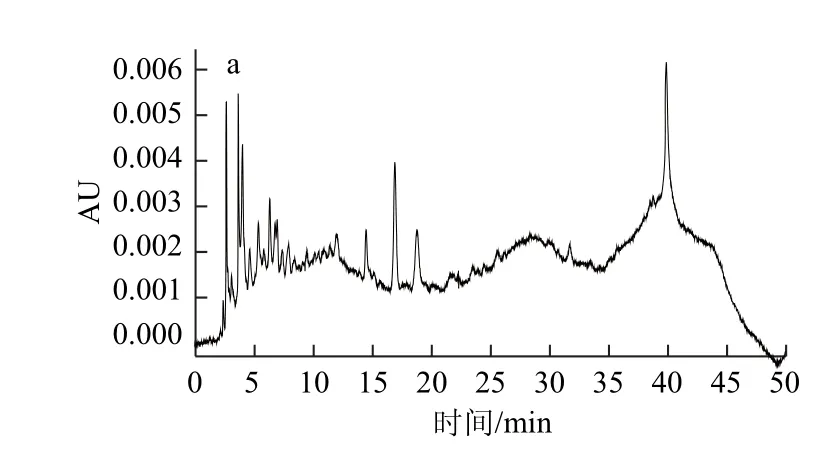

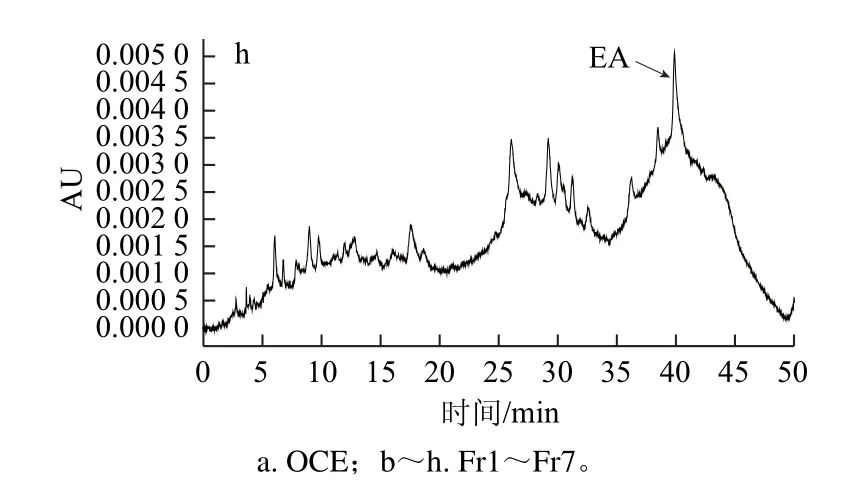
图3 Fr1~Fr7的HPLC图Fig.3 HPLC pro files of Fr1 through FFrr7
由图3可知,OCE、Fr1、Fr4、Fr7峰型多样,显示其组成较为复杂;Fr2、Fr3、Fr5、Fr6峰型较为单一,显示其组成较为简单,主要化合物的纯度较高;与标准品HPLC图对照,发现Fr2中含有GA,Fr7中含有EA,而Fr2、Fr3及Fr4均含有MEAG。
2.3 Fr1~Fr7的5α-还原酶的抑制活性
通过Fr1~Fr7对5α-还原酶抑制活性的检测,结果表明7 个分离部位中Fr4和Fr5的抑制活性最高,抑制率分别为(73.01±2.93)%和(76.28±1.37)%,比纯化前OCE的抑制率(57.79±1.67)%显著增加,其余4 个分离部位的抑制活性都不及OCE,说明OCE中具有高效抑制活性的关键化合物在Fr4和Fr5中得到了有效富集。由于Fr4得率仅为0.64%,明显低于Fr5的得率2.10%,且HPLC检测结果显示Fr4组成较为复杂,因此可以选择Fr5作为活性部位进一步制备抑制5α-还原酶的单体化合物。

图4 Fr1~Fr7的 5α-还原酶抑制率Fig.4 Inhibition rates of Fr1 through FFrr7 on 5α-reductase
液相图谱显示Fr2中没食子酸和MEAG的峰面积所占百分比分别为13.63%和80.18%,但Fr2抑制率(39.43%)低于OCE;Fr7中鞣花酸的峰面积所占百分比为35.12%,但Fr7抑制率(50.72%)也低于OCE。图4结果表明没食子酸、鞣花酸及MEAG的抑制率均在15%以下,显著低于OCE的抑制率(57.79%)。由上述推测OCE中抑制5α-还原酶的关键化合物并不是没食子酸、鞣花酸及MEAG。这与Hirano等[19]从娑罗双属树的心材中分离得到5 种鞣质类化合物中没食子酸和鞣花酸对5α-还原酶没有抑制活性(5α-还原酶剩余活性分别为99%和97%)的结果吻合。
3 结 论
应用聚酰胺色谱法能够有效分离纯化OCE中抑制5α-还原酶的活性部位。分离纯化得到的7个部位中Fr4和Fr5抑制活性最强,抑制率分别为(73.01±2.93)%和(76.28±1.37)%,较OCE纯化前的抑制率(57.79±1.67)%显著增加,其中Fr5得率为2.10%,组成较为单一,这为进一步制备OCE中抑制5α-还原酶的关键化合物奠定了基础。
Hiipakka等[20]通过体外酶学实验和细胞实验研究了多酚类物质对5α-还原酶抑制的结构-活性关系,结果发现大多数酚类物质(尤其异黄酮、黄豆苷、染料木黄酮和山萘酚)对5α-还原酶具有较强的抑制活性。油菜花粉、仙人掌、何首乌、交趾黄檀、知母、朝鲜当归、高良参、杨梅树皮等提取物均分离出相应的活性化合物[21-23]。课题组前期研究表明,OCE中多酚类物质含量较高(37.58±1.68)%,而且多酚类物质的含量与其5α-还原酶的抑制率成正相关[24],因此OCE中5α-还原酶抑制的关键化合物极有可能是多酚类物质。
天然产物活性成分的层析分离技术中应用最广泛的是硅胶色谱法。硅胶吸附分离原理是根据物质在硅胶上的吸附力不同而得到分离,一般情况下极性较大的物质易被硅胶吸附,极性较弱的物质不易被硅胶吸附,因此极性小的混合物体系适合用硅胶柱等正相吸附剂来分离[25]。以酚酸类化合物为主的油茶蒲提取物(OCE)极性较强,再加上羧基是极性很大的取代基,易解离成盐,与硅胶吸附较强,所以OCE在用硅胶薄层层析(TLC)做成分预试时极易被硅胶死吸附,造成样品损失严重及分离效果不理想(Rf≤0.48,谱带黏连,严重拖尾)。
适合强极性化合物分离的吸附材料有聚酰胺、反相硅胶、葡聚糖凝胶等,但是反相硅胶、葡聚糖凝胶价格较为昂贵,对于上样量较大的样品分离最好选用聚酰胺。聚酰胺对于黄酮、蒽醌等多羟基酚性化合物的吸附分离效果要明显优于硅胶。聚酰胺吸附分离原理是通过分子中酰胺基的羰基与酚类化合物中的羟基形成氢键而被吸附,与不能形成氢键的化合物分离,特别适合多元酚类化合物的分离[26]。而且聚酰胺对鞣质具有极强的几乎不可逆的吸附作用,满足本实验中除鞣质的需求(没食子酸、鞣花酸、MEAG不具有显著5α-还原酶抑制活性),从而使活性成分得到有效富集。因此聚酰胺色谱法较硅胶色谱法更适合分离强极性的酚酸类混合物体系。
[1]孙洁, 赵维, 向华, 等.非甾体类5α-还原酶抑制剂研发近况[J].药学进展, 2011, 35(10): 450-455.
[2]NEELIMA D, DEEPAK B.Benign prostatic hyperplasia: an overview of existing treatment[J].Indian Journal of Pharmacology, 2011, 43(8):6-12.
[3]CONNOLLY S, ITZPATRICK J.Medical treatment of benign prostatic hyperplasia[J].Postgra duate Medical Journal, 2007, 83(3):73-78.
[4]CHO C H, BAE J S, KIM Y U.5α-Reductase inhibitory components as antiandrogens from herbal medicine[J].Journal of Acupuncture and Meridian Studies, 2010, 3(1): 116-118.
[5]JONAS A, ROSENBLAT G, KRAPT D, et al.Cactus fl ower extracts may prove beneficial in benign prostatic hyperplasia due to inhibition of 5α-reductase activity, aromatase activity and lipid peroxidation[J].Urological Research, 1998, 26(14): 265-270.
[6]HIDEAKI M, NORIKO S, MIHO Y, et al.Testosterone 5α-reductase inhibitory active constituents fromAnemarrhenae rhizoma[J].Biological and Pharmaceutical Bulletin, 2001, 24(3): 586-587.
[7]李利敏, 沈建福, 吴晓琴.八种油茶蒲提取物中活性物质含量及其抗氧化能力的比较研究[D].杭州: 浙江大学, 2013: 12-16.
[8]陈秋平.油茶蒲减肥降脂功能因子研究[D].杭州: 浙江大学, 2011:2-5.
[9]罗晓伟.油茶蒲醇提取物抑制5α-还原酶及对前列腺疾病的作用[D].杭州: 浙江大学, 2011: 39-45.
[10]HAN H Y, SHAN S, ZHANG Z, et al.Down-regulation of prostate specific antigen in LNCaP cells by flavonids from the pollen ofBrassica napusL.[J].Phytomedicine, 2007, 9(14): 338-343.
[11]MASTUDA H, YAMAZAKI M, MATSUO K, et al.Anti-androgenic ativity of myricae cortex-isolation of active constituents from bark of myrica rubra[J].Biological and Pharmaceutical Bulletin, 2001, 24(3):259-263.
[12]陈莲君.油菜蜂花粉活性成分的提取及结构鉴定[D].无锡: 江南大学, 2012: 8-25.
[13]LIU J, KENJI K, KUNIYOSHI S, et al.Structure-activity for inhibition of 5α-reductase by triterpenoids isolated fromGanoderma lucidum[J].Bioorganic & Medicinal Chemistry, 2006, 2(14): 8654-8660.
[14]SUPHROM N, PUMTHONG G, KHORANA N, et al.Antiandrogenic effect of sesquiterpenes isolated from the rhizomes ofCurcuma aeruginosaRoxb.[J].Fitoterapia, 2012, 83: 864-871.
[15]严拯宇.中药薄层色谱分析技术与应用[M].北京: 中国医药科技出版社, 2009: 1-60.
[16]徐任生, 赵维民, 叶阳.天然产物活性成分分离[M].北京: 科学出版社, 2012: 49-264.
[17]何丽一.平面色谱方法及其应用[M].北京: 化学工业出版社, 2005:25-42.
[18]国家药典委员会.中华人民共和国药典中药材薄层色谱彩色图集[M].北京: 人民卫生出版社, 2009: 1-12.
[19]HIRANO Y, KONDO R, SAKAI K.5α-reductase inhibitory tanninrelated compounds isolated fromShorea laeviforia[J].The Japan Wood Reseaech Society, 2003, 49(4): 339-343.
[20]HIIPAKKA R A, ZHANG H Z, DAI W, et al.Structure-activity relationships for inhibition of human 5α-reductase by polyphenols[J].Biochemical Pharmacology, 2003, 63(5): 1165-1176.
[21]刘本, 常忆凌, 陈科力.5α-还原酶作为天然药物筛选靶的研究进展[J].药物生物技术, 2006, 13(9): 468-470.
[22]程芳, 陈光亮.植物药治疗良性前列腺增生的研究进展[J].安徽医药, 2009, 13(11): 1316-1317.
[23]NEWMAN D J, CRAGG G M.Natural products as sources of new drugs over the last 25 years[J].Journal of Natural Products, 2007,70(2): 461-477.
[24]罗晓伟, 沈建福, 肖仁显.油茶蒲提取物中次生代谢产物的测定[J].食品工业科技, 2011, 11(6): 451-453.
[25]薛扬, 吴唯.聚酰胺树脂的层析分离应用[J].化工新型材料, 2005,33(4): 50-53.
[26]方小燕.聚酰胺树脂在分离纯化黄酮中的应用研究[J].海峡药学,2013, 25(5): 41-42.

