网络方法在食品体内功能定量化评价中的应用
庞广昌,陈庆森,胡志和,解军波,马丽娜
(1.天津商业大学生物技术与食品科学学院,天津市食品生物技术重点实验室,天津 300134;2.天津商业大学理学院,天津 300134)
尽管对于食品的功能性问题,存在很多争议,例如食品的功能主要应该是为机体提供生存和生命活动必须的营养,但是功能性食品及其功能研究还是越来越成为食品科学的重要研究领域,因为越来越多的研究结果表明:食品决不仅仅为机体提供生存所必需的营养,它同时也是机体学会如何适应周围的物质世界并作出响应和适应的基础。也就是说,食品不仅为机体提供物质和能量,更重要的是为机体提供信息。但是,在功能性食品的功能性研究中,我们遇到了几个重大难题。1)虽然营养不足会造成相应的营养缺陷症,但是当营养过剩时也会造成肥胖、高血压、高血脂、糖尿病甚至癌症等现代文明病;这个问题不仅表明了食品科学,特别是功能性食品研究的重要性,同时也给我们提出了一个难题:不同个体、不同民族的饮食习惯、家庭背景、甚至不同的肠道微生物都对机体的营养需求产生不同作用。尽管针对这些问题的发展和蔓延,已经提出了个性化营养和试图针对不同的个体基因组提供不同营养配方的营养基因组学研究思路,但是表观遗传学研究却用大量的实验结果告诉我们:一个人的饮食习惯和经历也可以通过DNA印迹和组蛋白复杂的修饰作用,塑造和改变其表观遗传特性,而且可以传代。这实际上相当于告诉我们:并非基因组决定我们的饮食需求,可能恰恰相反,饮食在不改变DNA序列的情况下决定基因组的表达、调控、修饰、记忆和遗传,显然这是对营养基因组学的致命性挑战。于是问题又回到了原点:如何为不同的个体提供科学饮食和食品配方?2)食品和营养对免疫系统的作用是显而易见的,也是功能性食品研究的热门领域,但是近年来的大量研究表明,机体的营养似乎优先保证免疫防御系统的运行,只有在婴幼儿、老年人、疾病状态或营养严重缺陷时才会出现免疫力低下。换言之,在营养充分,甚至普遍过剩的今天,往往表现出免疫过强并由此导致炎症、自身免疫性疾病和代谢综合征。所以免疫学研究成果一再告诫我们:免疫是一把双刃剑,免疫力低下会导致反复感染,但是免疫力过强会导致炎症、超敏反应等自身免疫性疾病。问题是什么是适当的免疫?如何定量化功能性食品对免疫的作用?尽管已经积累了大量有关食品的免疫调节作用,包括食品对细胞因子的作用,但是由于至今没有一个适合于免疫这一复杂系统的定量化方法,即使得到一些实验结果,也难以提供一个确切的指导意见和结论,甚至往往互相矛盾、含糊其词地得出一个几乎放之四海而皆准的结论:“具有重要的免疫调节作用”。这些结论除了能够发表文章以外,难以得出指导性意见,甚至误导消费者。3)实验方法上的突出问题是:我们往往沿用医药领域对药物的实验和药效评价方法,亦即用离体实验或实验动物致病模型来对食品的功能进行评价,这实际上犯了一个简单的逻辑错误,因为食品不是用来治病,而是用来维护机体健康和预防疾病。我国明文规定:保健食品不可标记治疗作用。而且,对于这些离体实验和病理模型动物所得出的实验结果我们可以相信吗?因为人毕竟不同于动物。理由很简单,不同食性的动物食用同样的食品其后果也不同,就像牛羊可以吃草,而人类不能吃草一样。之所以用实验动物做食品的功能实验,主要是因为有些人一直认为:食品对机体的健康保护(治疗)作用需要通过对相应组织或器官进行测定才能对其保护(治疗)作用进行评价。既然需要取组织甚至器官,当然不能通过人,只能通过动物。显然,要想用人对食品的功能进行评价,就必须解决无损检测这一难题。4)食品只能通过胃肠道消化后才能吸收,不能吸收的就要排出体外。食品究竟是如何对机体内的器官或组织发挥生物功能?至少需要弄清楚:是通过直接进入机体达到靶器官或组织,还是通过作用于机体的胃肠黏膜系统,从而影响免疫、代谢、内分泌系统?已经有大量研究结果证明:食品和营养主要是通过和胃肠黏膜系统的相互作用,继而通过胃肠道和机体内的循环系统和信号系统在器官和组织之间建立通信并发挥功能,而不是直接进入靶器官或靶组织发挥作用。但是,如何对这一复杂的非线性系统进行定量化描述就成了不得不面对的一个重大难题。本文将针对这些问题,在综合国内外相关研究进展,特别是作者课题组近10年的研究成果的基础上提供一个综述和解决方案。
1 功能性食品及其主要作用机制
由于近年来现代文明病的流行和泛滥,促使很多科学家,特别是细胞和分子生物学领域的科学家对食品、营养和饮食健康问题产生了极大的兴趣,特别是在饮食对胃肠系统微生态的作用、营养吸收与控制的信号途径、非营养成分——植物化合物(phytochemicals)受体及其信号传递、胃肠道对神经内分泌系统的作用、胃肠黏膜免疫及其作用机制等方面进行了大量的研究,并取得了举世瞩目的成就。
1.1 胃肠系统的信号传递及神经传导功能
大量研究结果证明,胃肠道系统可以通过植物神经和脑神经中枢紧密联系在一起,并发现很多神经系统的疾病与饮食密切相关。大脑通过食欲控制进食的机制已经积累了大量研究成果,并说明大脑对饮食和营养的传感作用除食物的颜色是直接通过光学信号传递以外,嗅觉、味觉和饱腹感信号传递都是通过受体和食物中的嗅觉成分、味觉成分和营养与非营养成分的相互识别,经过这些弱相互作用信号在细胞内的级联放大作用,改变细胞的钙离子通道、钠钾泵活性,从而通过传感细胞释放定量的电化学信号,刺激附近的神经末梢,进而将复杂的嗅觉、味觉、营养和非营养信号传递到大脑,通过大脑控制食欲和进食过程[1]。已知这些受体中最重要的受体家族就是G蛋白偶联受体(G protein-coupled receptors,GPCRs),它们因为都是通过其胞内结构域和G蛋白信号的级联放大和传递途径相偶联而得名。G蛋白信号放大系统和糖代谢、脂代谢、蛋白质代谢等多条代谢途径交互作用,控制着机体的神经、内分泌、免疫和生理代谢等几乎所有生物功能。已知GPCRs是1个有上千个基因成员组成的超家族,不仅分布在视觉、嗅觉、味觉器官或组织,而且也分布在胃肠道系统、白细胞和循环系统,控制几乎所有真核生物的营养吸收、免疫、代谢和内分泌活性[2]。
1.2 营养吸收及其调节机制
人类要生存,就必须满足机体的营养需求。从进化的角度看,最原始的多细胞动物——腔肠动物,必须能够传感周围物质世界的结构和功能,确定是否可以吸收这些营养作为它们的碳源和氮源,以便依赖新陈代谢而生存。它们没有发达的大脑,也没有复杂的神经系统,但是它们可以准确传感周围可利用的营养,特别是脂肪、葡萄糖和氨基酸等基本营养成分。近10年期间,已经获得并鉴定了多种肠上皮细胞受体和传递体介导这些信号的传递,并进一步证明营养传感并不仅仅发生在舌和鼻咽部,而是整个胃肠系统。胃肠道似乎可以使用复杂而精致的受体系统来区分食物糜中不同成分的特性和浓度。而且这些传感受体沿胃肠道分布,对摄取的食品做出定量化响应。虽然有大量的GPCRs参与胃肠道(gastrointestinal,GI)对食品的吸收与“侦察”,但是对单独营养的传感可以激活多种互相交叉的信号途径。而且,一个细胞上存在多种受体,激活细胞内不同的信号途径,例如:多种受体都可以激活G蛋白信号级联放大系统。可见机体可能正是通过这些复杂的受体和配体(基)之间的弱相互作用激活传感细胞内的结构域,并通过信号途径之间的“交谈”实现输出信号的定量化。已知GPCRs在糖、氨基酸、脂肪、氯化钠等营养的传感、吸收和定量化和食欲控制中发挥重要作用。正是GPCRs在味觉,特别是嗅觉信号传感中极大的多样性构成了生物各自不同的获取营养的方式和渠道,占据不同生态位。
1.3 非营养成分的作用途径
近年来,来自饮食的植物化合物(phytochemicals,PhC)对健康的保护作用得到了学术界的高度重视。人们早就注意到,来自果蔬等植物的这些化合物虽然不是经典意义上的糖、脂肪和氨基酸等“大营养”,其健康作用则不容忽视。而且,已经证明它们在健康保护、抗癌、防癌,特别是预防现代文明病方面表现出巨大的应用潜力。研究发现,它们主要通过和受体相互作用向机体、组织和细胞传递信号。PhC涉及的受体主要是:Toll样受体(Toll-like receptors,TLRs)、GPCRs和雌激素受体(estrogen receptors,ERs),其中雌激素受体属于核受体,包括:脂调节过氧化物酶体增殖因子激活受体(lipid-regulating peroxisome proliferatoractivated receptors,PPARs)、肝脏X受体(the liver X receptor)、法呢醇X受体(farnesoid X receptor)和孕甾烷核受体(the pregnane nuclear receptor,PXR);所涉及的信号途径主要有:磷酸肌醇3激酶(phosphoinositide 3 kinase,PI3K)、丝裂原-活化蛋白激酶(mitogenactivated protein kinase,MAPK)、蛋白激酶C(protein kinase C,PKC);所涉及的转录因子主要包括:Nrf2、活化因子蛋白-1(activator protein-1,AP-1)、核因子κB(nuclear factor κB,NF-κB)等[3]。不同信号途径之间互相“交谈”从而构成了非常复杂的信号调控网络。机体复杂的生命活动,特别是免疫和防御活动依赖于体温升高、代谢增强,特别是中心代谢途径所涉及的酶活性的协调增强,从而为细胞和机体提供能量。与此同时,不可避免地造成对自身的伤害,也就是过头的免疫应答,这可能也正是现代文明病的重要病因。值得注意的是,几乎所有PhC都表现出抑制炎症,下调先天免疫、获得性免疫、分解代谢和内分泌[4]。可见,当今维护人类健康的主体是下调免疫,而不是增强免疫。
1.4 肠道微生态的复杂作用及其调节机体健康的途径
近年来,肠道微生物、益生元(prebiotics)和微生态研究取得了举世瞩目的成就。已经证明,肠道菌群的构成在宿主健康和生命活动中发挥重要作用。2012年,科学杂志就肠道微生物和健康的关系发表了系列综述,从生态学、基因组学、代谢组学、免疫学和大众健康等多角度综述了肠道微生物与健康和疾病的关系[5]。Costello等[6]着重强调了肠道微生物的种类和多样性及其与肠黏膜系统的互作,以便更清晰地了解肠共生动力学和生态理论,了解饮食习惯与微生态变化和稳定性的关系。Lemon[7]则重点考察了抗生素治疗所造成的微生态破坏,以及如何通过益生元进行修复的问题。Nicholson等[8]提出,肠道微生物也是宿主代谢系统的参与者,它们受饮食中营养的影响,反过来又影响机体的代谢网络。Haiser等[9]综述了肠道微生物对医药和食品在代谢上的相互作用和影响。Hooper等[10]则重点讨论了肠道微生物与宿主免疫的关系,以及肠道微生物对保持肠道内平衡的作用。不论从哪个方面看,肠道微生物菌群和宿主之间在代谢、生理、内平衡和免疫相互作用都是复杂的,非线性的。例如:到底是饮食结构塑造了肠道微生物,还是肠道微生物塑造了宿主的微生态?显然可能都有作用。因为饮食结构显然是肠道微生物的重要培养基,而肠道微生物和宿主共同形成的代谢组又对机体营养吸收与代谢平衡发挥重要作用。需要想强调的是:宿主的免疫系统对肠道微生物菌群的作用也是不可忽视的,因为炎症反应的发起者是宿主而不是肠道微生物。
遗憾的是,面对如此复杂的系统,除微生物种群和遗传多样性以外,至今还没有一个定量化的方法来描述微生物和宿主在代谢、免疫、生理、内分泌等复杂相互作用。原因是面对如此复杂的非线性系统,我们似乎束手无策。幸运的是,如果翻过来分析:无论微生物在肠道中和食物以及宿主发生多么复杂的相互作用,必需通过作用于宿主体内的神经、代谢、免疫和内分泌才能发挥作用,那么,只要能够对饮食所产生的结果,建立机体内细胞间无线通讯网络作用的定量化模型就能解决这一难题。
2 神经内分泌生理代谢调节的复杂性和非线性问题
越来越多的研究结果表明,食品——特别是功能性食品对机体神经内分泌和生理代谢有明显的影响,这也正是把免疫失调、慢性炎症、糖尿病、高血脂、肥胖、糖尿病等归纳为生活方式症的原因所在。厌食、暴饮暴食、抑郁、狂躁、孤独等疾病也被公认饮食不当或食欲控制失调所造成的疾病。慢性结肠炎、克隆氏病和老年痴呆也与饮食有密切关系。已有调查和研究结果表明,上述病人往往伴随着细胞因子异常、激素和内分泌失调等症状发生。但是,由于其作用过程、途径、分子机制、代谢复杂性及其相互作用,构成了一个非线性复杂体系,至今难以建立定量化研究方法和数学模型。
2.1 免疫和细胞因子网络的交互作用控制复杂的免疫防御系统
口服疫苗的成功提示我们,肠道可能是最重要的天然免疫接种系统。特别是肠道上的微皱折细胞(M细胞)介导可以完整抗原进入PP结(peyer’s patches);树突状细胞(dendritic cells,DCs)作为取样细胞负责提取肠道内腔中的抗原,并进行处理,自身转变为成熟细胞,迁移进入引流淋巴结;肠上皮下的抗原递呈细胞(antigen presenting cells,APC)则负责处理并提呈抗原决定簇给原态Th0细胞,从而构成机体免疫识别肠腔中食物和微生物的分子基础[11]。病原体模式识别受体-TLRs则通过识别食物中的病原体模式分子激活或抑制炎症细胞因子,如白细胞介素(IL-1、IL-6)、干扰素(IFN-δ)和肿瘤坏死因子(tumor necrosis factor,TNF)的释放,这些炎症细胞因子既是激活先天免疫的前提条件,又是产生获得性免疫的必经途径[12]。
2.2 细胞因子和激素共同控制复杂的代谢内分泌系统
毫无疑问,生命活动需要能量,而能量则以分解代谢、氧化磷酸化为基础。不难想象:所有生命活动,特别是以白细胞为基础的免疫防御系统的运行都需要能量供应,需要分解代谢。但是代谢是一个复杂的网络,由多种酶催化和协调控制。其中任何一种酶都不可能控制整个网络的协调增强或减弱。什么条件可以保证整个代谢网络协调改变?当然只有温度,也就是体温这一重要的状态函数。所以免疫防御系统的激活和抑制必然伴随分解代谢的增强或减弱、体温的升高和降低、以及分解代谢、呼吸和氧化磷酸化的上调或下调。本质上这些正常生命活动调节的基础显然依赖于饮食和胃肠道营养吸收及其与食物的相互作用。胃肠黏膜系统不仅是机体选择性控制和吸收营养的场所、免疫调节和黏膜免疫屏障基础,而且也是机体最大的免疫及内分泌系统。近年来的大量研究证据表明:胃肠系统拥有最大的淋巴系统——肠相关淋巴组织和内分泌系统——胃肠激素分泌系统。在胃肠黏膜系统和各个重要器官之间存在着密切的通信联系[13]。
胃肠系统的食物、微生物通过和胃肠黏膜受体之间复杂(直接或间接)的相互作用向机体内发送信号:细胞因子、趋化因子和激素(各种肠激素),这些信号分子通过循环系统传递到各器官、组织或细胞,它们在接到信号后还可以再发出相同或不同的信号传递给其他细胞,从而形成一个由自分泌、旁分泌和内分泌构成的局域或全局性的细胞通讯网络。胃肠黏膜系统至少有400 m2的面积,不仅是机体最大的防御系统,也是最大的信息、物质(营养)和能量交流系统。它以分泌细胞因子、趋化因子和激素作为通讯的信号分子,通过循环系统实现机体内细胞间无线通讯网络。同时该网络控制和调节机体的神经、生理、免疫、内分泌和代谢网络。
激素对代谢内分泌系统的控制已经得到了充分的研究和证实,细胞因子除了控制先天免疫、获得性免疫、免疫平衡外,对代谢也发挥非常重要的控制作用。一个重要的问题是:为什么机体的免疫防御作用总是和炎症、体温升高相伴?这个问题从能量的角度进行分析就变得很清晰:免疫防御作用需要大量的能量来保证其生物活性,特别是白细胞的动员、趋化到达靶位点(部位)及其对靶细胞的杀伤作用。这一切都需要能量的不断补给和保证。而细胞的能量当然来自代谢,特别是分解代谢和氧化磷酸化。动员机体的能源物质(肝糖原、肌糖原)需要内分泌系统的配合,同时需要经过相应代谢网络中所有酶活性的协调提高。能使分解代谢中所有酶的活性同时提高的只有体温。所以机体的免疫,特别是先天免疫应答过程一定伴随着体温的升高和分解代谢的增强。除此之外,机体本身的能量贮存也对分解代谢控制发挥重要作用:当能量(主要以脂肪的形式贮藏在皮下,特别是腹部)储存超过一定的界限时,机体也会随时拉响(由mTOR所发动)“需要增强能量消费”的警报。可见肥胖、糖尿病、高血脂甚至癌症等现代代谢综合征的原因也正是机体调节能量储存和消费的一种应激机制[14]。有趣的是,当机体接收到病原体入侵信号时就会激活机体的炎症反应,升高体温,激活免疫防御系统,但是,为了防止炎症反应所带来的自身损伤,同时也启动抗炎症信号,其作用在于:一方面可以将炎症反应严格控制在安全范围内;另一方面,一旦完成了免疫防御作用可以随时关闭炎症反应,如图1所示。这些细胞因子、趋化因子和激素在机体中通过自分泌、旁分泌和内分泌形成一个复杂的网络,表现为极端的复杂的非线性,尽管定量化测定这些作用非常迫切,但是至今没有一个能够真正实现定量化描述的数学模型。

图1 炎症和抗炎症平衡调节Fig.1 The balance between inflammatory and anti-inflammatory reactions
病原体所诱发的信号途径通过对IκB的磷酸化和泛素化解除其对NF-κB的控制,起动NF-κB转入细胞核,转录炎症细胞因子,促使机体通过发炎,亦即提高体温激活免疫防御系统,发挥免疫应答和防御作用,但是与此同时NF-κB也会促进IκB的转录与表达,除非有持续的入侵信号刺激IκB的降解,否则新合成的IκB就会通过将NF-κB扣押在胞浆中,不再启动炎症细胞因子的转录和表达。除此之外,还有:SOCS、IL-10和TGF等多种机制控制炎症细胞因子的表达,防止过头的炎症反应。
3 网络和网络方法在生物学领域异军突起
网络研究方法的应用在几乎整个生命科学领域中产生了一场革命。生物大分子(DNA、RNA、蛋白质,如转录因子)之间互作网络的研究结果已经改变了生命科学诸多领域,特别是分子生物学领域的各个方面,如:科学家的思维方式、技术路线和研究思路[15-16]。尽管已经在Nature、Science和Cell等顶尖杂志上不断发表研究和综述性论文,尽管在多种模式生物,特别是酵母菌中进行了全局性分子互作网络的研究,并得出若干几乎可以颠覆性的结论,但是生命活动的基本单位并不是这些大分子本身,而是细胞[17]。所有的生物活性分子都必需通过细胞发挥其生物学功能。遗憾的是,虽然科学家早就意识到高等动物除存在一个以脑为中心的神经网络,它控制着机体的运动和神经活动以外,一定还存在着一个控制代谢、内分泌和免疫防御系统的无线通信网络,但是到目前为止对这些网络的研究还处于一般的文字表述水平。
根据来自动物、植物和微生物的大量代谢研究结果,已经绘制出细胞的代谢网络。但是这张代谢网络图只是根据化学结构、酶、化学平衡和自由能等参数推测而来,并非体内或细胞内的真实情况。最先通过网络和化学剂量学方法对代谢网络进行研究的是生物化工领域,主要目的是通过对代谢网络进行通量及其控制分析获得更大产量的代谢产物。但是随着研究的不断深入,发现在通过模式微生物,如大肠杆菌进行代谢网络的通量控制分析时,并不像生物化学家所预料的那样存在着限速步骤和限速酶。这实际上已经宣布:很多生物化学和分子生物学推测在现实中并不存在。当我们要了解体内代谢网络及其控制时,必需重新进行实际检测。随基因操作、基因芯片等高通量检测技术、核磁共振技术等的不断发展与应用,代谢网络研究取得了举世瞩目的进展[18],从网络理论来看,细胞中蛋白之间相互作用,代谢相互作用、信号相互作用和转录相互作用可以构成网络,这些网络的相互作用形成“网中之网”(network of networks),这些网中之网负责机体、器官、组织和细胞的行为。网络生物学的主要任务是要集成理论和实验来绘制出这些网络,从而以定量的形式搞清楚生命活动的动力学和拓扑学特性。
近来,一种半自动的酵母菌双杂交筛选生物芯片技术(stemi-autmated yeast two-hybrid screens)[19]和生物分子互作的SPR技术可以使科学家测定生物大分子是何时并如何相互作用的。这些研究已经揭示出细胞内分子互作网的建筑学特性就如同互联网、计算机芯片和社会网络。Jeong等[20]利用SAYTHS技术研究了43种生物的细胞代谢网络得出:1)它们都是无标度(scale-free)的、强健的和容错(error-tolerant)的,也就是抗干扰的网络。2)具有小世界(small-world)特性,任何两个节点都可以有少量的代谢反应(连接点)与其连接。3)高度连接的是底物而很少连接的则是种属特异性酶的产物[20]。4)生物网络都是统计异质的,也就是说不同的节点由不同的连接数k,复合倍数定律分布(the power-law distribution(P(k)≈kγ)),在这样的网中,新的节点偏向于和已经连接了节点的节点连接。此种网即强健又具有抗出错能力。5)所有已测定的43种生物的代谢网络的结构和规模都是一样的。6)所有已测定的生物的平均连接数目(两个节点之间的连接数目)都意外地相近,在3左右。7)如果一种底物(节点)由于催化其反应的酶的突变而突然降低,则很快就可能有一条最短的生化代谢途径和少数新酶的表达,通过更大的网络半径来补救,这显然相似于互联网中的TCP/IP协议。8)大肠杆菌代谢网络计算机模拟和在体突变(in silico and in vivo mutagenesis)研究表明,细胞可以耐受若干代谢酶的删除。9)拥有最多连接的节点也就是“hubs”在所有已测生物中都是相同的。
蛋白质之间的互作网(protein-protein interaction network)研究表明[21-22],无标度网有惊人的抗意外损伤的能力,即使80%的随机选定的节点断裂,保留的20%仍能形成互联簇,使任何两个节点间保持连接。当然,这一特征依赖于hubs。在酵母菌中,0~10%的蛋白质少于5个连接,大于60%的多于15个互连(互相作用),这表明蛋白的互连度在决定缺陷基因表型中具有重要作用,只有约18.7%的酵母基因(约14.4%的大肠杆菌基因)缺失使细胞致死。很多大肠杆菌的基因同时缺失甚至不会发生任何表型变化。证明很多基因在无标度网中是可以互相替代的。图2为酵母菌蛋白互作网。
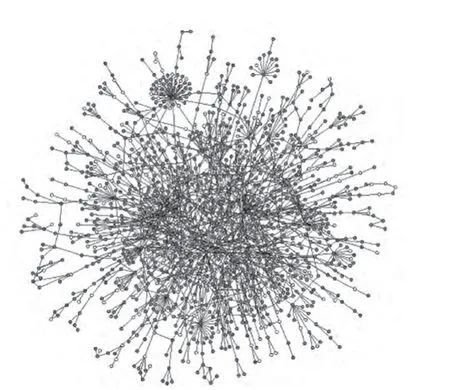
图2 酵母菌蛋白互作网[[2233]]Fig.2 Yeast protein-protein interaction network[23]
该图依据早期酵母双杂交测定结果绘出[23]。该图表明只有很少高连接的节点,也就是hubs。其中最大的簇含有所有蛋白的约78%。节点的色度表示移去相应蛋白之后的表现型[24]。已经测定到7 048种蛋白质之间具有相互作用,其互作评价也已经搞清楚。在蛋白互作网中,高度互作的蛋白占总互作蛋白(4 679)的66%。
各代谢途径中基因的相关性和互作也有大量的研究报道[25],图3显示出了基因互作和代谢途径的关系。
Ihmels等[26]根据自己和他人的资料进行了层次模块分析,其结果见图4。细胞网络的这些研究成果促使科学家不得不从新的角度来看待生命科学研究。通过细胞网络研究,人们可以应用各种分子生物学技术,数学、拓扑学、网络知识从整体上,从生物分子的相互作用上观察和研究生物及其基本生命活动单位——细胞。大量的研究结果显示出,细胞内的生物网络属于无标度网(scalefree network)和分级网(hierarchical network),这种网络具有很强的自稳定、抗干扰和进化能力。通过将细胞中的各种组分连接成网络,我们可以研究细胞系统的自组织、自稳定、自调整和细胞的整体结构、功能和行为。细胞的生物网络研究成果同时也对基因操作和生物工程提供了重要的理论依据。这提示我们:生物很少有单基因性状,尤其是面对复杂非线性系统时,必需从系统和网络的观点来设计操作方案,重点要考虑影响系统稳定性的关键因素,如hubs。

图3 同一代谢途径中蛋白(酶)基因的相关性[[2266]]Fig.3 The correlations among protein (enzyme) genes of the same metabolic pathways[26]

图4 代谢网络的层次模块[[2266]]Fig.4 The Hierarchical module of the metabolic network[26]
4 机体内细胞间无线通讯网络的建立
笔者早在2006年[27-28]根据大多数功能性食品和药物虽然不能进入体内,但可以发挥重要的生物学功能(最为典型的是可食性纤维)的事实和当时的国内外有关免疫学研究进展提出:食品或药物主要是通过和胃肠黏膜系统的受体进行相互作用诱导机体产生细胞因子、趋化因子或激素,从而影响和改变机体的免疫和生理功能。本课题组通过大量实验建立了相应的实验方法,通过一系列实验结果证明:食品——特别是功能性食品——的确是通过改变机体的细胞因子、趋化因子和激素发挥生物功能[29-37]。但是当我们面对进食功能性食品后,多种细胞因子都有显著性变化的实验结果时,也必须面对另一个问题:这些细胞因子的显著变化到底意味着什么?有什么生物学意义?细胞因子、趋化因子和激素历来是医药、生物化学及子生物学研究的热门领域,几乎每一种细胞因子都具有无数多种功能,但是这些功能都是在不同条件、不同场合下所发挥的,例如IL-6既具有促炎功能,也具有抗炎功能,还具有调节脂肪酸代谢的功能。如果仅仅是为了写文章,似乎可以依照个人意愿和想象力列出其相应的功能,但是其真实作用和实际意义到底是什么我们却不得而知或者说仅仅是推测和想象而已。
显然,要解决这些问题,必需澄清一个重要的逻辑问题:生物功能的最小单位到底是细胞还是分子?或二者皆是?回答当然是细胞而不是分子。分子只能通过细胞发挥生物学作用。于是在此基础上笔者所在的课题组针对酪蛋白酶解肽所产生的显著性变化的细胞因子通过当时的数据库检索出分泌这些细胞因子的细胞和这些细胞因子作用的靶细胞,并通过这两个矩阵的运算建立起由这些细胞因子所形成的机体内细胞间无线通讯网络的变化情况[38-39]。这是一个有向加权网络,也是机体内天然存在的细胞间无线通讯网络。它和由神经纤维所构成的神经网络不同,神经网络实质上属于有线连通网络,只能形成以脑为中心,和固定的组织、器官之间的神经纤维通讯,传递的是电信号(神经兴奋),速度快,但是不能实现移动细胞(例如血液中的红细胞、白细胞)、组织和器官之间的通信。无线通讯网络的通信介质,亦即信号分子是细胞因子、趋化因子和激素,其传播动力是循环系统,发送信号依赖于信号分子的合成与分泌,接收信号依赖于细胞表面的受体,放大信号则要靠细胞内的信号级联放大系统。值得强调的是,该网络不仅可以实现器官、组织和固定细胞之间的通讯,而且可以实现移动细胞之间,以及移动细胞和固定细胞之间的通讯[40]。其实这个无线通讯网络并不陌生,通常所说的细胞因子网络本质上就是由信号发起者细胞合成与分泌细胞因子,经过循环系统运送到带有其特异性受体的靶细胞所构成的细胞间的通讯网络。实际上细胞因子在发送过程中并没有分子间的相互作用,细胞因子本身不可能构成网络。最早对这个以细胞因子作为信号分子所形成的细胞通讯网络进行建模和分析的是Frankenstein等[41],通过对细胞因子的数据库进行收集与分析,建立起一个复杂的细胞通讯网络。同时还比较了当时所公布的100个不同的网络研究结果,发现免疫细胞之间通过细胞因子所构成的通信网络的密度最高,达0.61,比猴脑的神经网络密度0.15高得多。排在第二位的是免疫细胞和非免疫细胞之间通过细胞因子所构成的通讯网络,密度为:0.40。
5 机体中代谢网络及其研究方法
代谢网络及其通量控制分析主要在模式生物,如酵母菌中进行,这是因为需要通过基因操作才能实现代谢途径中不同酶的定量化表达与合成,从而得出各自对通量的控制作用(通量控制系数),而要得到足够多有关代谢途径中酶的不同表达并进行通量控制分析几乎是不可能的,因为催化代谢,特别是中心代谢途径的酶的突变体往往是致死性的或者由于其调节酶特性和容错能力造成表型上的无反应。而且通量控制分析需要在稳态的条件下进行,显然这是通量控制分析主要停留在模式生物的主要原因。笔者发现:只要改变细胞或动、植物机体的环境温度,就可以将代谢网络中所有酶的合成量变成变量,再通过其对通量(变量)的数学处理,即可以进行代谢网络的通量控制分析。课题组从2003年开始进行代谢网络,特别是中心代谢途径的通量及其控制分析研究,已经先后对水稻、瑞士乳杆菌、螺旋藻、蟾蜍、黄鼠、人类、哈密瓜进行了代谢网络的通量控制分析[42-44],并充分证明了通过通量及其控制方法对食品的体内作用进行评价的可行性。在此基础上,课题组通过志愿者分析了食用不同温、凉、寒、热、平属性的食品所引起的体内乳酸代谢的通量变化,发现:乳酸通量可以作为机体分解代谢和氧化磷酸化的一个重要指标,凡热性食品都会增加其通量,而凉、寒性食品则降低乳酸通量(尚未发表的材料)。因此,通过代谢网络的通量及其控制分析可以定量化描述食品对体内分解和合成代谢的控制作用。显然这在普遍存在营养过剩和生活方式病的今天具有非常重要的研究意义和应用价值。有趣的是,由代谢及其通量所构成的网络与上述机体内细胞间无线通讯网络一样也属于有向加权网络[45],可见有向加权网络可能正是生命活动的主体和主旋律。
6 有向加权网络模型为复杂非线性问题提供了一系列定量化方法
虽然有关脑神经网络的研究由来已久,但是网络研究真正成为研究热点则是由于互联网络的建立、完善和推广应用。通过网络不仅把地球变成了一个实际上的“地球村”,而且网络实质上已经成为一门数学,一种哲学和一种新的思维、推理方法,网络方法和系统方法已经应用于通信、信息、生物、生态、社会、经济和政治等各个领域。特别是网络方法可以为复杂非线性系统提供多角度的量化方法。
在生命科学领域,现有的研究工作主要是通过构建无向无权网络,如:代谢网络[46-47]、蛋白互作网络[48-49]、蛋白结构免疫球蛋白网络[50]和有向无权网络,如:神经网络,模拟和分析生物复杂系统的发展和演化规律。然而,在生物学各领域中普遍存在的却是有向加权网络,例如代谢网络、群体之间所形成的食物链、微生态系统所形成的群络等。很少有研究同时考虑权重和方向(即基于有向加权网络开展研究),原因之一就是已有数据不支持构建有向加权网络来模拟和分析生物复杂系统。
由于生物系统,往往面对的是多变量、非线性、复杂体系,所以其定量化问题始终是一个最大的难题。在食品和医药领域,虽然已经有很多离体研究成果,但是根本不可能用这些成果进行精确的体内作用推测,因为体内是一个非常复杂的多变量非线性体系。面对这一复杂的非线性系统,尽管包括数学家在内的科学家已经进行过不懈的努力,但是至今并没有一个公认的量化方法。只有网络方法给我们展示了广阔的解决这些难题的希望。
虽然对于有向加权网络已经有一些文章发表,但是总体上还处于初级阶段。笔者所在的课题组最近提出了出度、入度、总度,出权重、入权重、总权重,出聚类系数、入聚类系数、总聚类系数和最短路径等数学模型。特别是聚类系数,既考虑了节点之间相互作用的方向也考虑了相互作用的强度,是一个比较科学的定量化刻画这种网络的指标。有向加权网络可以简化为无向无权网络,换言之,无向无权网实质上只是有向加权网络的简化形式(尚未发表的材料)。总之,网络,特别是有向加权网络方法可以从不同的角度为复杂的非线性系统提供一系列定量化参数。在食品或药物的体内、外生物功能的定量化研究、动力学评价、胃肠道微生态、代谢等目前最重要的研究领域提供了新的定量化研究途径和解决方案。
7 通过外周血可以实现食品功能的无损伤检测
一个非常值得思考的问题是:为什么食品功能不能通过人而只能通过动物实验来检测?显然,人和人之间对食品的功能都不一样,何况人和动物?生态学家早就告诉我们,不同的动物占据不同的生态位,主要源于其取食方式,如捕食与被捕食的关系。而且,尚无任何一种动物和人具有相似的食性,更不要说相同的基因型。体外实验所得出的结果和结论当然对人的参考价值非常有限。近年来,动物模型被大量用于功能性食品或功能因子的功能性评价,这些方法原封不动地照搬了医药学研究领域。但是我国明确规定:功能性食品不能标注治疗作用,于是经过动物模型所做的实验的实际意义是什么?是为了治病还是防病?可见在食品科学领域照搬医药学实验方法从根本上是行不通的。食品的目的是为了获取生存所需要的营养、维护机体健康,而不是为了治病。换言之,食品是所有人生存的基础,而药物则是治病。当然,另一个不可回避的问题是:功能性食品只有吸收到体内才能发挥功能吗?事实上,几乎所有的食品都必需经过胃肠系统的消化才能被吸收,蛋白质要消化成氨基酸或二肽、三肽;淀粉要消化为葡萄糖;脂肪要消化为脂肪酸和甘油;核酸要消化为核苷酸。不消化成和自身基本营养成分相同的物质就不能被吸收,特别是亲水物质包括:钠、钾离子都不能随便进入机体。为什么?因为机体必须保证自身的独立性和稳定性。显然,食品营养以外的功能,至少主体上并不是通过进入体内发挥作用,而是通过和胃肠道系统复杂的相互作用发挥功能,特别是可食性纤维、多糖、多肽和大多数水溶性成分,当然也包含肠道微生物及其代谢产物。这本来是经过大量实验证明了事实,但是在食品功能性评价研究中却经常被忽略。再一个问题是:对哪个脏器有作用,就需要摘取那个脏器进行功能评价吗?例如,评价醋的护肝作用,就需要制造肝损伤模型,然后取肝脏进行评价?这显然正是食品只能用实验动物进行评价的重要原因。难道有心病的人真的只有把心掏出来化验才能证明其心病是否存在吗?奇怪的是,这种简单的逻辑错误在国内外食品科学领域的论文里大量地存在甚至发展。机体是一个由脑神经网络和循环系统作为信号传递系统的体内细胞间无线通信网络所构成,在脏器之间,例如胃肠道系统和其他器官、组织和细胞之间传递信号,根本不需要任何外来成分的参与,通过细胞因子、趋化因子和激素可以传递任何信息包括发育、分化、功能调节、代谢调节、生理调节等。换言之,通过循环系统中这些信号分子的测定,理论上可以获得所有生物功能和生理信息。而所有这些信号分子的测定已经积累了海量的研究数据和高通量的测定方法。更值得一提的是:这些信号分子的测定只需要2~3 mL外周血,也就是说:基本上属于无损伤检测。最后一个问题是:以往的大多数功能性食品评价实验往往需要至少3~4周的动物实验(例如小鼠实验),而小鼠的寿命只有2年左右,4周相当于小鼠寿命的1/24,相当于人的3~4年。功能性食品真的需要吃那么长的时间才能发挥作用吗?如此长时间食用同一种功能性成分很可能造成机体的耐受性,或偏性。为了弄清楚食品发挥作用的规律,本课题组已经进行过系统研究,结果证明:食品发挥最大功能的时间是在食用后2.5~3.0 h,而且最适当的检测时间是下午的2点半到3点。为了最大限度地避免基因型和遗传背景所造成的误差,人们往往选择纯系小鼠作为实验动物,但是这却很难适用于食品功能评价,因为没有哪一种动物和人的基因型完全吻合。只要不再认定护肝作用只能摘取肝脏来进行评价,只要能够通过采集少量的外周血就能够建立起机体内细胞间的无线通信网络,就可以通过志愿者进行真正意义上的食品功能评价。而且完全可以通过同一个人食用不同的食品来进行评价,这样可以有效避免基因型所造成的偏差。
8 结 语
科学家梦寐以求,要解决复杂非线性系统的定量化问题,但这一直是传统数学的极大挑战。脑神经网络、互联网络的发展不仅改变了整个科学,也改变了人们的生活方式甚至思维方法。网络方法已经成为一种数学和哲学方法,为复杂非线性系统的定量化提供了一套近乎完美的科学方法。网络方法已经被大量用来研究DNA、RNA、蛋白等分子互作,取得了大量成果,大大改变了该领域前沿科学家的认识和思维方式,甚至正在引发分子生物学领域的革命。在代谢领域,通过代谢网络的研究,可以大大减少代谢组学所面对的变量上极大的复杂性和多样性,在生物化工和生物技术领域则已经产生了巨大影响和广泛应用。功能性食品的功能性评价是一个充满争议和挑战的领域,笔者所在的课题组经过多年努力,已经建立了一套适合于食品和药物体内功能评价的方法:体内细胞间无线通信网络评价方法。由于该网络属于有向加权网络,所以可以参考生物大分子互作网络——无向无权网络模型和有向加权代谢网络模型,引入多种参数,可以从多个不同角度定量刻画这种网络。食品和营养代谢密切相关,笔者所在的课题组已经成功创建了适合于研究人机体内中心代谢途径的通量和通量控制分析方法,可以定量化研究食品对机体内合成与分解代谢的作用,从而为食品对机体合成与分解代谢的功能评价提供了一个定量化研究方法。值得注意的是围绕中心代谢途径所形成的代谢网络同样可以将通量转化为加权值,反应方向作为有向性,从而将代谢网络转变为有向加权网,用有向加权网络模型进行定量化描述。由于这两种网络全部是通过采集适量的外周血进行测定,近乎无损伤检测,从而为实现功能性食品的定量化功能性评价提供一种新的近乎无损检测的定数量化方法。
到目前为止的大部分食品营养和功能评价是通过实验动物作出的,还有一部分是离体实验结果,对人类本身的功能评价却很少,多数来自调查。所以一系列适合于人类食品营养及其功能评价方法的建立、完善和推广具有极其重要的意义,相信上述体内细胞无线通讯网络和代谢通量控制网络模型的建立与完善在食品或医药的体内功能评价方面必将发挥举足轻重的作用。除此之外,有向加权网络是无向无权网络的扩展形式,具有更普遍的意义和适用范围。肠道微生态系统、果蔬表面微生态系统、动物、植物和微生物生态系统、捕食与被捕食者以及社会上人和人之间的关系实际上都可以构成有向加权网络,该网络模型为复杂非线性体系提供了一个从不同的角度进行定量化刻画的解决方案,具有广阔的应用前景。
[1]庞广昌, 陈庆森, 胡志和, 等.五味调与营养平衡及其信号传导[J].食品科学, 2012, 33(13): 1-20.
[2]REIMANN F, TOLHURST G, GRIBBLEI F M.G-Protein-coupled receptors in intestinal chemosensation[J].Cell Metabolism, 2012,15(4): 421-431.
[3]O’LONE R, FRITH M C, KARLSSON E K, et al.Genomic targets of nuclear estrogen receptors[J].Molecular Endocrinology, 2004, 18(8):1859-1875.
[4]庞广昌, 陈庆森, 胡志和, 等.食品非营养成分发挥生物学作用的信号通路[J].食品科学, 2010, 31(19): 1-24.
[5]GORDON J I, HONOR T H Y, Gut symbionts redux[J].Science,2012, 336: 1251-1253.
[6]COSTELLO E K, STAGAMAN K, DETHLEFSEN L, et al.The application of ecological theory toward an understanding of the human microbiome[J].Science, 2012, 336: 1255-1262.
[7]LEMON K P, ARMITAGE G C, RELMAN D A, et al.Microbiotatargeted therapies: an ecological perspective[J].Science Translational Medicine, 2012, 137: 137-145.
[8]NICHOLSON J K, HOLMES E, KINROSS J, et al.Host-gut microbiota metabolic interactions[J].Science, 2012, 336: 1262-1267.
[9]HAISER H J, TURNBAUGH P J.Is it time for a metagenomic basis of therapeutics?[J].Science, 2012, 336: 1253-1255.
[10]HOOPER L V, LITTMAN D R, MACPHERSON A J.Interactions between the microbiota and the immune system[J].Science, 2012,336: 1268-1273.
[11]黄栩林, 庞广昌.食品作用于肠黏膜免疫系统可能的信号途径[J].食品科学, 2008, 29(11): 717-722.
[12]庞广昌.食品免疫论[M].北京: 科学出版社, 2008.
[13]PANG Guangchang, XIE Junbo, CHEN Qingsen, et al.How functional foods play critical roles in human health[J].Food Science and Human Wellness, 2012(1): 26-60.
[14]庞广昌, 陈庆森, 胡志和, 等.过度营养与人体代谢和疾病关系的研究进展[J].食品科学, 2013, 34(15): 373-396.
[15]VIDAL M, CUSICK M E, BARABASI A L.Interactome networks and human disease[J].Cell, 2011, 144: 986-998.
[16]ADITYA S, DASGUPTA B, KARPINSKI M.Algorithmic perspectives of network transitive reduction problems and their applications to synthesis and analysis of biological networks[J].Biology, 2014, 3: 1-21.
[17]BRENNER S.Sequences and consequences[J].Philosophical Transactions of the Royal Society, 2010, 365: 207-212.
[18]BARABÁSI A L, OLTVAI Z N.Network biology: understand the cell’s functional organization[J].Nature Reviews Genetics, 2004, 5:101-113.
[19]ITO T, CHIBA T, OZAWA R, et al.A comprehensive two-hybrid analysis to explore the yeast protein interactome[J].Proceedings of the National Academy of Sciences, 2001, 98: 4569-4574.
[20]JEONG H, TOMBOR B, ALBERT R, et al.The large-scale organization of metabolic networks[J].Nature, 2000, 407: 651-654.
[21]RAVASZ E, SOMERA A L, MONGRU D A, et al.Hierarchical organi-zation of modularity in metabolic networks[J].Science, 2002,297: 1551-1555.
[22]JEONG H, MASON S P, BARABÁSI A L, et al.Lethality and centrality in protein networks[J].Nature, 2001, 411: 41-42.
[23]VOGELSTEIN B, LANE D, LEVINE A J.Surfing the p53 network[J].Nature, 2000, 408: 307-310.
[24]UETZ P, GIOT L, CAGNEY G, et al.A comprehensive analysis of protein-protein interactions in Saccharomyces cerevisiae[J].Nature,2000, 403: 623-627.
[25]GAVIN A C, BÖSCHE M, KRAUSE R, et al.Functional organization of the yeast proteome by systematic analysis of protein complexes[J].Nature, 2002, 415: 141-147.
[26]IHMELS J, LEVY R, BARKAI N.Principles of transcriptional control in the metabolic network of Saccharomyces cerevisiae[J].Nature Biotechnology, 2004, 22: 86-92.
[27]庞广昌, 陈庆森, 胡志和.食品是如何通过细胞因子网络控制人类健康的(I)[J].食品科学, 2006, 27(5): 258-264.
[28]庞广昌, 陈庆森, 胡志和.食品是如何通过细胞因子网络控制人类健康的(II)[J].食品科学, 2006, 27(6): 260-270.
[29]LI Haiping, LIU Xiaojuan, LI Yang, et al.Effects of the polysaccharide from Pholiota nameko on human cytokine network in serum[J].International Journal of Biological Macromolecules, 2012, 50: 164-170.
[30]XIE Junbo, GUO Li, PANG Guangchang, et al.Modulation effect of semen ziziphi spinosae extracts on IL-1b, IL-4, IL-6, IL-10, TNF-a and IFN-c in mouse serum[J].Natural Product Research, 2011, 25(4): 464–467.
[31]郭丽, 庞广昌, 曾梦霞.酪蛋白水解肽对家兔细胞因子的影响[J].食品科学, 2008, 29(6): 649-653.
[32]王连芬, 庞广昌, 白玉.螺旋藻蛋白的胃蛋白酶酶解肽对细胞因子的影响[J].食品科学, 2008, 29(10): 563-567.
[33]王连芬, 庞广昌, 米小媛.螺旋藻蛋白水解物对小鼠血清中细胞因子的影响[J].海洋科学, 2008, 32(10): 51-55.
[34]李杨, 庞广昌, 于立琴.牛初乳中的IgG对肠黏膜免疫系统调节的初步研究[J].食品科学, 2009, 30(17): 297-301.
[35]于立芹, 庞广昌, 李珍珍.普洱茶对主要发炎和抗炎细胞因子的影响[J].食品科学, 2008, 29(7): 428-431.
[36]于立芹, 庞广昌, 戴懿.乳酸对主要发炎和抗炎细胞因子的影响[J].食品科学, 2007, 28(12): 439-442.
[37]庞广昌, 于立芹, 马田野.食品-家兔体温-免疫调节的因果关系研究[J].食品科学, 2008, 29(10): 568-574.
[38]HUA Yanjun, PANG Gangchang.Cellular communication network modeling method based on cytokines[C].2011 International Conference on Network Computing and Information Security.2011:441-445.
[39]滑艳君, 庞广昌, 郭丽.口服酪蛋白复合肽对细胞通讯网络的作用[J].食品科学, 2010, 31(17): 310-317.
[40]庞广昌, 陈庆森, 胡志和, 等.食品与机体中的移动通讯网络[J].食品科学, 2010, 31(21): 1-9.
[41]FRANKENSTEIN Z, ALON U, COHEN I R.The immune-body cytokine network defines a social architecture of cell interactions[J].Biology Direct, 2006, 1: 32.
[42]王芳, 庞广昌, 王景川.螺旋藻β-胡萝卜素代谢控制分析及其新方法的研究[J].食品科学, 2011, 32(7): 237-243.
[43]王景川, 庞广昌.螺旋藻β-胡萝卜素代谢通量调控规律的研究[J].食品科学, 2009, 30(1): 236-241.
[44]王景川, 庞广昌.乳酸代谢通量调控规律的研究[J].食品科学,2009, 30(21): 246-251.
[45]ALMAAS E, KOVÁCS B, VICSEK T, et al.Global organization of metabolic fluxes in the bacterium Escherichia coli[J].Nature, 2004,427: 839-843.
[46]WATTS D J, STROGATZ S H.Collective dynamics of ‘small-world’networks[J].Nature, 1998, 393: 440-442.
[47]JEONG H, TOMBOR B, ALBERT R, et al.The large-scale organization of metabolic networks[J].Nature, 2000, 407: 651-654.
[48]JEONG H, MASON S, BARAB´ASI A L, et al.Lethality and centrality in protein networks[J].Nature, 2001, 411: 41-42.
[49]HAKES L, PINNEY J W, ROBERTSON D L, LOVELL S C.Proteinprotein interaction networks and biology: what’s the connection? [J].Nature Biotechnology, 2008, 26: 69-72.
[50]MILO R, ITZKOVITZ S, KASHTAN N, et al.Superfamilies of evolved and designed networks[J].Science, 2004, 303:1538-1542.

