改性硅藻土对脂肪酶固定化研究*
刘媛媛,郑永杰,田景芝
(齐齐哈尔大学化学与化学工程学院,黑龙江齐齐哈尔161006)
改性硅藻土对脂肪酶固定化研究*
刘媛媛,郑永杰*,田景芝
(齐齐哈尔大学化学与化学工程学院,黑龙江齐齐哈尔161006)
以改性硅藻土为载体,采用吸附法对脂肪酶进行固定化。对固定化条件进行优化。得到较佳的固定化条件:固定化时间为4h;温度为40℃;pH值为7.5;固定化酶在40℃下保温2h后酶活损失很小,固定化酶重复性达到最佳状态。
改性硅藻土;固定化;脂肪酶
脂肪酶(lipase,EC 3.1.1.3,甘油酯水解酶)是具有酰基基团可做生物催化剂的一种水解酶,在医药[1]、食品加工[2]、生物能源[3]上有广泛的应用。但是游离酶不易回收,很难反复利用,限制了其大规模应用。固定化酶可有效反复使用,使工业生产降低成本[4];吸附法的优势在于工艺简单,操作条件温和、不易破坏酶分子的高级结构以及活性中心的构象,酶活回收较高;张军等[5]对18种不同的无机和有机载体对脂肪酶进行固定化,发现硅藻土是比较好的固定化载体。
脂肪酶在载体表面的吸附数量取决于它们之间的静电平衡[6,7]。在对脂肪酶固定化时我们发现由于受孔径的限制,不是所有的多孔载体都能应用于酶的固定化,相反,如果想获得高负载酶量和保持高酶活力得率,对载体内部的几何结构的要求是肯定的。但是硅藻土原矿杂质较多、理化结构存在缺陷,这些因素极大地限制了硅藻土吸附性能的发挥。
本文采用焙烧法[8]先对硅藻土进行改性,在高温环境下,硅藻土表面羟基会发生对硅藻土吸附性有很大影响的转化。再用碱浸法对硅藻土进行提纯,改性硅藻土固定化脂肪酶对酶活、反复利用率上有很大程度提高。
1 实验部分
1.1 材料及仪器
脂肪酶(lipase)(10万U·g-1,阿拉丁试剂);橄榄油(A.R.);硅藻土(阿拉丁试剂);NaH2PO4,Na2HPO4均为分析纯,国药集团化学试剂有限公司;聚乙烯醇(PVA)(中国医药集团上海化学试剂厂);石油醚(A.R.)。
TU-1900双光束紫外可见分光光度计(北京普析通用仪器有限责任公司);DZF-6020真空干燥箱(上海一恒科学仪器有限公司);AR1140/C电子分析天平(奥豪斯仪器(上海)有限公司);Nicolet6700傅立叶变换红外色谱仪(美国尼高力仪器公司);KQ3200E超声波清洗器(昆山市超声仪器有限公司);S-4300场发射扫描电子显微镜(日本日立公司);SHA-C水浴恒温振荡器(金坛市中大仪器厂)。
1.2 实验方法
1.2.1 脂肪酶酶液配制将脂肪酶溶于pH值为7的缓冲溶液中,用实验室高剪切分散乳化机搅拌,抽滤,取上清液定容,配制一定浓度的酶液。
1.2.2 脂肪酶水解活力的测定采用橄榄油乳化法测定游离脂肪酶和固定化脂肪酶的活力。脂肪酶在一定条件下能使甘油三酯水解成脂肪酸等,用标准碱进行中和滴定,用pH计确定反应终点,根据消耗碱量,计算酶活力。
1.2.3 脂肪酶蛋白质含量测定紫外可见分光光度计法是利用物质的分子或离子对某一波长范围的光的吸收作用,对物质进行定量、定性分析。在紫外可见光的范围内,对于一个特定的波长,溶液的吸光度与吸光物质的浓度、液层厚度乘积成正比,即Lambert-Beer定律。
Lambert-Beer定律显示吸光度与吸收池厚度成正比,与溶液浓度成正比,即
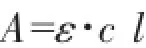
式中A:吸光度;ε:摩尔吸光系数;c:溶液浓度,mol·L;l:液池厚度,cm。
可以通过这个定律在扫描光谱中的最大吸收波长来对脂肪酶溶液进行定性分析。此文用TU-1900双光束紫外可见分光光度计来测定固定化酶量,游离酶的含量。
1.2.4 硅藻土的改性
硅藻土的焙烧改性:硅藻土在300、450、600℃培烧2h进行热活化,再在105℃下活化1h,干燥冷却,即得到不同温度焙烧改性硅藻土。在相同条件下固定化脂肪酶,活性最高者所对应的温度为最适温度。选取该条件下热活化的硅藻土进行碱浸处理。
硅藻土的碱浸处理:将清洗后的载体放入60℃的1mol·L-1NaOH水溶液中孵育1h,超纯水清洗3次,室温晾干。
1.3.5 固定化脂肪酶的制备在一定浓度,一定pH的酶液中加入改性硅藻土,搅拌均匀,恒温水浴震荡一定时间后,抽滤,用石油醚清洗固定化的载体3次,使载体颗粒分散均匀,抽真空干燥。
2 结果与讨论
2.1 载体对固定化酶活影响
A是未改性硅藻土,A1、A2、A3分别是300、450、600℃培烧改性硅藻土,B是先经450℃焙烧后碱浸的改性硅藻土。对不同载体固定脂肪酶进行酶活测定。以不同种类硅藻土做横坐标,固定化酶活为纵坐标做图1。

图1 不同改性硅藻土对酶活影响Fig.1 Different modified diatomite enzyme and immobilized enzyme activity
由1图可知,改性后硅藻土对于脂肪酶酶活有一定程度提高。
2.2 固定化酶学性质
2.2.1 温度对酶活的影响酶的本质是一种蛋白质,受这种属性的影响,温度对酶的影响非常敏感,在其他条件相同的情况下,温度是可以改变载体的吸附量,而且蛋白质在高温中会变质。温以酶活最高者为100%,以温度为横坐标,以相对酶活为纵坐标作图2。
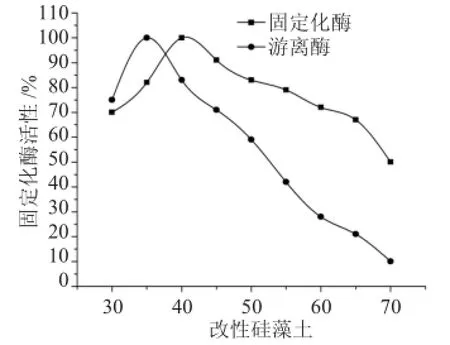
图2 温度对游离酶和固定化酶活性影响Fig.2 Temperature effect on the free on enzyme activity effect
由图2可见,在30~70℃这个范围内进行温度对游离态的脂肪酶和固定化的脂肪酶活性进行研究,游离酶在30~35℃这个温度范围内活性呈上升趋势的,35℃达到活性最高,35~70℃活性呈下降趋势。固定化酶在30~40℃这个温度范围内活性是呈上升趋势,40℃达到活性最高,40~70℃活性呈下降趋势。
2.2.2 pH对酶活影响在固定化酶的过程中,介质pH值因为等电点的原因决定了酶的净电荷,同时也影响了载体的电荷量。当溶液pH值超出一定范围时,微观结构会发生变化,从而引起酶变性失活。因此缓冲液pH值是影响固定化脂肪酶催化活力和载体吸附蛋白量的关键因素之一。以酶活最高者为100%,以pH值为横坐标,以相对酶活为纵坐标作图3。

图3 pH对游离酶和固定化酶活影响Fig.3 pH influence on free enzyme and immobilized enzyme activity
由图3可见,游离酶的pH值为5.5~7.0时,酶活呈上升趋势,当pH值为7时,活性最佳。pH为7.0~8.0时活性呈下降趋势。固定化酶的pH值为5.5~7.5时,酶活呈上升趋势,当pH值为7.5时,活性达到最佳状态。pH值为7.5~8.0时活性呈下降趋势。
2.3 固定化条件筛选
2.3.1 时间对固定化的影响时间的长短对固定化脂肪酶活力和载体吸附蛋白量也产生影响。以酶活最高者为100%,以时间为横坐标,以相对酶活为纵坐标作图4。
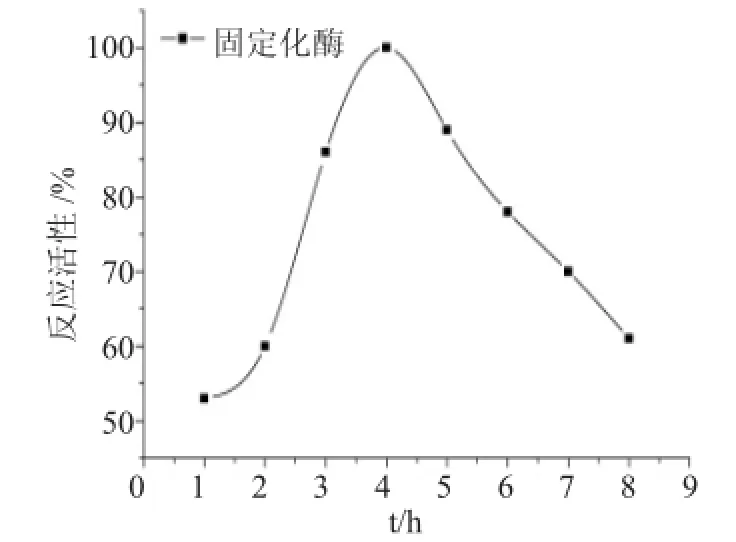
图4 时间对固定化酶酶活影响Fig.4 Time effect on immobilized enzyme activity
由图4可见,在pH值为7.5条件下,固定化时间为1~4h时,呈上升趋势,4h时达到最佳状态,在4~8h时,活性呈下降趋势。
3 固定化脂肪酶表征
3.1 扫描电子显微镜(SEM)分析
如图5所示,在放大2000倍条件下未改性硅藻土固定化脂肪酶与改性硅藻土固定化脂肪酶的扫描形貌图,改性硅藻土孔径更为清晰通透,排列规整,一定面积的孔数量显明显增加,因此有效改善了硅藻土的吸附性能。

图5 硅藻土固定脂肪酶与改性硅藻土固定化脂肪酶电镜图(×2000)Fig.5 SEM graph of diatomite immobilized lipase and Modified diatomite immobilized lipase(×2000)
3.2 红外光谱分析
改性硅藻土固定化酶、硅藻土固定化酶、游离脂肪酶有不同的基团,红外吸收有差异,但固定化酶由脂肪酶与不同载体构成,红外吸收亦有相同之处,三者红外分析谱图见图6。

图6 改性硅藻土固定化酶、硅藻土固定化酶、游离酶红外谱图Fig.6 Immobilized enzyme of modified diatomite/Immobilized enzyme of modified diatomite/Free enzyme
由图6可见,游离脂肪酶的红外图谱中3435cm-1处的吸收峰为-NH的伸缩振动,2978、2920cm-1处的吸收峰为甲基或者亚甲基的伸缩振动峰,在固定化脂肪酶上都出现了脂肪酶在2978、2920cm-1处的特征吸收峰,但是未改性的硅藻土特征峰并不明显,而改性硅藻土特征峰明显,表明改性硅藻土固定化优于未改性硅藻土。
4 结论
采用改性硅藻土固定化脂肪酶具有工艺流程简单、操作方便、反应条件较为温和。固定化时间为4h;由实验结果可知酶的最佳固定化条件:温度为40℃;pH值为7.5;固定化酶在40℃下保温2h后酶活损失很小,固定化酶热稳定性和存储稳定性比游离酶明显提高,具有较好的操作稳定性。
Study on modified diatomite for lipase immobilization*
LIU Yuan-yuan,ZHENG Yong-jie*,TIAN Jing-zhi
(College of Chemistry and Chemistry Engineering,Qiqihaer University,Qiqihaer 161006,China)
The lipase was immobilized by adsorption method with modified diatomite as carrier.The optimized conditions were immobilized time is 4h,temperature is 40℃,pH value is 7.5.The results showed that enzyme activity loss was little when under 40℃and heat preserved 2h.The immobilized enzyme repeatability achieve the best.
modified diatomite;immobilization;lipase
Q814.2
A
1002-1124(2014)03-0014-04
2013-12-26
齐齐哈尔大学青年教师科研启动支持计划资助(2010K-M 24);黑龙江省教育厅资助项目(12521612)
刘媛媛(1988-),女,黑龙江省伊春市,在读硕士研究生。
郑永杰(1964-),男,黑龙江省同江县,工学博士,教授,分析化学学科和生物化工学科研究生导师,主要研究方向:仪器分析及其联用技术、吸附材料及其应用、环境污染物动态迁移转化研究。

