臭氧直接氧化法回收碘*
卢明达朱浩天刘昭宇李晓辉** 张澜萃**
(1辽宁师范大学化学化工学院 辽宁大连116021;2吉林大学生命科学学院 吉林长春130012)
碘及其化合物广泛应用于医药、食品、农业、化工、军事技术等领域,需求量较大。在无机化学实验中,如平衡常数的测定、化学反应速率和活化能的测定等,均会产生大量的含碘废液,如果将其直接排放,不但污染环境,还会造成碘资源的浪费。已报道的碘的回收方法主要有离子交换法、萃取法、活性炭吸附法、沉淀法、液膜分离法、溶剂浮选法等[1]。在这些方法中,均涉及将碘离子(I-)氧化为碘单质(I2)这一关键步骤。常用的氧化剂有氧化性盐,如NaClO、K2Cr2O7、KMnO4、FeCl3等[2],其主要缺点是在废液中引进了新的污染物,且需要较强的酸性环境,需进一步处理才能排放。其他氧化剂还有氧化性酸(如HNO3),虽然废液中无新的污染物,但产生的氮氧化物会造成大气环境的污染。H2O2是温合型氧化剂,对环境无污染,也被用于碘废液中碘的回收[3],但H2O2易分解,且反应同样需要在较强酸性条件下才能发生。O3具有较强的氧化性,在氧化还原反应中只生成对环境无污染的O2,但由于制备O3困难,成本较高,且氧化性强难以控制,所以很少被推广应用。近年来,随着科技的进步,制备O3越来越容易、简单。某些小型商用活氧机使用方便、耗电量低,完全能满足实验室使用。本文工作在大量实验的基础上,以O3为氧化剂,淀粉为指示剂,控制其最终氧化产物为I2而不发生继续氧化,从而建立了用O3直接氧化实验室含碘废液回收单质碘的方法。
1 实验部分
1.1 仪器和药品
仪器:A-81多功能活氧机,功率18W,输出活氧量(以O3计)≥400mg·h-1;BSA224S电子天平;SHB-Ⅲ型循环水式多用真空泵;PHS-3C型酸度计。
药品:CCl4,NaOH,H2SO4,Na2S2O3·5H2O,KI,淀粉,Na2SO3,FeCl3;以上药品均为分析纯。
1.2 含碘废液中碘的回收
1.2.1 碘的存在形式的分析
(2)I2的分析:用CCl4萃取含碘废液,若CCl4层呈紫色,则含I2,否则不含I2。实验证明该废液中存在I2。
(3)I-的分析:取(2)中水相溶液1mL,加入1mL 0.1mol·L-1FeCl3溶液,振荡后用CCl4萃取,若CCl4层呈紫色,则含I-,否则不含I-。实验证明该废液中存在I-,反应为2Fe3++2I-=2Fe2++I2。
1.2.2 碘的总含量测定
量取100mL废液,用稀H2SO4调控pH为4~5,通入O3使废液由蓝色变为无色,此时碘的存在形式只有。参照文献[4]方法进行碘的总含量测定。其原理为:在酸性介质中,试样中氧化KI析出I2单质,用Na2S2O3标准溶液滴定,测定碘的含量。反应为:


此结果相当于I2的质量浓度为0.533g·L-1,以此表示废液中碘的总含量。
1.2.3 臭氧氧化法回收碘最佳实验条件的确定
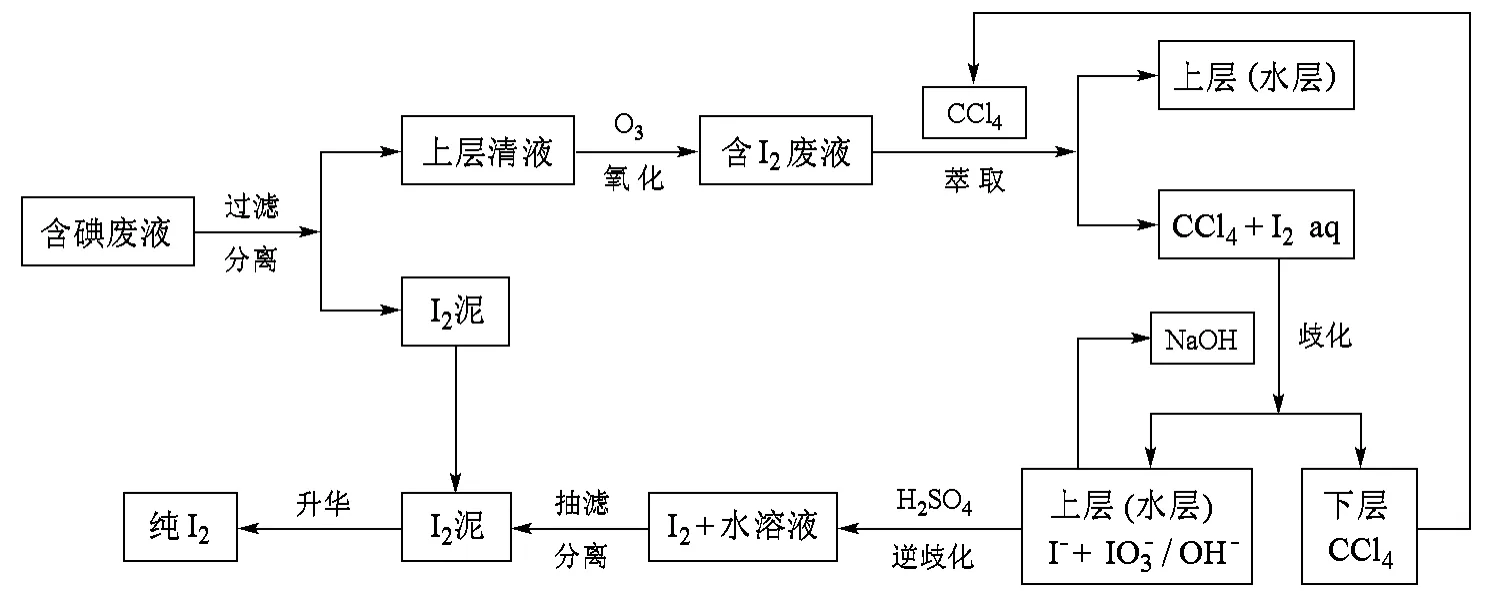
图1 碘的回收流程示意图
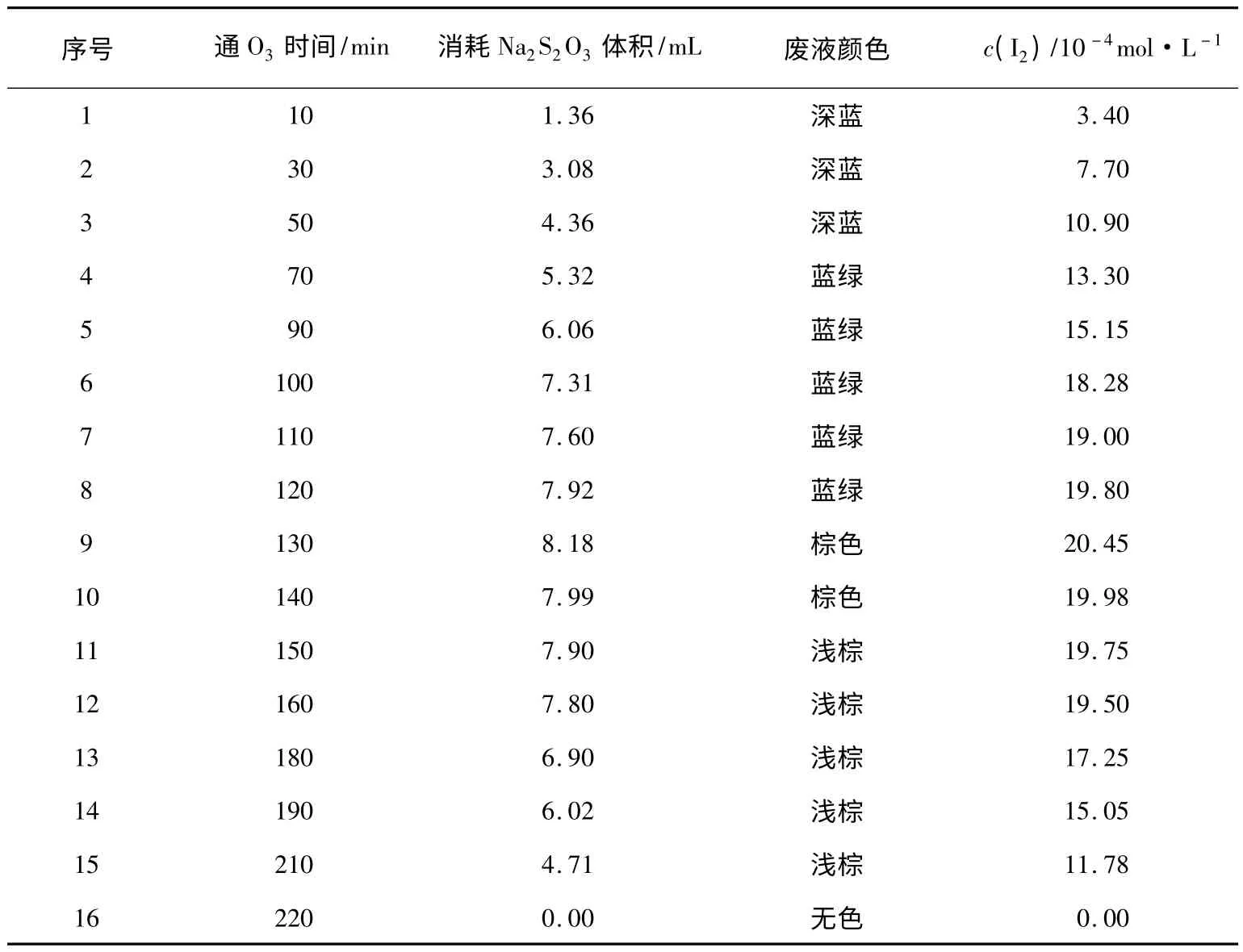
表1 生成I2量的分析结果
2 结果与讨论
2.1 臭氧的用量控制
在酸性溶液中,O3的标准电极电势为φӨ(O3+2H+/O2)=2.07V;在碱性溶液中,φӨ(O3/O2+2OH-)=1.24V[5]。因此,在很宽的pH范围内,O3均可氧化水溶液中的还原性物质。不同氧化态碘的电极电势为:φӨ(I2/I-)=0.535V,φӨ/I2)=1.195V,φӨ/I-)=1.085V[5],从电极电势的差值可以看出,O3能将I-氧化为I2,并可进一步将其氧化为。但在酸性条件下,同时也会发生如下反应:5I-++6H+=3I2+3H2O,即发生逆歧化反应,生成I2,所以可以通过控制O3的通入量,使碘的最终氧化态为I2(O3+2I-+2H+=O2+I2+H2O)。此方法反应速度快,终点颜色变化明显。
从表1可以看出,随着O3的不断通入,I2的生成量逐渐增大;当O3通入约130min时,I2的生成量达到最大,废液从蓝绿色突变为棕色。那么此时I-是否全部转化为I2?是否有部分I2已被氧化为?因此对以上废液进行进一步的分析:用CCl4多次萃取棕色废液至CCl4层近无色,说明几乎全部的I2已被萃取出来,此时上层清液仍显淡蓝绿色,表明废液中仍存在少量。经碘量法验证,上层清液中剩余含量为5×10-6mol·L-1,说明I-完全被氧化;另外,再取上层清液按1.2.1中方法(4)进行检验,未检测出。从以上分析结果可知,采用O3氧化法回收碘,其回收率高,可达97.4%。从表1还可以看出,随着O3的继续通入,I2的含量逐渐减小,废液颜色变浅,表明I2已被过度氧化,生成了;当通入O3约220min时,废液变为无色,说明I2全部转换为无色的。多次实验证明,采用O3为氧化剂,通过控制O3的通入量可将I-氧化至I2进行回收。
2.2 pH的影响和淀粉指示剂的显色条件探讨
实验发现:当废液的pH为5~6时,通入O3,废液由深蓝色渐变为浅蓝色,最后变为无色;放置一段时间后,废液又从无色渐变为浅蓝色至深蓝色;如此往复,未观察到废液突变为棕色的现象。当向上述无色废液中滴入几滴酸后,立即生成棕色沉淀,说明无色废液中含有和I-,加入酸后,发生了逆歧化反应生成了单质I2,也说明了歧化与逆歧化反应处于动态平衡。当将废液的pH调至4~5,通入O3后即可观察到废液由深蓝色渐变为蓝绿色,最后突变为棕色。所以,废液的pH是该氧化-还原反应终点控制的重要因素。
在碘量法分析中,淀粉是常用的指示剂,其检测灵敏度高,I2的最小检测浓度为4×10-5mol·L-1。欲使直链淀粉显示蓝色,必须满足两个条件:一是必须有I-存在(I-浓度必须大于4×10-5mol·L-1);二是需控制一定的pH,一般应控制在pH2~9的范围。因为在pH<2时,淀粉易水解为糊精,遇I2显红色;若pH>9,则I2发生歧化而不显色[6]。实验证明淀粉显色在弱酸性溶液(pH4~5)中最为灵敏。实验室含碘废液多为弱酸性,适合用淀粉作指示剂。当蓝色刚好褪去时,表明I-的浓度已小于4×10-5mol·L-1。换言之,I-几乎被全部氧化为I2。
2.3 萃取剂和碱液的循环使用
用CCl4为萃取剂萃取I2,CCl4层加碱可使I2发生歧化反应上层为含碘的水层,下层为CCl4层。分出的CCl4作为萃取剂可循环使用,富集碘的水层可作为碱液继续使用,这样可减少CCl4和碱液的用量,并减少废水的排放量,防止环境污染。
2.4 碘升华方法的改进
碘升华一般采用水浴加热。水热容大,升温慢,并产生大量的水蒸气。而砂子的热容小,升温快。将水浴改为沙浴,并将碘泥直接搅拌、分散于沙子中,可有效提高碘的升华速度;此方法有利于实验室碘回收的推广应用。
3 结论
臭氧氧化法具有操作简便、成本低、萃取剂可循环使用、碘回收率高等优点。该方法可替代其他氧化法用于实验室含碘废液中碘的回收。经控制氧化、萃取、分离、升华等流程可直接从无机化学实验产生的含碘废液中回收单质碘。本文工作以O3为氧化剂用于碘的回收,方法快速、准确、可行;实验过程中无二次污染;实验中所使用的O3由家用小型活氧机产生,价廉实用,绿色环保;回收的碘可再次用于学生实验,既解决了废液排放污染环境的问题,又可以节约碘资源,并有助于提高学生的环保意识,具有很好的教学意义。
[1]史春英,胡宏,解田,等.磷肥与复肥,2011,26(6):6
[2]魏剑英,许炎妹,韩周祥,等.无机盐工业,2007,39(9):47
[3]朱兆友,高秀,牛志芳,等.化学与生物工程,2011,28(10):60
[4]中国国家标准化管理委员会.制盐工业通用试验方法 碘的测定.中华人民共和国国家标准.GB/T 13025.7—2012
[5]河北师范大学,辽宁师范大学,福建师范大学,等.无机化学.第2版.北京:高等教育出版社,2012
[6]华中师范大学,东北师范大学,陕西师范大学,等.分析化学(上).第4版.北京:高等教育出版社,2011

