脑源性神经营养因子缓释胶原凝胶支架对神经干细胞生长和分化的影响
黄 斐,马广文,尹宗生,王 清,尹 勇
脑源性神经营养因子缓释胶原凝胶支架对神经干细胞生长和分化的影响
黄 斐1,马广文1,尹宗生2,王 清1,尹 勇1
目的观察脑源性神经营养因子(BDNF)缓释胶原凝胶支架对神经干细胞生长和分化的影响。方法将BDNF与胶原凝胶溶液混合,制备成BDNF缓释支架,采用ELISA法检测缓释支架中BDNF的释放曲线,然后将大鼠胚胎神经干细胞接种于缓释支架中作为实验组,并观察神经干细胞在缓释支架中的生长情况。以常规添加BDNF并悬浮培养的神经干细胞作为对照组,采用免疫荧光方法鉴定缓释支架中神经干细胞分化成不同神经细胞的比例,并用细胞活力检测试剂盒(CCK-8)检测不同培养组中神经干细胞的活力。结果ELISA结果显示缓释支架可以持续释放BDNF达到10 d,体外实验显示该缓释支架与神经干细胞有较好的生物相容性,CCK-8检测显示缓释支架中神经干细胞活力优于对照组(P<0.05),免疫荧光证实缓释支架中神经干细胞分化成神经元的比例要高于对照组(P<0.05)。结论BDNF缓释胶原凝胶支架具有良好的生物相容性,可以促进神经干细胞生存并诱导其分化成神经元。
神经干细胞;胶原凝胶;神经球;胚胎;大鼠
神经干细胞具有增殖、自我更新和多向分化能力[1],是目前常用的种子细胞。研究[2-3]表明移植外源性神经干细胞治疗中枢神经系统疾病可以促进其功能恢复,但是为了达到治疗效果,就需要在体外培养足够数量的细胞,并诱导神经干细胞主要向神经元分化。研究[4-6]显示神经干细胞的生存、增殖和分化都受到神经营养因子的调控。脑源性神经营养因子(brain-derived neurotrophic factor,BDNF)是目前研究较多的一种神经营养因子,它可以促进神经干细胞生存,并诱导神经干细胞向γ-氨基丁酸(Gamma-amino butyric acid,GABA)能神经元分化[7],因此在神经干细胞培养时常加入BDNF进行诱导分化。然而有研究[8]显示神经营养因子加入到培养液后很快就失活,只有少部分的神经营养因子能与细胞相互作用,为了解决这个问题,该研究利用胶原凝胶与BDNF相互混合构建BDNF缓释胶原凝胶支架,并观察缓释支架对BDNF生物活性的保护作用,以及对神经干细胞生长和分化的影响。
1 材料与方法
1.1 实验动物孕14 d的SD大鼠3只,雌性,清洁级,300~320 g,由安徽医科大学实验动物中心提供。
1.2 主要试剂与仪器DMEM/F12培养基、B27和胎牛血清(美国Gibco公司);表皮生长因子(epidermal growth factor,EGF)和碱性成纤维细胞生长因子(basic fibroblast growth factor,b-FGF)(美国Pepro-Tech公司);Ⅰ型鼠尾胶原、accutase酶和DAPI(美国Sigma公司);一抗兔抗大鼠Nestin多克隆抗体(英国Abcam公司);小鼠抗大鼠βⅢ-tubulin单克隆抗体、兔抗大鼠GFAP多克隆抗体和小鼠抗大鼠CNPase单克隆抗体(美国Chemicon公司);荧光二抗(美国Jackson公司);细胞活力检测试剂盒(CCK-8,日本Dojindo公司);BX-51免疫荧光显微镜(日本Olympus公司)。
1.3 神经干细胞的分离培养将SD大鼠用10%水合氯醛腹腔麻醉后,用75%乙醇溶液浸泡5 min,无菌条件下取出胎鼠大脑皮质放入预冷的DMEM/F12培养液中,用眼科剪将组织块剪成1 mm×1 mm ×1 mm大小,用吸管反复吹打后取上清液,通过200目滤网过滤制成单细胞悬液,收集单细胞悬液800 r/min离心10 min,弃上清,加入含有2%B27、20 ng/ml EGF和b-FGF的DMEM/F12培养液重悬细胞,调节细胞密度为2×105/ml接种到50 ml培养瓶中,置于37℃、5%CO2饱和湿度培养箱中培养。
1.4 神经干细胞的传代培养培养5~7 d后将神经干细胞收集到离心管中,800 r/min离心5 min后,弃上清液加入0.5 ml accutase酶,37℃孵育10 min后,加入等量培养液终止消化,用经火焰抛光的吸管吹打制成单细胞悬液,800 r/min离心5 min后,弃上清液定量加入培养液,调整细胞密度为2× 105/ml接种到50 ml培养瓶中,置于37℃、5%CO2饱和湿度培养箱培养。以后每2~3 d进行半量换液,每6~7 d传代1次
1.5 构建BDNF凝胶缓释支架无菌条件下用三蒸水将BDNF溶解成100 μg/ml,将Ⅰ型胶原蛋白用三蒸水溶解成0.5 mg/ml,取40 ng BDNF与200 μl胶原凝胶混合后,平铺于细胞爬片上,然后在无菌条件下4℃风干保存。
1.6 BDNF缓释凝胶支架体外释放检测BDNF
体外释放实验可采取双抗夹心ELISA法测定。神经干细胞接种于缓释支架中作为实验组,在神经干细胞与缓释支架混合培养后6、12 h,1、3、5、7、10 d分别取细胞培养液100 μl,按ELISA试剂盒说明进行检测,用酶标仪于450 nm处测出液体中BDNF吸光度,以吸光度间接反应BDNF浓度,绘制出BDNF释放曲线。以常规添加相同数量的BDNF并悬浮培养的神经干细胞作为对照组,并在相同时间点检测BDNF浓度。所有实验均重复3次,取平均值。
1.7 细胞活力检测采用CCK-8检测神经干细胞与缓释支架共培养时的活力。采用96孔细胞培养板检测,具体操作方法按照CCK-8说明书进行,神经干细胞密度为5×104/ml,每组共有5个培养孔,每孔加入100 μl,在培养1、4、7 d后,每孔加入10 μl CCK-8在37℃、5%CO2条件下培养4 h,用酶标仪测定450 nm,参考波长为650 nm的吸光度值(A)。
1.8 缓释凝胶支架对神经干细胞分化潜能的影响的测定神经干细胞与缓释凝胶支架共培养1周后,免疫荧光方法检测共培养的神经干细胞分化潜能。细胞用预冷的4%多聚甲醛室温固定20 min,再用含有5%正常山羊血清和0.3%Triton X-100的PBS湿盒内室温封闭通透1 h后,加入一抗神经干细胞标志物Nestin(1∶250)、神经元标志物βⅢ-tubulin(1∶100)、神经胶质细胞标志物GFAP (1∶400)、少突胶质细胞标志物CNPase(1∶200),4℃孵育过夜后,加入相应荧光二抗室温孵育1 h,加入DAPI复染细胞核,各步骤之间PBS洗3次,在免疫荧光显微镜下观察。测定神经干细胞分化潜能时,随机选取20个视野,以DAPI染色的细胞核数为总细胞数,分别计数βⅢ-tubulin、GFAP和CNPase阳性细胞数来计算神经元、神经胶质细胞和少突胶质细胞的分化比例。对照组每天在培养液中加入40 ng BDNF培养1周后,去除EGF和b-FGF诱导神经球贴壁,同样用免疫荧光方法鉴定其分化潜能。
1.9 统计学处理采用SPSS 13.0统计软件进行分析,数据以±s表示,两组间比较采用t检验。
2 结果
2.1 神经干细胞的悬浮培养和鉴定分离的细胞在无血清并含有EGF、b-FGF的培养液中悬浮生长形成神经球,悬浮生长4~5 d的神经球传代后,可以形成新的神经球。收集神经球制成单细胞悬液,在1%胎牛血清的诱导下,神经球来源的细胞贴壁分化形成神经细胞。免疫荧光显示神经球表达神经干细胞标志物Nestin。因此悬浮神经球可以认为是神经干细胞,见图1。
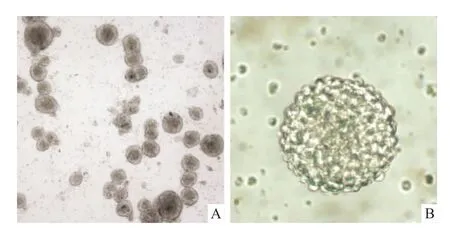
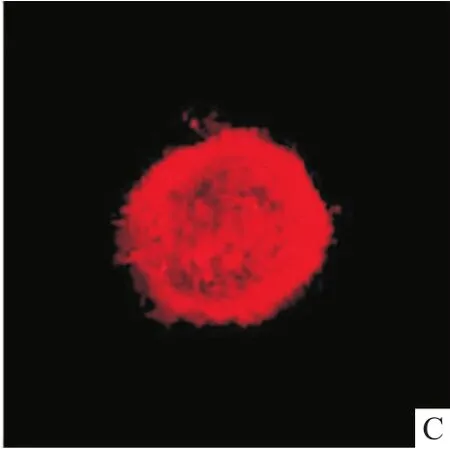
图1 神经干细胞培养与鉴定
2.2 缓释支架材料上BDNF的释放曲线BDNF在最初的24 h内累计释放量为61.1%,表现为释放曲线的急剧上升,显示BDNF为爆发性释放,而2 d后释放曲线缓慢上抬,7 d时累计释放量达到89.9%,表现为BDNF的持续缓慢释放。在任何时间点对照组BDNF都未能检测出,两组之间在不同实验时间段的释放率差异有统计学意义(P<0.05)。见图2。
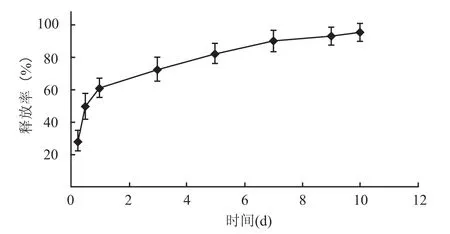
图2 BDNF的释放曲线
2.3 神经干细胞与缓释支架共培养将神经干细胞按1×105/ml种入0.5 mg/ml的胶原凝胶缓释支架中进行共培养,由于这些细胞来源单一,光镜下观察细胞折光性强,细胞活力较好,培养7 d后缓释支架中的细胞增殖形成神经球,见图3。

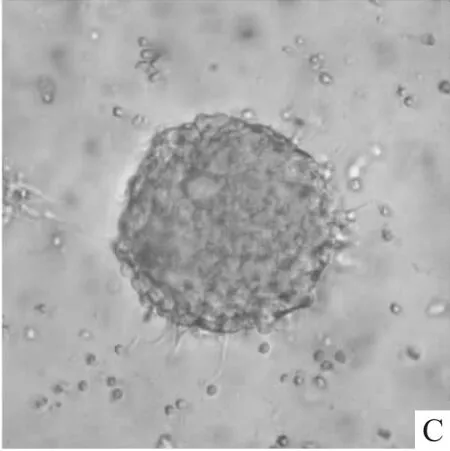
图3 神经干细胞在与缓释支架共培养
2.4 细胞活力检测用CCK-8来检测细胞活力,培养1 d时,实验组与对照组细胞活力比较差异无统计学意义(P>0.05)。培养4 d时,随着BDNF的持续释放,实验组细胞活力要高于对照组(P<0.05),而培养7 d时随着缓释支架中BDNF释放的减少,实验组与对照组比较细胞活力差异无统计学意义(P>0.05)。见图4。

图4 CCK-8检测不同培养组中神经干细胞的活力
2.5 缓释支架对神经干细胞分化的影响将胶原凝胶三维培养1周后的神经干细胞用1%胎牛血清诱导分化5 d后,免疫荧光显示实验组神经干细胞分化为βⅢ-tubulin阳性率为(38.26±1.56)%、GFAP阳性率为(48.62±4.78)%、CNPase阳性率为(15.47±1.32)%,而对照组中的神经干细胞分化为βⅢ-tubulin阳性率为(18.29±1.86)%、GFAP阳性率为(71.27±4.22)%、CNPase阳性率为(11.32±1.43)%,见图5。两组间分化成神经元和神经胶质细胞的比例比较差异有统计学意义(P<0.05)。
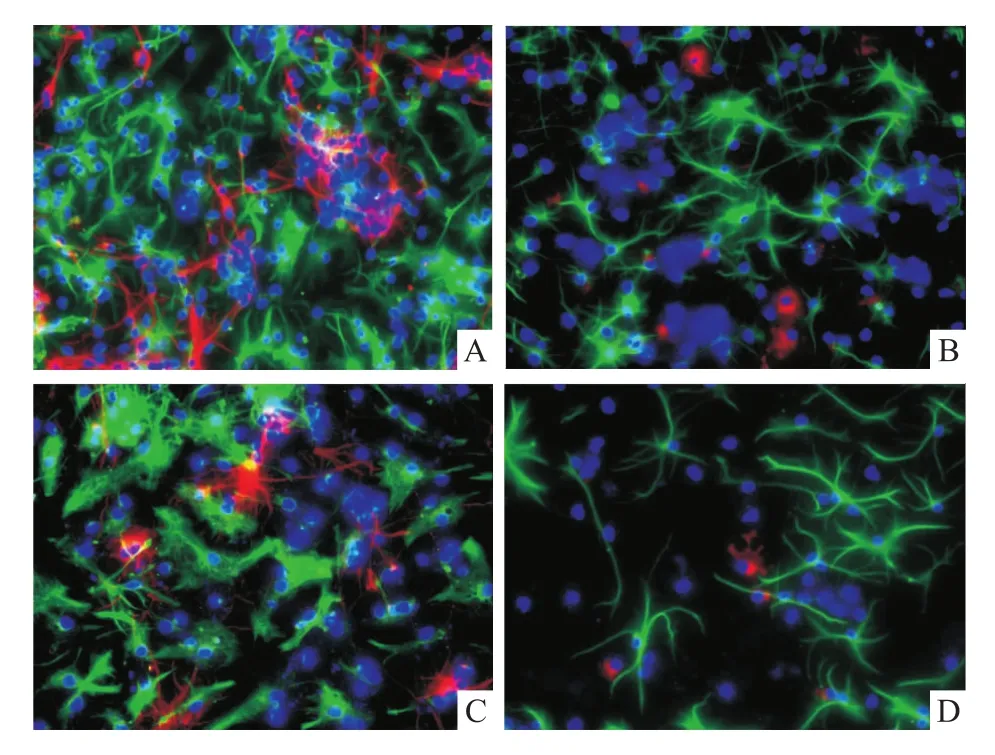
图5 免疫双标显示不同培养组中神经干细胞分化成神经细胞 ×400
3 讨论
目前对中枢神经系统损伤缺乏有效的治疗手段,神经干细胞因为具有分化成神经细胞的潜能而受到广泛研究。神经营养因子在神经干细胞的生存、增殖和分化中都起到了重要的调控作用。BDNF目前研究较为广泛,该研究表明BDNF可以通过酪氨酸激酶B(TrKB)受体促进神经干细胞增殖,并诱导神经干细胞向神经元和少突胶质细胞分化。然而BDNF在培养液中半衰期很短,只有少量的BDNF与细胞发生作用,因此在本实验中构建BDNF-胶原凝胶缓释支架载体,来维持BDNF的活性,促进BDNF与神经干细胞发生作用,维持神经干细胞的生长并诱导分化。
胶原凝胶是水凝胶的一种,拥有水凝胶的特点,可以形成立体三维网状支架,同时胶原蛋白作为天然的细胞外基质,具有无毒性、低免疫原性和可降解性等优点[9-11]。有研究[12]表明神经干细胞可以在胶原凝胶支架中增殖并传代,同时胶原凝胶支架可以维持神经干细胞的干细胞特性,而对神经干细胞的分化无明显影响。一些学者也将胶原凝胶支架作为缓释载体进行研究,Bhang et al[13]研究发现利用胶原凝胶支架和神经营养因子-3构建的缓释系统可以极大的减少PC-12细胞培养所需的生长因子数量,而且胶原凝胶支架可以维持神经营养因子-3的活性,延长它的作用时间。
本实验显示胶原凝胶中BDNF的释放符合双相动力学释药规律,既有初期的快速释放,也有后期的缓释,这种释放特点可以在局部形成有效浓度,有助于神经干细胞的生长和分化。CCK-8检测显示BDNF-胶原凝胶实验组中的神经干细胞活力要高于在对照组中神经干细胞活力,同时免疫荧光结果显示实验组神经干细胞分化成神经元的比例也高于对照组。
本研究表明BDNF复合于胶原凝胶中,可以达到缓释的目的,构建了带有生长因子缓释效果的生物支架,该支架能够很好的促进神经干细胞的生长并提高神经干细胞向神经元分化的比例,为后期进一步的体内实验奠定了基础。
[1]Chojnacki A,Weiss S.Production of neurons,astrocytes and oligodendrocytes from mammalian CNS stem cells[J].Nat Protoc,2008,3(6):935-40.
[2]Sandner B,Prang P,Rivera F J,et al.Neural stem cells for spinal cord repair[J].Cell Tissue Res,2012,349(1):349-62.
[3]Goldman S.Stem and progenitor cell-based therapy of the human central nervous system[J].Nat Biotechnol,2005,23(7):862-71.
[4]Choi K C,Yoo D S,Cho K S,et al.Effect of single growth factor and growth factor combinations on differentiation of neural stem cells[J].J Korean Neurosurg Soc,2008,44(6):375-81.
[5]Oh J,McCloskey M A,Blong C C,et al.Astrocyte-derived interleukin-6 promotes specific neuronal differentiation of neural progenitor cells from adult hippocampus[J].J Neurosci Res,2010,88(13):2798-809.
[6]Johansson S,Price J,Modo M.Effect of inflammatory cytokines on major histocompatibility complex expression and differentiation of human neural stem/progenitor cells[J].Stem Cells,2008,26 (9):244-54.
[7]Elliott R C,Black I B,Dregfus C F.Differential regulation of p75 and trkB mRNA expression after depolarizing stimuli or BDNF treatment in basal forebrain neuron cultures[J].J Neurosci Res,2001,66(1):83-8.
[8]Schuss Z,Singer A,Holcman D.The narrow escape problem for diffusion in cellular microdomains[J].Proc Natl Acad Sci USA,2007,104(44):16098-103.
[9]Watanabe K,Nakamura M,Okano H,et al.Establishment of three-dimensional culture of neural stem/progenitor cells in collagen type-1 Gel[J].Restor Neurol Neurosci,2007,25(2):109 -17.
[10]Ma W,Fitzgerald W,Liu Q Y,et al.CNS stem and progenitor cell differentiation into functional neuronal circuits in three-dimensional collagen gels[J].Exp Neurol,2004,190(2):276-88.
[11]Yang Z,Mo L,Duan H,et al.Effects of chitosan/collagen substrates on the behavior of rat neural stem cells[J].Sci China Life Sci,2010,53(2):215-22.
[12]Huang F,Shen Q,Zhao J T.Growth and differentiation of neural stem cells in a three-dimensional collagen gel scaffold[J].Neural Regener Res,2013,8(4):313-9.
[13]Bhang S H,Lee T J,Lim J M,et al.The effect of the controlled release of nerve growth factor from collagen gel on the efficiency of neural cell culture[J].Biomaterials,2009,30(1):126-32.
Effects of slow-release of brain-derived neurotrophic factor from collagen gel on growth and differentiation of neural stem cells
Huang Fei1,Ma Guangwen1,Yin Zongsheng2,et al
(1Dept of Orthopaedics,The Fourth Affiliated Hospital of Anhui Medical University,Hefei 230022;2Dept of Orthopaedics,The First Affiliated Hospital of Anhui Medical University,Hefei 230022)
ObjectiveTo observe the effects of the slow-release of brain-derived neurotrophic factor(BDNF)from collagen gel on growth and differentiation of neural stem cells.MethodsBDNF was mixed with collagen gel to prepare BDNF-collagen gel slow-release scaffold.The quantity and duration of BDNF release from the scaffold were determined by enzyme linked immunosorbent assay(ELISA).The embryonic rat neural stem cells were seeded in BDNF-collagen gel slow-release scaffold,and to observe the survival of neural stem cells.With group of daily add-ition of BDNF as a control,the proportion of differentiated cells of neural stem cells in BDNF-collagen gel slow-release scaffold were identified by the immunofluorescence techniques.The cell viability of neural stem cells cultured in different groups was detected by Cell Counting Kit-8(CCK-8)assay.ResultsThe ELISA showed BDNF was released from collagen gel for at least 10 days in vitro.The study showed that the slow-release scaffold and neural stem cells had a good biocompatibility in vitro,and neural stem cells could survive in slow-release scaffold.The CCK-8 testing showed the neural stem cells in BDNF-collagen gel slow-release scaffold group had higher cell viabilities than those in the control group(P<0.05).Immunofluorescence showed the differentiation percentage from neural stem cells into neurons in the BDNF-collagen gel slow-release scaffold group was higher than those in the control group(P<0.05).ConclusionBDNF-collagen gel slow-release scaffold,with a good biocompatibility,can enhance survival of neural stem cells,and induce them to differentiate into neurons.
neural stem cells;collagen gel;neurosphere;embryo;rat
R 394.2
1000-1492(2014)05-0586-05
2013-12-20接收
安徽医科大学校基金(编号:2013xkj045)
1安徽医科大学第四附属医院骨科,合肥 230022
2安徽医科大学第一附属医院骨科,合肥 230022
黄 斐,男,医师;
马广文,男,主任医师,责任作者,E-mail:hbmagw@126.com

