风湿性心脏瓣膜病合并心房颤动患者中SK2与CX40蛋白的表达变化及相关性
吴智明,石开虎,吴君旭,徐盛松,陶 辉,宣海洋,曹 炜,沙纪名,占红英
风湿性心脏瓣膜病合并心房颤动患者中SK2与CX40蛋白的表达变化及相关性
吴智明,石开虎,吴君旭,徐盛松,陶 辉,宣海洋,曹 炜,沙纪名,占红英
目的探讨风湿性心脏瓣膜病(简称风心病)合并心房颤动(AF)患者2型小电导钙激活钾通道蛋白(SK2)与缝隙连接蛋白40(CX40)表达水平变化及其相关性。方法
风湿性心脏病;心房颤动;缝隙连接蛋白;小电导钙激活钾通道蛋白
风湿性心脏瓣膜疾病(简称风心病)合并心房颤动(atrial fibrillation,AF)是心脏外科常见的临床疾病。近年来发现2型小电导钙激活钾通道蛋白(SK2)在心肌细胞复极化的过程中起到非常重要的作用,且与AF具有一定相关性[1-3]。AF早期出现的电重构是容易逆转的电生理现象,后期则出现不可逆的结构重构现象,这又被称作“快速心率引起的心房肌病”[4]。心肌间的结构藕联是由缝隙连接蛋白(CX)组成,心肌间电激动很大程度取决于CX。心房肌细胞主要表达CX40、CX43等。而CX40是心房肌细胞最主要的藕联蛋白,CX40结构重构与AF的发生及稳定性密切相关。该研究通过对风心病合并AF患者的右心耳CX40、SK2蛋白表达进行对比分析,探讨CX40、SK2对AF的影响,从而揭示风心病患者AF发生与维持的可能机制,为临床更好地防治AF提供理论依据。
1 材料与方法
1.1 病例资料收集2012年2月~2013年2月在我院因风心病施行心脏瓣膜置换手术的31例患者,排除合并高血压、糖尿病、心绞痛和慢性肾功能不全者。按有无AF分为AF组和窦性心律(SR)组。AF组20例,其中男9例,女11例,年龄29~70岁,平均41.62岁;术前NYHA心功能分级Ⅰ级0例,Ⅱ级5例,Ⅲ级9例,Ⅳ级6例。SR组11例,其中男4例,女7例,年龄32~68岁,平均35.42岁;术前NYHA心功能分级Ⅰ级1例,Ⅱ级7例,Ⅲ级3例。
1.2 主要试剂人KCNN2 ELISA试剂盒、人CX40 ELISA试剂盒(美国Uscn公司);兔抗CX40多克隆抗体(美国Millipore公司);兔抗SK2多克隆抗体(Alomone公司)。
1.3 方法
1.3.1 心脏彩超检查 在患者术前行心脏彩超检查。仪器:MYLAB50频率3.5 mHz。记录反映心功能的参数:左室射血分数(LVEF)。记录心脏若干结构数据:左房内径(LAD)、右房内径(RAD)、左室舒张末期直径(LVDD)、右室内径(RVD)。
1.3.2 ELISA测定蛋白
1.3.2.1 膜蛋白的提取 组织剪碎加入1 ml蛋白提取液,液氮研磨,冰上孵育30 min,4℃,2 600 r/min离心5 min,取上清液。
1.3.2.2 ELISA试验 ①加样:依次将标准品、待测样品100 μl加入到酶标板中,盖上覆膜,37℃温育30 min;②加试剂A:弃去孔内液体,每孔加试剂A 100 μl,酶标板加上覆膜,37℃温育1h;③洗涤:弃去孔内液体,每孔用350 μl洗涤液洗涤,浸泡1~2 min,弃去孔内液体,拍干,如此重复5次;④加试剂B:每孔加入试剂B 100 μl,酶标板加上覆膜,37℃温育30 min;⑤洗涤:同步骤3;⑥显色:每孔加底物溶液90 μl,酶标板加上覆膜,37℃避光显色10~15 min;⑦终止:每孔加终止溶液50 μl终止反应,此时溶液由蓝色立即转为黄色。终止液的加入顺序和底物溶液的加入顺序相同,在确保酶标板底无水滴及孔内无气泡15 min内,立即用酶标仪在450 nm波长测定各孔的吸光度(OD)值。
1.3.3 Western blot法测定蛋白 心房肌蛋白提取:取右心耳的心房肌组织块1 g,加入总蛋白提取液1 ml,匀浆、裂解、离心,即得总蛋白提取液,置于-80℃冰箱保存备用。①蛋白电泳:采用12%分离胶及5%积层胶的SDS-PAGE系统;②转膜:300 mA恒流电2h;③印迹:洗膜;一抗工作液,37℃孵育过夜,洗膜;二抗工作液,37℃孵育2h,洗膜;④洗片:将A和B发光液按等体积混合滴于PVDF膜上,压片,曝光,定影;⑤蛋白半定量检测:采用Lab Works4.5图像获取和分析系统软件测定CX40、SK2蛋白条带的积分光密度(IOD)值,以甘油醛-3-磷酸脱氢酶(GAPDH)作为内参照,每个样品均同时检测GAPDH蛋白条带的IOD值,SK2、CX40的相对表达量以IODSK2/IODGAPDH、IODCX40/IODGAPDH值表示。
1.4 统计学处理采用SPSS 19.0统计软件进行分析,数据用±s表示。两组之间定量数据比较采用t检验,相关性分析使用Pearson相关。
2 结果
2.1 基本资料AF组患者平均年龄大、病程长,与SR组比较差异有统计学意义(P<0.01);彩色多普勒超声心动图资料显示:AF组LAD、RAD、LVDD平均值明显大于SR组(P<0.01),但LVEF平均值明显小于SR组(P<0.01),见表1。
表1 心功能各项指标(±s)
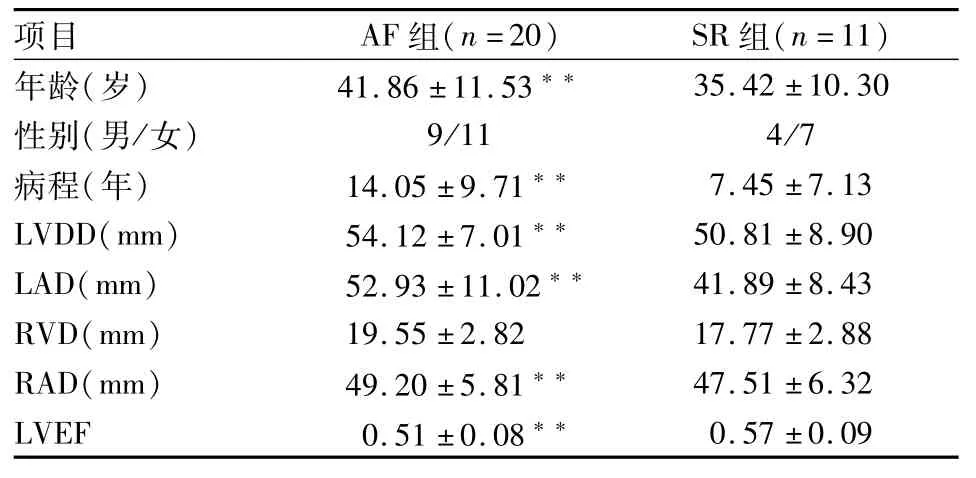
表1 心功能各项指标(±s)
与SR组比较:**P<0.01
项目AF组(n=20)SR组(n=11)年龄(岁)41.86±11.53**35.42±10.30性别(男/女)9/114/7病程(年)14.05±9.71**7.45±7.13 LVDD(mm)54.12±7.01**50.81±8.90 LAD(mm)52.93±11.02**41.89±8.43 RVD(mm)19.55±2.8217.77±2.88 RAD(mm)49.20±5.81**47.51±6.32 LVEF0.51±0.08**0.57±0.09
2.2 ELISA法检测由图1A ELISA标准曲线可间接得出,每孔样品量总蛋白为0.1 mg的条件下,AF组患者心房肌细胞SK2蛋白浓度为(4.01± 0.47)ng/ml,SR组患者心房肌细胞SK2蛋白浓度为(1.23±0.13)ng/ml,两组比较差异有统计学意义(P<0.01)。由图1B可知,AF患者心房肌细胞CX40蛋白浓度为(5.38±0.45)ng/ml,SR组患者心房肌细胞CX40蛋白浓度为(8.92±0.78)ng/ml,两组比较差异有统计学意义(P<0.01)。
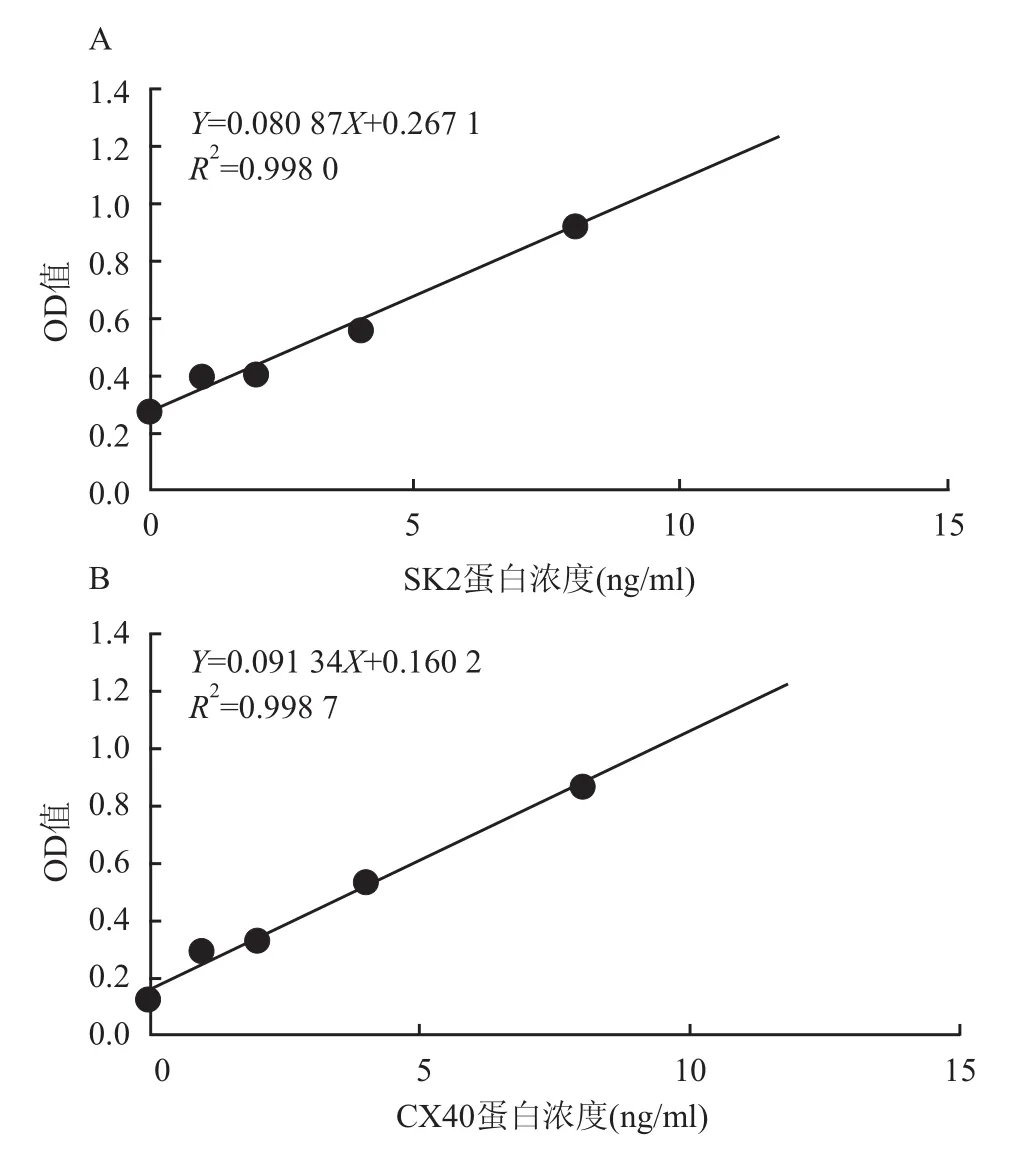
图1 ELISA标准曲线
2.3 Western blot法检测与SR组相比较,AF组右心房SK2蛋白的相对表达量明显增加(P<0.01),而AF组右心房CX40的相对表达量明显减少(P<0.01),见图2。
2.4 SK2与CX40的相关性分析AF的电重构与结构重构可能存在相互作用,即SK2与CX40蛋白水平相关性研究可能揭示电重构与结构重构的关系,分析结果:CX40蛋白水平与SK2蛋白水平呈负相关(r=-0.56,P<0.01)。
3 讨论
AF的发生不仅与心房肌细胞动作电位不应期缩短有密切关系,还与心肌细胞间的电藕联结构密切相关。心房电重构是导致心律失常基质产生的重要原因,亦导致AF的发生、发展和持续[5-6]。心房肌细胞动作电位的去极化与复极化过程则由心肌细胞膜上不同的离子通道开闭程度所决定的,其中SK2蛋白在心房肌细胞动作电位末期起到非常重要的作用,并发现SK2蛋白在心房组织表达量明显高于心室组织[1]。而缝隙连接作为心肌细胞间实现电藕联的特殊结构基础,参与了AF的发生、发展及维持。研究[7]表明CX40其含量和分布与AF密切相关。
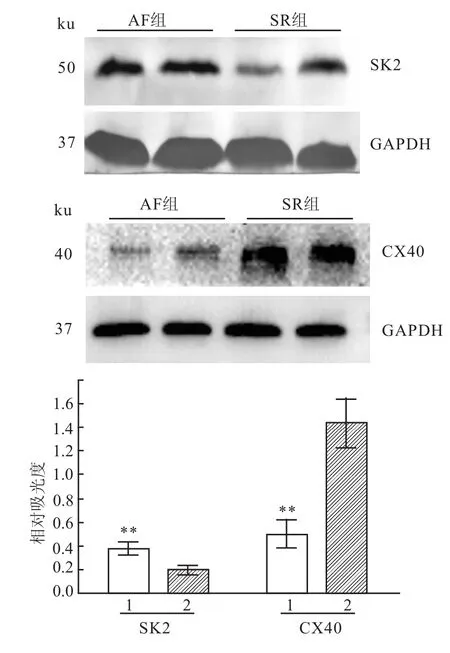
图2 Western blot法检测SK2、CX40蛋白的表达
本研究通过ELISA、Western blot法检测发现风心病合并AF患者右心耳心房肌组织SK2蛋白表达量较SR组明显增加,与Ozgen et al[3]在兔肺静脉经过间歇的短阵高速起搏的肺静脉肌细胞SK2通道研究结果类似。心房肌细胞SK2蛋白增加,会导致心肌细胞动作电位复极时程缩短,而心肌细胞动作电位复极时程缩短又是引起AF的重要因素。此外,研究[8]显示SK2阻滞剂NS8593可以延长心房的有效不应期,但不影响心室激动时间,并且能预防和终止离体或在体的AF模型。李妙龄等[9]研究发现持续性AF患者的右心耳SK2通道电流明显增加。持续性AF患者心房肌细胞SK2通道电流的增强,揭示了SK2可能参与和介导AF的心房电重构过程。
Kostin et al[7]对AF频繁发作患者行迷宫手术时,留取的右心房组织进行分析后发现CX40的表达水平明显下降;Nao et al[10]对风心病行瓣膜置换术患者的右心耳行CX定量检测中发现AF组CX40表达量较SR组明显减少,但CX40的丝氨酸磷酸基的表达却增高。另外,黄骥等[11]对31例风心病行瓣膜置换术患者的左、右心耳CX40表达进行对比研究后发现,左、右心房CX40表达量比SR组明显降低,这都与本研究结果类似。因此,CX40降解及重新分布,蓄积于胞质内,导致缝隙连接的中断、功能障碍,引起心肌间电藕联障碍,造成激动时电活动横向传导失藕联,以及不同传导方向的不应期差异,从而产生兴奋的折返导致AF的发生[12-13]。
本研究还发现SK2与CX40呈负相关性,其可能原因是在慢性AF中扩张的右心房导致心房肌细胞增大,引起CX40降解和分布异常,导致缝隙连接的功能失常。另外,心房肌细胞SK2蛋白增多使得心房肌细胞动作电位复极时程缩短[3],导致房内小折返回路,同时组织结构异质性使传导延迟,更多子波折返,两种机制正反馈的促进AF的发生、发展和维持。
综上所述,AF的电重构与结构重构可能存在相互影响,并促进AF的发生和维持。由SK2和CX40在心房组织和心室组织的表达不同[1,14],为临床新药的研发提供实验基础和理论依据。通过药物阻断SK2通道,直接针对心房肌细胞而不影响心室肌细胞的电活动,减少传统抗心律失常药物引起的副作用;或者以CX40为作用靶点开发药物,以缓解或阻止心房结构重构的发生、发展,从而达到治疗及预防AF的临床目的。
[1] Xu Y,Tuteja D,Zhang Z,et al.Molecular identification and functional roles of a Ca2+-activated K+channel inhuman and mousehearts[J].J Biol Chem,2003,278(49):49085-94.
[2] Li N,Timofeyev V,Tuteja D,et al.Ablation of a Ca2+-activated K+channel(SK2 channel)results in action potential prolongation in atrial myocytes and atrial fibrillation[J].J Physiol,2009,587(5):1087-100.
[3] Ozgen N,Dun W,Sosunov E A,et al.Early electrical remodeling in rabbit pulmonary vein results from trafficking of intracellular SK2 channels to membrane sites[J].Cardiovasc Res,2007,75(4):758-69.
[4] Wijffels M C,Kirchhof C J,Dorland R,et al.Atrial fibrillationbegets atrial fibrillation.A study in awake chronically instrumented goats[J].Circulation,1995,92(7):1954-68.
[5] Maylie J,Bond C T,Herson P S,et al.Small conductance Ca2+-activated K+channels and calmodulin[J].J Physiol,2004,554(2):255-61.
[6] Cook D I,Wegman E A,Ishikawa T,et al.Tetraethylammonium blocks muscarinically evoked secretion in the sheep parotid gland by a mechanism additional to its blockade of BK channels[J].Pflugers Arch,1992,420(2):167-71.
[7] Kostin S,Klein G,Szalay Z,et al.Structural correlate of atrial fibrillation inhuman patients[J].Cardiovasc Res,2002,54(2):361-79.
[8] Diness J G,Sorensen U S,Nissen J D,et al.Inhibition of smallconductance Ca2+-activated K+channels terminates and protects against atrial fibrillation[J].Circ Arrhythm Electrophysiol,2010,3(4):380-90.
[9] 李妙龄,李 涛,雷 明,等,持续性心房颤动患者心房肌细胞小电导钙激活钾通道电流的增强[J].中华心血管病杂志,2011,39(2):147-51.
[10]Nao T,Ohkusa T,Hisamatsu Y,et al.Comparison of expression of connexin in right atrial myocardium in patients with chronic atrial fibrillation versus those in sinus rhythm[J].Am J Cardiol,2003,91(6):678-83.
[11]黄 骥,宋治远.风湿性心脏病心房颤动患者左、右心房肌Cx40、Cx43表达的对比研究[J].中国心脏起搏与心电生理杂志,2003,17(5):367-9.
[12]Beardslee M A,Laing J G,Beyer E C,et al.Rapid turnover of connexin43 in the adult ratheart[J].Circ Res,1998,83(6):629-35.
[13]Beardslee M A,Lerner D L,Tadros P N,et al.Dephosphorylation and intracellular redistribution of ventricular connexin43 during electrical uncoupling induced by ischemia[J].Circ Res,2000,87(8):656-62.
[14]Vozzi C,Dupont E,Coppen S R,et al.Chamber-related differences in connexin expression in thehumanheart[J].Mol Cell Cardiol,1999,31(5):991-1003.
Study on expression of SK2 and CX40 in the patients with rheumaticheart disease and atrial fibrillation
Wu Zhiming,Shi Kaihu,Wu Junxu,et al
(Dept of Cardiothoracic Surgery,The Second Affiliated Hospital of Anhui Medical University,Hefei 230601)
ObjectiveTo investigate the influence of atrial fibrillation(AF)to SK2 and CX40 in right atrial myocytes when the patients with rheumaticheart disease suffered from AF or not.MethodsWe investigated 31 patients with rheumaticheart disease undergoing cardiac surgery for correction to valvular defect.According to the duration of AF,20 patients with AF were experimental group;11 without AF were control group.Expression of SK2 and CX40 was detected by ELISA and Western blot.ResultsELISA showed that compared with the control group,concentration of SK2 protein in experimental group washigher(P<0.01).But the level of CX40 was markedly decreased in experimental group(P<0.01).The results of Western blot were similar to those of ELISA.Correlation analysis showed the expression of SK2 and CX40 took on negative correlation(r=-0.56,P<0.01).ConclusionThehigher expression level of SK2 and down-regulation of level of CX40 can be an important agent in the occurrence and maintenance of the rheumaticheart disease with atrial fibrillation.In addition,expression of SK2 and CX40 takes on negative correlation.
rheumaticheart disease;atrial fibrillation;connexin;small-conductance calcium-activated potassium channels
R 541.2;R 541.75;R 341.7;R 329.251
A
1000-1492(2014)04-0460-04
2013-10-16接收
安徽省自然科学基金(编号:1308085MH117);安徽省高等教育自然科学基金(编号:KJ2011A175)
安徽医科大学第二附属医院心胸外科,合肥 230601
吴智明,男,硕士研究生;石开虎,男,主任医师,硕士生导师,责任作者,E-mail:shikaihu@gmail.com
将31例风心病接受瓣膜置换手术患者,于体外循环前切取的右心耳组织作为研究对象,根据AF的定义将标本分为两组:AF组(n=20)和窦性心律(SR)组(n=11),分别利用ELISA、Western blot法检测心房肌组织中SK2和CX40蛋白表达水平变化。结果ELISA法检测显示AF组与SR组相比,SK2蛋白表达增加(P<0.01);而CX40蛋白表达减少(P<0.01)。同时,Western blot法检测显示AF组与SR组相比,SK2蛋白表达增加(P<0.01),而CX40蛋白表达减少(P<0.01)。相关性分析显示SK2与CX40之间呈负相关(r=-0.56,P<0.01)。结论SK2与CX40蛋白参与风心病合并AF的病理过程。此外,SK2和CX40之间存在一定负相关性。

