脊柱转移癌的术前评估和手术方式评价
李金洪 胡波 孙红振
脊柱转移癌的术前评估和手术方式评价
李金洪 胡波 孙红振
脊柱是恶性肿瘤骨转移最常见的部位[1],约占骨转移的 2 / 3。有尸检报告显示 70% 的癌症患者伴有脊柱转移。其中,伴有脊髓压迫的脊柱转移癌患者占 5%~14%[2]。近年来,随着检测技术的进步,尤其是 PET / CT的使用,脊柱转移癌的确诊率不断提高。在治疗方面,脊柱转移癌患者的管理理念也发生了转变,从单纯放、化疗逐渐演变为在放、化疗的基础上,积极进行外科手术治疗。试验证明,这种联合治疗比既往的单纯放、化疗对改善患者生存质量更有优势[3]。
为何要做手术评估
既然,外科手术在脊柱转移癌治疗中的优势已很明显。因此,无论从缓解疼痛症状,改善生活质量,还是重建脊柱稳定性方面,都应该积极合理地进行手术治疗。手术评估是决定患者预后的一个关键环节,何时进行手术和选择何种手术方式直接影响了患者术后的生活质量,甚至生存时间。脊柱转移癌的术前评估包括:全身肿瘤状况的评估,生活状况的评估,脊柱病灶情况和预后评估四部分。其中,前三种评估方法明确,容易进行。第四种评估对手术治疗最为关键,遗憾的是,虽然预后评估方法较多,但没有一种能够准确地评价患者的预后情况。所以,我们将各种评估的优缺点加以综述,介绍如下。
手术治疗前的评估体系
一、全身肿瘤状况评估
包括原发肿瘤的部位,性质,已发生转移的部位和转移灶数目等因素。肿瘤原发灶的情况可通过临床症状和局部组织活检明确,转移灶的情况可通过内镜、多部位 CT或 PET / CT 检查了解。PET / CT 将功能代谢和解剖结构现象结合在一起,在肿瘤的早期诊断,良恶性鉴别,恶性肿瘤的分级分期和原发灶的寻找方面有明显优势,有研究发现:50% 的脊柱转移癌患者经 PET / CT 检查后,治疗策略发生了改变[4]。
二、生活状况评估
包括患者术前身体状况和脊髓功能。ECOG 评分[5]是一种简化的活动状态评分表,是最常用的生活质量评估方法,主要评价患者的行走能力和生活自理能力,分为0~5 级,级别越高,生活质量越差。神经功能评分多采用Frankel 评分[6]。
三、脊柱病灶的局部评估
CT、MRI 等影像学检查是有效评估病灶累及部位和脊髓受压程度的方法[7]。CT 引导下病灶穿刺活检创伤小,是确诊的金标准。伴脊髓压迫但症状稳定的患者,建议常规穿刺活检。对于脊髓损伤严重且进展迅速的患者,可行急诊手术减压并术中活检。
四、预后评估
近年来,国外相继报道了几种指导外科手术治疗的预后评分系统,如:Tomita、Tokuhashi、Harrington、Sioutos,Van der Linden 和 Bauer 等[8]。有研究表明 Tomita评分则在远期预后方面较为准确,而 Tokuhashi 评分在脊柱转移癌的近期预后方面较准确[9],Harrington 和其余评分方法因过于简化,不够准确等原因,在预后评估中已少采用。
1. Tomita 评分
Tomita 等[10]基于原发肿瘤的生长速度,骨转移和内脏转移灶数目这三项因素总结出了一套评分系统 ( 表1 )。其中,原发肿瘤的类型和组织学特征在 Tomita 评分中占有重要比重[11],当三项指标总和为 2~3 分时,可广泛或边缘切除;总分为 4~5 分时,边缘或病灶内切除;总分为6~7 分时,多行姑息性手术;总分为 8~10 分时,多为支持治疗。Tomita 评分易于计算,可操作性强,在术后生存质量和生存时间评价广泛应用。Padalkar 等[12]对 102 例脊柱转移癌患者分别应用 Tomita 和 Tokuhashi 评分体系评估预后。研究发现,Tomita 与患者术后生存时间相关性较Tokuhashi 评分强。同样的结果在 Wibmer 等[13]的试验中得到了验证。
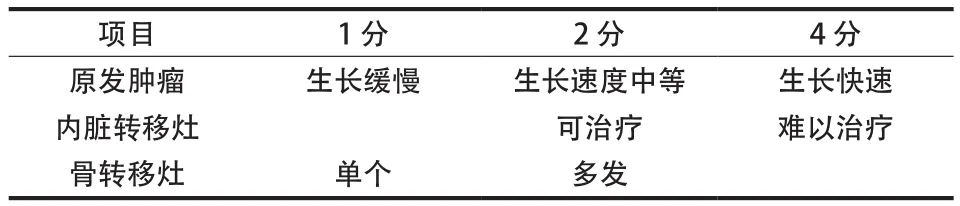
表1 Tomita 评分系统Tab.1 Tomita scoring system
2. Tokuhashi 评分
Tokuhashi 等最早在 1990 年提出,此后,为强调原发肿瘤类型的重要性,在 2005 年又对此方法进修订( 表2 )。当总分为 12~15 分时,应行脊柱转移灶切除术;总分为 9~11 时,若为单发病灶或无内脏转移可行转移病灶切除手术,否则行姑息性手术;总分为 0~8 分时,根据患者情况可选择姑息性手术或保守治疗。目前,各学者有争议的是,Tokuhashi 等发现麻痹是疾病的一个预测因素,而其他的研究者认为脊髓受压和神经病学症状与生存时间并无直接相关性。国内外多名学者对 Tokuhashi 评分的预测价值进行了研究,结果发现:Tokuhashi 评分 ( T12) 和改进的 Tokuhashi 评分 ( T15) 对脊柱转移癌近期预后均有较高的预测价值,T15比 T12更具准确性[14]。但是,在远期预后、患者生存率方面,Tokuhashi的预测价值不高。尤其是评分在 9~11 分和乳腺癌脊柱转移的患者,准确性只有 35%[15]。Tokuhashi 对不同原发灶肿瘤脊柱转移的评估准确性也不同。Wang 等[14]在一项前瞻性研究中,对 448 例不同原发灶的脊柱转移癌进行Tokuhashi 评分。发现 T12和 T15在前列癌和乳腺癌脊柱转移的患者中均有准确的预测价值,只有 T12对结肠癌有预测价值,对于肺癌,肾癌和混合癌,T12和 T15均无预测价值。T15对多发性骨髓瘤的预测价值较高。
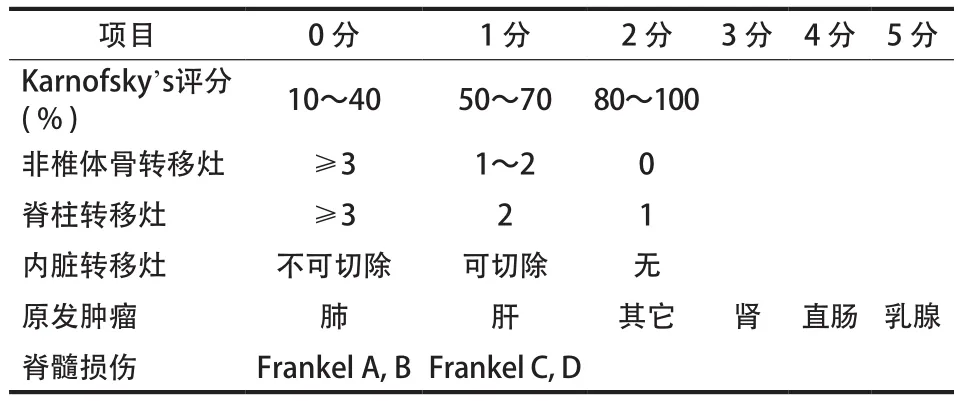
表2 Tokuhashi 评分系统Tab.2 Tokuhashi scoring system
3. Harrington 评分 Harrington 等[16-17]按照神经或骨损伤程度分为 5 级:I 级,无明显损伤;II 级,存在骨破坏,无骨折及脊柱不稳:III 级,无明显骨破坏的神经损伤:IV 级,椎体压缩性骨折伴非神经性疼痛;V 级,椎体压缩性骨折合并神经损伤。其中,后两种需手术治疗。与前两者评分系统相比,Harrington 评分过于简单,对预后评估不够细化。
手术治疗
随着手术技术水平和医疗器械的不断改进,脊柱转移癌可操作的手术方式有姑息减压术、刮除减瘤术、全脊椎整块切除术和微创手术。由于伦理学限制了双盲对照研究,各种手术方式对患者生存期的影响还没有循证医学的证据支持。因脊柱转移癌患者多为肿瘤晚期,手术耐受性差,近几年开展的微创手术恰好具有创伤小,住院时间短等特点,成为改善晚期肿瘤患者生存治疗的一种手术选择。微创联合放化疗治疗脊柱转移癌已成为目前研究热点问题。
一、姑息减压术
一般指单纯椎板切除术。多用于:肿瘤累积 2 个以上节段,拟行姑息性肿瘤切除;高度恶性硬膜外肿瘤引起神经功能障碍;保守治疗难以控制的疼痛,肿瘤生长和脊柱严重不稳等情况。这种手术方式开展较早,但不能消除肿瘤,还破坏了脊柱稳定性,有回顾性研究证实,单纯椎板切除术比放疗并发症发生率和死亡率更高[18],目前该方法已少用。
二、刮除减瘤术
包括病灶内切除和肿瘤整块切除 ( 广泛切除和边缘切除 ) 两种方式,通过减瘤实现对脊髓的环形减压。病灶内切除是指在肿瘤假包膜内行切除手术,常用于颈椎肿瘤的前路手术。边缘切除指沿肿瘤假包膜进行切除。广泛切除手术在假包膜外进行,将肿瘤连同周围正常组织一起切除,多适用于一般状况良好,仅有单个椎体受累且预计生存时间长于 1 年的患者。2010 年,Rades 等[19]通过对324 例脊柱转移癌脊髓压迫患者进行单纯放疗与刮除减瘤术联合放疗后,发现联合组行走能力更佳,1 年生存率明显高于单纯放疗组。2012 年,Kim 等[20]对 1970~2007 年33 个中心的 2495 例转移性脊髓压迫症的患者进行文献数据的 Meta 分析,发现治疗后患者在神经功能恢复 ( 64%比 29% )、瘫痪患者恢复行走能力的比例 ( 42% 比 10% )和疼痛缓解 ( 88% 比 74% ) 等指标上,减瘤术联合化疗比单纯化疗有明显优势。
三、全脊椎整块切除术 ( total en bloc spondylectomy,TES )
TES 由 Tomita 在 1994 年首次提出,该手术适用于孤立或局限的转移灶,原发病灶治疗有效,预计生存期至少 6 个月[21]。手术包括受累椎骨在内的整个肿瘤间室的节段性切除,要求既要对肿瘤完整切除,又不能破坏周围结构,操作难度和风险较高。Li 等[22]通过对 10 年 131 例脊柱转移癌患者进行 TES 与传统的分块切除术比较,发现术后中位生存期无明显差别,但局部复发率显著降低。Murakami 等[23]指出,在原发肿瘤可控,无内脏转移的情况下,TES 是脊柱转移癌患者理想的手术方案。TES 手术切除范围大,因此具有术中出血量大、手术耗时长等特点,从而增加了肿瘤细胞播散的机会。Kawahara 等[24]建议 TES 术前栓塞肿瘤血管或术中使用生物胶以减少手术出血。
四、经皮椎体成形术 ( percutaneous vertebroplasty,PVP ) 和椎体后凸成形术 ( percutaneous kyphoplasty,PKP )
随着脊柱非血管介入手术技术的发展,PVP 和 PKP被广泛应用于临床[25-26]。手术方法是在影像学技术,如DSA 机、CT 引导下经皮肤穿刺向病变椎体注入骨水泥,作为一种微创手术,PVP 具有出血量少、软组织损伤小、住院期限短及患者耐受性好等特点。适用于一般状况差,预期生存时间少于 3 个月,因脊柱病理学塌陷引起剧烈疼痛的患者。常用的填充材料有 PMMA 骨水泥,磷酸钙骨水泥,125I 粒子等。为防止骨水泥渗漏引发并发症,有研究者在骨水泥中加入钡和钨,并取得不错效果。近年来,也有研究在骨水泥材料中加入镇痛药、抑癌基因载体、抗生素,报道的效果不一,尚处于摸索阶段。PKP 在 PVP基础上,通过扩张球囊的应用,降低了骨水泥渗漏的可能,起到了缓解疼痛、矫正后凸畸形的目的。研究发现,PVP 联合放疗可显著缓解病理性骨折引发的疼痛,改善生存质量[27-28]。但不适用于对脊髓压迫的治疗。
五、射频消融术 ( radiofrequency ablation,RFA )
RFA 是在超声、CT 或内镜引导下,将电极置于肿瘤部位,通过热效应使肿瘤组织产生凝固性坏死。RFA 主要用于不能进行其它手术的晚期肿瘤患者,目前已广泛应用于肝癌、肾癌、肺癌、乳腺癌和胰腺癌的治疗。多项研究发现[29-30]RFA 在缓解患者疼痛方面有显著疗效。近年来,射频消融与 PVP、PKP 的联合治疗可以同时消除肿瘤,重建脊柱稳定性,成为新的研究热点,并且取得了较好的临床效果。在 Lane 等[31]的研究中,36 例患者接受了射频消融和骨水泥成形术联合治疗,治疗后患者疼痛评分显著下降 ( 7.2 / 10 比 3.4 / 10 )。
结 语
脊柱转移癌是原发肿瘤全身转移的一部分,治疗上不同于原发性脊柱肿瘤。因患者的生存期有限,手术时机和手术方式的选择对患者至关重要。脊柱转移癌的治疗方法和评估方案在过去 10 年间有了长足的进步,但受到病情复杂性和多样性等特点所限,目前尚无一种方案被广泛认同。因此,外科治疗研究仍任重道远,需要多中心大样本的临床资料。
[1] Laufer I, Sciubba DM, Madera M, et al. Surgical management of metastatic spinal tumors. Cancer Control, 2012, 19(2): 122-128.
[2] Jacobs WB, Perrin RG. Evaluation and treatment of spinal metastases: an overview. Neurosurg Focus, 2001, 11(6):e10.
[3] Quraishi NA, Gokaslan ZL, Boriani S. The surgical management of metastatic epidural compression of the spinal cord. J Bone Joint Surg Br, 2010, 92(8):1054-1060.
[4] Pelosi E, Pennone M, Deandreis D, et al. Role of whole body positron emission tomography/computed tomography scan with 18F-fluorodeoxyglucose in patients with biopsy proven tumor metastases from unknown primary site. QJ Nucl Med Mol Imaging, 2006, 50(1):15-22.
[5] Rades D, Douglas S, Huttenlocher S, et al. Prognostic factors and a survival score for patients with metastatic spinal cord compression from colorectal cancer. Strahlenther Onkol, 2012, 188(12):1114-1118.
[6] Kawahara N, Tomita K, Murakami H, et al. Total en bloc spondylectomy of the lower lumbar spine: a surgical techniques of combined posterior-anterior approach. Spine, 2011, 36(1):74-82.
[7] Switlyk MD, Hole KH, Skjeldal S, et al. MRI and neurological findings in patients with spinal metastases. Acta Radiol, 2012, 53(10):1164-1172.
[8] Murakami H, Kawahara N, Demura S, et al. Perioperative Complications and Prognosis for Elderly Patients with Spinal Metastases Treated by Surgical Strategy. Orthopedics, 2010, 165-168.
[9] Fisher CG, DiPaola CP, Ryken TC, et al. A novel classification system for spinal instability in neoplastic disease: an evidencebased approach and expert consensus from the Spine Oncology Study Group. Spine, 2010, 35(22):E1221-1229.
[10] Tomita K, Kawahara N, Kobayashi T, et al. Surgical strategy for spinal metastases. Spine, 2001, 26(3):298-306.
[11] Bartels RH, Feuth T, van der Maazen R, et al. Development of a model with which to predict the life expectancy of patients with spinal epidural metastasis. Cancer, 2007, 110(9): 2042-2049.
[12] Padalkar P, Tow B. Predictors of survival in surgically treated patients of spinal metastasis. Indian J Orthop, 2011, 45(4): 307-313.
[13] Wibmer C, Leithner A, Hofmann G, et al. Survival analysis of 254 patients after manifestation of spinal metastases: evaluation of seven preoperative scoring systems. Spine, 2011, 36(23):1977-1986.
[14] Wang M, Bünger CE, Li H, et al. Predictive value of Tokuhashi scoring systems in spinal metastases, focusing on various primary tumor groups: evaluation of 448 patients in the Aarhus spinal metastases database. Spine, 2012, 37(7):573-582. [15] Hernandez-Fernandez A, Vélez R, Lersundi-Artamendi A, et al. External validity of the Tokuhashi score in patients with vertebral metastasis. J Cancer Res Clin, 2012, 138(9): 1493-1500.
[16] Moon KY, Chung CK, Jahng TA, et al. Postoperative survival and ambulatory outcome in metastatic spinal tumors: prognostic factor analysis. J Korean Neurosurg Soc, 2011, 50(3):216-223.
[17] Lee BH, Kim TH, Chong HS, et al. Prognostic factor analysis in patients with metastatic spine disease depending on surgery and conservative treatment: review of 577 cases. Ann Surg Oncol, 2013, 20(1):40-46.
[18] Sheehan JP, Shaffrey CI, Schlesinger D, et al. Radiosurgery in the treatment of spinal metastases: tumor control, survival, and quality of life after helical tomotherapy. Neurosurgery, 2009, 65(6):1052-1062.
[19] Rades D, Huttenlocher S, Dunst J, et al. Matched pair analysis comparing surgery followed by radiotherapy and radiotherapy alone for metastatic spinal cord compression. J Clin Oncol, 2010, 28(22):3597-3604.
[20] Kim JM, Losina E, Bono CM, et al. Clinical outcome of metastatic spinal cord compression treated with surgical excision±radiation versus radiation therapy alone: a systematic review of literature. Spine, 2012, 37(1):78-84.
[21] Druschel C, Disch AC, Melcher I, et al. Multisegmental en bloc spondylectomy. Indications, staging and surgical technique. Oper Orthop Traumatol, 2012, 24(3):272-283.
[22] Li H, Gasbarrini A, Cappuccio M, et al. Outcome of excisional surgeries for the patients with spinal metastases. Eur Spine J, 2009, 18(10):1423-1430.
[23] Murakami H, Kawahara N, Demura S, et al. Total en bloc spondylectomy for lung cancer metastasis to the spine: Clinical article. Spine, 2010, 13(4):414-417.
[24] Kawahara N, Tomita K, Murakami H, et al. Total en bloc spondylectomy for spinal tumors: surgical techniques and related basic background. Orthop Clin Nam, 2009, 40(1):47-63.
[25] Omidi-Kashani F, Hasankhani EG, Akhlaghi S, et al. Percutaneous vertebroplasty in symptomatic hemangioma versus osteoporotic compression fracture. Indian J Orthop, 2013, 47(3):234-237.
[26] Wu J, Xu YQ, Chen HF, et al. Percutaneous kyphoplasty combined with the posterior screw-rod system in treatment of osteoporotic thoracolumbar fractures. Indian J Orthop, 2013, 47(3):230-233.
[27] Chen L, Lin J, Zhu X, et al. Improved percutaneous kyphoplasty for diagnosis and treatment of thoracolumbar metastatic spine tumors. Zhongguo Xiu Fu Chong Jian Wai Ke Za Zhi, 2011, 25(11):1298-1301.
[28] Zuozhang Y, Lin X, Hongpu S, et al. A patient with lung cancer metastatic to the fifth thoracic vertebra and spinal cord compression treated with percutaneous vertebroplasty and I-125 seed implantation. Diagn Interv Radiol, 2011, 17(4):384-387.
[29] Thanos L, Mylona S, Galani P, et al. Radiofrequency ablation of osseous metastases for the palliation of pain. Skeletal Radiol, 2008, 37(3):189-194.
[30] Gazis A, Beuing O, J☒llenbeck B, et al. Bipolar Radio Frequency Ablation of Spinal Neoplasms in Late Stage C ancer Disease: A Report of Three Cases. Spine, 2012, 37(1):E64-68.
[31] Lane MD, Le HB, Lee S, et al. Combination radiofrequency ablation and cementoplasty for palliative treatment of painful neoplastic bone metastasis: experience with 53 treated lesions in 36 patients. Skeletal Radiol, 2011, 40(1):25-32.
( 本文编辑:马超 )
Preoperative assessment and evaluation of the surgical approach for spinal metastatic tumors
LI Jin-hong, HU Bo, SUN Hong-zhen. Department of Orthopedics, the ffth People’s Hospital of Jiulongpo District, Chongqing, 401329, PRC
With the evolution of surgical techniques, extensive use of implants, and increase of the demand for higher living quality in patients, the treatment concept of spinal metastatic tumors has gradually changed in recent years. Simple chemoradiotherapy has been gradually replaced by the active surgical treatment in combination with chemoradiotherapy. Surgical treatment begins to play a more and more important role in curing spinal metastatic tumors. However, there are no unifed opinions about the selections of surgical timing and surgical approach so far. How to select the reasonable surgical treatment method becomes the most diffcult in curing spinal metastatic tumors. Surgeons should cautiously balance the surgical risks and the postoperative improvement of the living quality, and make a reasonable surgical assessment. This review focuses on the recent advances in the preoperative evaluation and the treatment of spinal metastatic tumors.
Antineoplastic protocols; Program evaluation; Surgical procedures, operative; Bone neoplasms; Neoplasm metastasis
10.3969/j.issn.2095-252X.2014.01.014
R738.1
401329 重庆,九龙坡区第五人民医院骨科 ( 李金洪 );400042 重庆,第三军医大学第三附属医院脊柱外科 ( 胡波,孙红振 )
孙红振,Email: Hyings51@163.com
2013-08-07 )

