体外条件下 TGF-β3、BMP-2 和 DEX 诱导兔滑膜间充质干细胞向软骨细胞谱系分化的研究
符培亮 丛锐军 张雷 丁 如 陈松 李林涛 许震宇 吴海山 吴宇黎
体外条件下 TGF-β3、BMP-2 和 DEX 诱导兔滑膜间充质干细胞向软骨细胞谱系分化的研究
符培亮 丛锐军 张雷 丁 如 陈松 李林涛 许震宇 吴海山 吴宇黎
目的本实验拟将分离纯化得到的滑膜间充质干细胞 ( synovial-derived mesenchymal stem cells,SMSCs ) 在体外培养条件下进行成软骨刺激诱导,并从转录和翻译两个水平寻找进入软骨细胞分化谱系的证据,进而判断转化生长因子 β3 ( transforming growth factor-β3,TGF-β3 )、骨形态发生蛋白 ( bone morphogenetic protein-2,BMP-2 ) 和地塞米松 ( dexamethasone,DEX ) 诱导 SMSCs 进入软骨细胞分化谱系。方法贴壁法分离纯化得到 SMSCs,在体外培养条件下用含 500 ng / ml BMP-2、10 ng / ml TGF-β3、10-7M DEX 的高糖 DMEM 培养基进行刺激诱导,并在倒置相差显微镜下观察分化过程中其形态学的变化,以 RTPCR 检测 I、II 型胶原及软骨特异性 Aggrecan ( AGN ) 的 mRNA 表达,细胞免疫荧光化学染色的方法检测细胞分化过程中 I、II 型胶原的表达,碱性甲苯胺蓝细胞化学染色检测软骨特异性 GAG 的表达,证实 SMSCs 的诱导成软骨作用。结果SMSCs 在前述诱导条件下,诱导后 14 天细胞逐渐由小梭形变为多角形、类软骨细胞样形态,RT-PCR 可以检测到 I、II 型胶原及 AGN 基因的表达,细胞免疫荧光化学染色 I、II 型胶原、碱性甲苯胺蓝细胞化学染色结果呈阳性。而未经诱导的 SMSCs 形态基本保持梭形,基因表达和染色呈阴性,两组间差异显著。细胞免疫荧光化学染色分析 SMSCs 在软骨诱导培养基中诱导后 14 天表达 I、II 型胶原;未经诱导的SMSCs 不表达 I、II 型胶原。说明 SMSCs 在软骨诱导培养基中诱导后 14 天进入软骨细胞分化谱系,可作为种子细胞在同样的诱导条件下向软骨分化。结论SMSCs 作为新的 MSCs 家族成员,显示出与 BMSCs 相似的多向分化潜能,500 ng / ml BMP-2、10 ng / ml TGF-β3、10-7M DEX 的高糖 DMEM 培养基中培养后 14 天,SMSCs已进入软骨细胞分化谱系。SMSCs 可作为半月板组织工程的种子细胞。
间质干细胞;软骨细胞;细胞转分化;转化生长因子
滑膜间充质干细胞 ( synovial-derived mesenchymal stem cells,SMSCs ) 经分离、纯化、培养后,尚不能直接用作半月板组织工程的种子细胞,其原因在于 SMSCs 具有多向分化的潜能,在一定的诱导条件下可以分化为软骨细胞、成骨细胞、脂肪细胞及骨骼肌细胞等[1-4]。为了促使已在体外分离并扩增的 SMSCs 向软骨细胞谱系分化,尚需要特定的细胞因子对其进行刺激和诱导。
本实验拟将分离纯化得到的 SMSCs 在体外培养条件下用含 500 ng / ml BMP-2 ( bone morphogenetic proteins-2 骨形态发生蛋白 -2 )、10 ng / ml TGF-β3 ( transforming growth factor-β3 转化生长因子 β3 )、10-7M DEX ( dexamethasone 地塞米松 ) 的高糖 DMEM培养基进行刺激诱导,并在倒置相差显微镜下观察分化过程中其形态学的变化,以 RT-PCR 检测 I、II 型胶原及软骨特异性 Aggrecan 的 mRNA 表达,细胞免疫荧光化学染色的方法检测细胞分化过程中I、II 型胶原的表达,碱性甲苯胺蓝细胞化学染色检测软骨特异性 GAG 的表达,从转录和翻译两个水平寻找进入软骨细胞分化谱系的证据,进而借此判断联合使用 TGF-b3、BMP-2 和 DEX 是否能够诱导SMSCs 进入软骨细胞分化谱系。
材料与方法
一、材料
向软骨细胞方向诱导条件培养基:含 0.1 μmol / L DEX,10 ng / ml TGF-β3,500 ng / ml BMP-2 的DMEM HG 完全培养液;第一抗体:I 型胶原 ( 小鼠单克隆抗体 1∶100 )、II 型胶原 ( 小鼠单克隆抗体1∶100 ),第二抗体:羊抗小鼠 IgG-FITC 1∶100,羊抗小鼠 IgG-Cy3 1∶100,均购自 Sigma。RNA 抽提试剂盒购自上海生工生物技术有限公司;逆转录酶及相关试剂购自 Promega 公司;DNase I 及相关试剂购自 MBI 公司;PCR 相关试剂购自上海博光生物公司;琼脂糖 ( BBI 公司生产 ) 购自上海增建生物科技有限公司;自配 TAE 电泳缓冲液 ( 50× )、溴化乙锭 ( ethidium bromide,EB ) 溶液 ( 10 mg / ml )、电泳加样缓冲液 ( 6× )。
二、方法
1. 实验动物和细胞来源:5 只成年新西兰白兔平均 15 个月龄,体重 ( 2.2±0.65 ) kg,第二军医大学伦理委员会批准,膝关节活检、无菌条件下取1 cm×1 cm 滑膜组织 ( synovial membrane,SM ),无菌 PBS ( phosphate-buffered saline solution,Gibco BRL Life Technologies,Carlsbad,CA,USA ) 冲洗后剪碎组织块,放入 DMED ( Dulbecco’s modified Eagle’s medium Gibco BRL ) 培养基内培养,加入 1% ( v / v ) 抗生素 ( 10 000 U / ml 青霉素,10 000 μg / ml链霉素,25 μg / ml 两性霉素 B;Gibco BRL )。在DMEM ( Dulbecco modified Eagle medium;Gibco BRL )溶液中加入细菌胶原蛋白酶 II ( Gibco BRL ) 消化组织块。37 ℃ 孵育过夜,40- μm 尼龙细胞滤器移除不溶物。150 g 4 ℃ 离心 7 min ( 离心半径 13.5 cm,转速 1500 r / min ),DMEM 冲洗两遍后重悬收获细胞。37 ℃、5% CO2培养细胞后 72 h 获得贴壁细胞,移除未贴壁细胞。37 ℃、5% CO2α-MEM 培养基中加入小牛血清,培养细胞每周换液 2 次,待细胞长满培养皿后,胰蛋白酶消化传代,获得形态相似的贴壁细胞。
2. 干细胞鉴定:( 1 ) 流式细胞技术:使用流式细胞仪鉴定贴壁细胞的 CD44,CD105,CD90,CD13,CD14,CD106,CD17,CD34,CD73,CD81,SSEA-4 和 CD45 抗原。细胞经 75% 冰甲醇PBS 溶液 4 ℃ 冰浴 30 min,反复冲洗 3 次,胎牛血清 ( fetal bovine serum,FBS ) 封闭抗原,2×105细胞株使用鼠抗兔抗原标记前述 CD 抗原,单抗来源于BD Pharmingen ( San Diego,CA,USA )。阴性对照使用相同浓度的细胞,不进行抗原标记。使用 Becton Dickinson FACS Calibur 流式细胞仪和 CellQuest 软件 ( Becton Dickinson ) 进行检测和分析。( 2 ) 贴壁细胞的多向分化潜能鉴定:① 成软骨分化:体外微团培养无血清 DMEM 培养基内加入 10 ng / ml 转化生长因子 β3 ( transforming growth factor β3 TGF-β3 Biosource,Nivelles,Belgium ),移取 20 μl 2×107cells / ml SMSCs 悬液在 24 孔板内,贴壁 3 h。培养体系内加入 50 μg / ml 抗坏血酸,50 mg / ml ITS+TMPremix ( 6.25 μg / ml 胰岛素,6.25 μg / ml 转铁蛋白,6.25 ng / ml 亚硒酸,1.25 mg / ml 牛蛋白血清( bovine serum albumin,BSA ),5.35 mg / ml 亚麻酸( Sigma USA ),100 nM 地塞米松 ( Dexamethasone DEX Sigma USA )。每 2 天更换培养基维持 TGF-β3浓度为 10 ng / ml。培养后 2 周 PBS 冲洗,-20 ℃ 甲醇固定 30 min,pH0.2 条件下甲苯胺蓝 ( 0.5% 甲苯胺蓝 8 GS ( Carl Roth,Karlsruhe,Germany ) 加入 1 N HCl ) 染色过夜,蒸馏水反复冲洗后,200 μl 6 M 盐酸胍室温下萃取,分光光度法测定 630 nm 吸光值,定量分析。② 成骨分化:如前步骤 24 孔板内加入诱导成骨培养基,包含 10-7M DEX,0.2 mM 柠檬酸,10 mM β- 甘油磷酸盐培养 21 天,3 周后根据蛋白质含量得到标准化的钙含量,总钙量使用“ μg / μg 蛋白”表达。二喹啉甲酸 ( bicinchoninic acid,BCA ) 法测定蛋白质含量,BSA 作为标准。③ 成脂分化:用成脂分化的培养基替代前述培养基,包括10-6M DEX、0.5 mM 3- 异丁基 -1- 甲基黄嘌呤、100 μM 吲哚美辛、10 μg / ml 胰岛素。21 天后多聚甲醛固定 1 h,红油 O 染色 2 h。
3. 体外诱导滑膜间充质干细胞向软骨细胞方向分化:向软骨细胞诱导的培养基包括:45 ml DMEM HG、5 ml FBS、5 μl 1 mol / L DEX、50 μl 10 μg / ml TGF-β3、50 μl 0.5 mg / ml BMP-2、0.5 ml 100×P / S。滑膜间充质干细胞向软骨细胞分化的诱导:将涂有多聚赖氨酸的盖玻片置于 60 mm 的培养皿中,按50 cells / cm2接种第三代 SMSCs,当盖玻片上的细胞生长至 20% 融合时,换向软骨诱导的条件培养基继续培养 14 天,每 3 天换 1 次液。
4. 分化过程的形态学观察和分子表型的检测:每天在倒置相差显微镜下观察并通过显微摄影记录细胞形态和生长状况。( 1 ) RT-PCR 检测:收集加入诱导培养基后第 0 天,第 14 天的细胞,抽提总RNA,通过 RT-PCR 检测细胞分化过程中 I、II 型胶原及细胞外基质 Aggrecan 的 mRNA 表达。同时以未诱导的第三代 SMSCs 作为对照。细胞总 RNA 的抽提:实验前将与 RNA 接触的玻璃器皿洗净后置于 180 ℃ 烘烤 8 h,不耐高温的耗材浸泡于 0.1% 的DEPC 溶液中 12 h,70 ℃ 烘烤干燥,然后于 121 ℃高压灭菌 15 min,而后烘干。将贴壁培养的细胞消化成单细胞悬液,1500 r / min 离心后 5 min,完全弃去上清液,用“EZ Spin Column RNA Isolation Kit”试剂盒抽取细胞总 RNA。加入水溶解 RNA。保存于 -70 ℃。逆转录反应液配制:4 µl 细胞 RNA 样品、反应液配平到 20 µl 后包含 0.5 µl dT-Adaptor引物 ( Gibco BRL ),浓度为 50 mM Tris-HCl ( pH 8.3 ),75 mM KCl,3 mM MgCl2,40 mM 二硫苏糖醇 ( dithiothreitol DTT ),0.5 mM 脱氧核糖核酸混合液 ( deoxynucleotide triphosphate dNTP,Invitrogen,Carlsbad,CA,USA ),10 unit RNase 抑制剂 ( Gibco BRL ),200 单位逆转录酶。37 ℃ 逆转录 60 min后,70 ℃ 作用 15 min 终止反应。使用 1 µl of E. coli RNase H ( 4 mg / ml ) 清除 RNA 模板,37 ℃ 反应30 min。使用前一步获取的 cDNAs 作为模板进行PCR 扩增,使用特异的基因引物扩增目的基因和内参基因:3- 磷酸甘油醛 ( glyceraldehyde 3-phosphate dehydrogenase GAPDH ) 基因。引物表见表1。扩增反应在自动扩增仪 GeneAmp PCR System 2400 ( Applied Biosystems, Foster City,CA,USA ) 内完成25 μl 反应体系内包含 4 μl cDNA 溶液,4 μl of cDNA solution,20 mM Tris-HCl ( pH 8.4 ),50 mM KCl,1.5 mM MgCl2,0.1% Triton X-100,0.2 mM dNTP混合液,0.4 pM 引物以及 5 单位的 DNA 聚合酶( Promega,Madison,WI,USA )。反应条件:95 ℃5 min 后变性,进入循环:94 ℃ 30 sec → 55 ℃30 sec → 72 ℃ 1 min 循环 30 次,然后 72 ℃ 延长10 min,扩增产物经 1.5% 琼脂糖凝胶电泳后紫外灯下观察。( 2 ) 细胞免疫荧光化学染色:将长有细胞的盖玻片在加入诱导培养基后第 0 天,第 14 天取出,进行细胞免疫荧光化学染色检测细胞分化过程中 I、II 型胶原的表达。同时以未诱导的第三代SMSCs 作为对照。将涂有多聚赖氨酸的盖玻片置于60 mm 的培养皿中,接种细胞;分别在加入诱导培养基后第 0 天,第 14 天取出长有细胞的盖玻片,PBS 洗 3 次,用 4% 多聚甲醛 4 ℃ 固定 30 min;37 ℃ 干燥 2 h,将盖玻片细胞面向上用中性树胶粘在载玻片上。用 PBS 洗 3 次,每次 5 min。用含4% 山羊血清的 PBS 对细胞的非特异性结合位点封闭 15 min。加第一抗体,4 ℃ 孵育过夜。用 PBS 洗3 次,每次 5 min。加入二抗,分别为 FITC 标记-羊抗小鼠 IgG ( 1∶100 ),Cy3 标记-羊抗小鼠IgG ( 1∶150 ),室温反应 1 h,PBS 洗 3 次,每次5 min。DAPI 染核,用荧光显微镜观察。每次免疫荧光化学染色时,均设一张阴性对照片,不加一抗,其余过程相同。( 3 ) 碱性甲苯胺蓝细胞化学染色:将长有细胞的盖玻片在加入诱导培养基后第 14 天取出,进行碱性甲苯胺蓝细胞化学染色检测细胞分化过程中软骨特异性的 GAG。同时以未诱导的第三代 SMSCs 作为对照。将长有细胞的盖玻片在加入诱导培养基后第 14 天取出,PBS 洗 3 次,丙酮室温固定 15 min,将盖玻片细胞面向上用中性树胶粘在载玻片上。PBS 浸洗 3 次,0.1% 碱性甲苯胺蓝液浸染15 min。蒸馏水洗,洗去多余染液。冰醋酸分化至胞核和颗粒清晰,乙醇梯度脱水,二甲苯透明,中性树胶封片,光镜下观察。

表1 RT-PCR 引物列表Tab.1 The list of RT-PCR primers
结 果
一、兔滑膜间充质干细胞 SMSCs 向软骨细胞诱导分化过程中细胞形态学观察
第三代兔滑膜间充质干细胞 SMSCs 在软骨诱导培养基 ( 10 ng / ml TGF-β3,500 ng / ml BMP-2,0.1 μmol / L DEX ) 的诱导条件下,细胞形态发生明显变化,诱导后 14 天细胞逐渐由小梭形变为多角形,类似软骨细胞样形态 (图1B )。而未经诱导的 SMSCs形态基本保持梭形 (图1A )。
二、RT-PCR 检测诱导后 rSMSCs-2012-3 软骨细胞相关分子的表达
SMSCs 在软骨诱导培养基中诱导后 14 天,RTPCR 可以检测到 I、II 型胶原及软骨特异性的聚集蛋白聚糖 ( aggrecan ) mRNA 表达,而未经诱导的rSMSCs-2012-3 不表达 I、II 型胶原及 aggrecan。以上进一步说明 rSMSCs-2012-3 在体外可向软骨方向诱导分化 (图2 )。
三、细胞鉴定
流式细胞仪得到 SMSCs 呈 CD90、CD13、CD14、CD106、CD81、CD73、CD44 阳性,CD45、CD14、CD34 阴性,未分化的间充质干细胞 CD151阴性,成软骨诱导后的 CD151 阳性 (图3 )。贴壁细胞具有成骨、成软骨、成脂能力,符合多能干细胞标准 (图4 ),可以证明获得的贴壁细胞是来源于滑膜的多能间充质干细胞。
四、向软骨细胞诱导后 SMSCs 表达 I、II 型胶原及糖胺聚糖

图1 rSMSCs-2012-3 向软骨诱导培养 14 天时形态学变化( ×200 ) A:未诱导的第三代 rSMSCs-2012-3 呈小梭形;B:第三代 rSMSCs-2012-3 诱导培养后 14 天呈多角形Fig.1 The morphological changes of rabbit SMSCs-2012-3 ( rSMSCs-2012-3 ) after 14 days’ induction in DMEM ( ×200 ) A: The 3rd generation of rSMSCs-2012-3 without the induction showed small spindle morphology; B: The 3rd generation of induced rSMSCs-2012-3 showed polygonal morphology

图2 培养 14 天时 RT-PCR 检测 I、II 型胶原及 Aggrecan 的mRNA ( 1 为诱导后的第三代 SMSCs 细胞;2 为未经诱导的第三代 SMSCs 细胞; Marker:Oso-M1200 100bp DNA Ladder 50T )Fig.2 Collagen I, collagen II and mRNA of AGN were detected by RT-PCR at the 14th day of induction. ( 1: The 3rd generation of induced SMSCs; 2: The 3rd generation of SMSCs without induction; Marker: Oso-M1200 100bp DNA Ladder 50T )
细胞免疫荧光化学染色分析 SMSCs 在软骨诱导培养基中诱导后 14 天表达 I、II 型胶原;未经诱导的 SMSCs 不表达 I、II 型胶原。说明 SMSCs 在软骨诱导培养基中诱导后 14 天进入软骨细胞分化谱系,可作为种子细胞在同样的诱导条件下向软骨分化(图5,6 )。
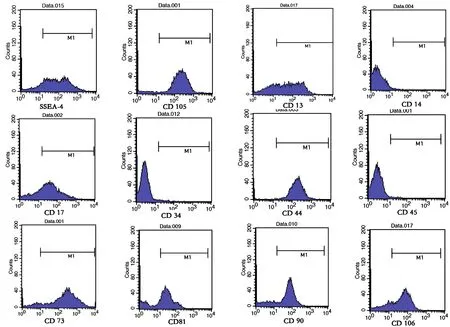
图3 流式细胞仪得到 SMSCs 呈 CD90、CD13、CD14、CD106、CD81、CD73、CD44 阳性,CD45、CD14、 CD34 阴性,未分化的间充质干细胞 CD151 阴性,成软骨诱导后的 CD151 阳性Fig.3 The fow cytometry showed CD90, CD13, CD14, CD106, CD81, CD73 and CD44 were positive, and CD45, CD14 and CD34 were negative. The undifferentiated mesenchymal stem cell CD151 was negative, and became positive after chondrogenic differentiation
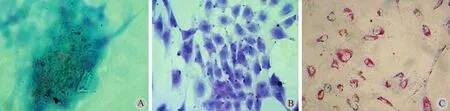
图4 三向分化实验 ( 100× ) A:钙结节染色鉴定成骨方向分化;B:甲苯胺蓝染色鉴定成软骨方向分化;C:红油 O 染色鉴定成脂方向分化Fig.4 Three differentiation experiments ( 100× ) A: Identifcation of osteogenic differentiation with the calcium nodule staining; B: Identifcation of cartilage differentiation with the toluidine blue staining; C: Identifcation of adipogenic differentiation with the Oil Red O staining
碱性甲苯胺蓝细胞化学染色结果显示第三代SMSCs 在软骨诱导培养基中诱导后 14 天,细胞外基质中 GAG 分泌,说明诱导分化的细胞具备软骨细胞特异的分泌特性。而未经诱导的 SMSCs 则不分泌GAG (图7 )。
讨 论
SMSCs 作为新的 MSCs 家族成员,显示出与BMSCs 相似的多向分化潜能,在体外不同的诱导条件下 SMSCs 可以向不同的组织细胞分化。Sakaguchi等[5]发现 SMSCs 在添加 10-7M 地塞米松、0.5 mM异丁基 -1- 甲基黄嘌呤和 50 μM 吲哚美辛的培养基中培养后 21 天,石蜡切片油红 O 染色阳性,提示 SMSCs 有向脂肪细胞分化的潜能;SMSCs 在含有10-9M 地塞米松、20 mM β- 磷酸甘油脂、50 μg / ml维生素 C 二磷酸盐的培养基中培养后 21 天,石蜡切片茜素红染色阳性,提示 SMSCs 有向骨骼细胞分化的潜能。

图5 细胞免疫荧光化学染色显示 SMSCs 向软骨诱导培养 14 天时 I 型胶原表达状态。DAPI 染核 ( ×200 ) A:未诱导的 SMSCs不表达 I 型胶原;B:SMSCs 诱导培养后 14 天表达 I 型胶原Fig.5 The immunofluorescence staining showed the expression status of collagen I after SMSCs were induced to chondrocytes for 14 days. The 4’,6-diamidino-2-phenylindole ( DAPI ) nuclear staining ( ×200 ) A: SMSCs didn’t express collagen I without induction; B. SMSCs expressed collagen I after 14 days’ induction
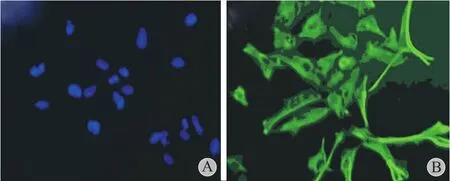
图6 细胞免疫荧光化学染色显示 SMSCs 向软骨诱导培养 14 天时 II 型胶原表达状态 ( DAPI 染核,×200 ) A:未诱导的 SMSCs不表达 II 型胶原;B:SMSCs 诱导培养后 14 天表达 II 型胶原Fig.6 The immunofluorescence staining showed the expression status of collagen II after SMSCs were induced to chondrocytes for 14 days ( DAPI nuclear staining, ×200 ) A: SMSCs didn’t express collagen II without induction; B: SMSCs expressed collagen II after 14 days’ induction
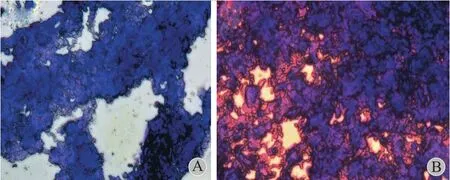
图7 碱性甲苯胺蓝细胞化学染色显示 SMSCs 向软骨诱导培养14 天时 GAG 分泌情况 ( ×200 ) A:未诱导的 SMSCs 细胞外基质中无 GAG 分泌;B:SMSCs 诱导培养后 14 天分泌 GAGFig.7 The alkaline toluidine blue staining showed the GAG status after SMSCs were induced to chondrocytes for 14 days ( ×200 ) A: SMSCs didn’t secrete GAG in the stroma without induction; B: SMSCs secreted GAG after 14 days’ induction
我们在实验中发现,将 SMSCs 在添加 500 ng / ml BMP-2、10 ng / ml TGF-β3、10-7M DEX 的高糖 DMEM 培养基中培养后 14 天,细胞逐渐由小梭形变为多角形,出现类似软骨细胞样的形态。RTPCR 检测到 I、II 型胶原及软骨特异性聚集蛋白聚糖( aggrecan ) mRNA 的表达,细胞免疫荧光化学染色也证实有 I、II 型胶原的表达,同时碱性甲苯胺蓝细胞化学染色也证实有软骨细胞特异性的胞外基质 GAG成分,这表明 SMSCs 已进入软骨细胞分化谱系。
间充质干细胞在分化过程中要依赖于细胞-细胞和细胞-基质间的相互作用,通常是通过胞外信号分子诱导和调控的[6]。目前用于诱导 SMSCs 向软骨细胞分化的培养基中常含有不同浓度的 DEX、TGF-βs 和 BMPs[1,5,7]。DEX 能促进细胞的有丝分裂,还能抑制 MSCs 向脂肪细胞分化,并可与 MSCs的糖皮质激素受体结合,激活细胞表面受体从而促进 MSCs 软骨细胞分化[8-9]。TGF-βs 与其受体结合后激活磷酸化信号转导途径,信号通过 smad 和非smad 途径传导至胞核,进而激活转录因子 SOX-9,诱导软骨生成相关基因的表达[10-11]。分子生物学技术证实该基因在软骨生成中的有重要作用,将表达SOX-9 基因质粒转染至细胞可以获得软骨表型,而敲除该基因则不能生成软骨[12-13]。Nishimura 等[14]证实兔 SMSCs 在含有 DEX 的软骨培养基中培养时,TGF-β3 能够诱导 SMSCs 合成软骨细胞重要的标志物-II 型胶原。
另外,BMPs 在 SMSCs 向软骨细胞分化过程中也发挥着重要的作用。Johnstone 等[15]首先报道单独使用 TGF-β 在体外能促进 BMSCs 向软骨细胞分化并形成软骨。但是后来大量的研究表明单独添加 TGF-β 并不能使得 MSCs 充分分化为软骨细胞。Sekiya 等[16]在 TGF-β 基础上额外添加 BMP-6 后使得软骨细胞团重量增加了 10 倍,蛋白聚糖染色范围也大大增加。Sekiya 等[17]又比较了 BMP-2、BMP-4、BMP-6 在体外促进 BMSCs 向软骨细胞转化时的影响,发现 BMP-2 效率最高。后来 Sakaguchi等[5]在评价细胞因子促进 SMSCs 向软骨细胞转化并形成软骨的影响时,发现以联合使用 BMP-2 和TGF-β3 最有效。Yokoyama 等[18]在体外诱导 SMSCs向软骨细胞分化时,比较了在高糖 DMEM 培养基中不添加和联合添加 BMP-2、TGF-β3 和 DEX 对软骨细胞分化的影响,结果发现联合添加上述细胞因子时可以显著增加软骨细胞团体积和软骨基质的合成分泌。
因此本实验中我们选择添加 500 ng / ml BMP-2、10 ng / ml TGF-β3、10-7M DEX 的高糖 DMEM 作为培养基,促使 SMSCs 向软骨细胞谱系分化,以期获得半月板组织工程的种子细胞。
与几乎完全表达 II 型胶原的透明软骨不同,正常半月板纤维软骨组织中胶原成分中 I 型胶原占绝大多数,II 型胶原只占很小的一部分。我们在体外单层培养下培养后 14 天发现经诱导后的 SMSCs 既分泌 I 型胶原,也分泌 II 型胶原,所以我们只能说是经诱导后的 SMSCs 进入了软骨细胞分化谱系。我们认为 SMSCs 形成最终的纤维软骨细胞终期表现型表达是一个多因素决定的复杂过程,受到体内微环境、细胞因子、局部生物力学刺激和关节腔内低氧环境等多种因素的影响,而难以在体外培养条件下通过模拟体内环境的方法实现。因此,在后续实验中,我们设计将已经诱导进入软骨细胞分化谱系的SMSCs 借助小肠黏膜下层作为支架回植入体内,希望在体内环境中能完成纤维软骨细胞的终期表现型表达。
在本实验中,我们采用体外单层诱导培养的方法将 SMSCs 在添加 500 ng / ml BMP-2、10 ng / ml TGF-β3、10-7M DEX 的高糖 DMEM 培养基中培养后14 天,细胞逐渐由小梭形变为多角形,出现类似软骨细胞样的形态。RT-PCR 检测到 I、II 型胶原及软骨特异性聚集蛋白聚糖 ( aggrecan ) mRNA 的表达,细胞免疫荧光化学染色也证实有 I、II 型胶原的表达,同时碱性甲苯胺蓝细胞化学染色也证实有软骨细胞特异性的胞外基质 GAG 成分,这表明其已成功分化为软骨细胞或者说已进入软骨细胞分化谱系,可作为半月板组织工程的种子细胞。
[1] De Bari C, Dell’Accio F, Tylzanowski P, et al. Multipotent mesenchymal stem cells from adult human synovial membrane. Arthritis Rheum, 2001, 44(8):1928-1942.
[2] Li J, Pei M. Optimization of an in vitro three-dimensional microenvironment to reprogram synovium-derived stem cells for cartilage tissue engineering. Tissue Eng Part A, 2011, 17(5-6):703-712.
[3] Bhardwaj N, Kundu SC. Chondrogenic differentiation of rat MSCs on porous scaffolds of silk fibroin/chitosan blends. Biomaterials, 2012, 33(10):2848-2857.
[4] Pei M, He F. Extracellular matrix deposited by synoviumderived stem cells delays replicative senescent chondrocyte dedifferentiation and enhances redifferentiation. J Cell Physiol, 2012, 227(5):2163-2174.
[5] Li J, He F, Pei M. Creation of an in vitro microenvironment to enhance human fetal synovium-derived stem cell chondrogenesis. Cell Tissue Res, 2011, 345(3):357-365.
[6] Shi Y, Massagué J. Mechanisms of TGF-beta signaling from cell membrane to the nucleus. Cell, 2003, 113(6):685-700.
[7] Nagase T, Muneta T, Ju YJ, et al. Analysis of the chondrogenic potential of human synovial stem cells according to harvest site and culture parameters in knees with medial compartment osteoarthritis. Arthritis Rheum, 2008, 58(5):1389-1398.
[8] Lee SY, Nakagawa T, Reddi AH. Mesenchymal progenitor cells derived from synovium and infrapatellar fat pad as a source for superficial zone cartilage tissue engineering: analysis of superfcial zone protein/lubricin expression. Tissue Eng Part A, 2010, 16(1):317-325.
[9] Awad HA, Butler DL, Boivin GP, et al. Autologous mesenchymal stem Cells-mediated repair of tendon. Tissue Eng, 1999, 5(3):267-277.
[10] Jones BA, Pei M. Synovium-derived stem cells: a tissuespecific stem cell for cartilage engineering and regeneration. Tissue Eng Part B Rev, 2012, 18(4):301-311.
[11] Qi J, Chen A, You H, et al. Proliferation and chondrogenic differentiation of CD105-positive enriched rat synoviumderived mesenchymal stem cells in three-dimensional porous scaffolds. Biomed Mater, 2011, 6(1):15-26.
[12] Bi W, Huang W, Whitworth DJ, et al. Haploinsufficiency of Sox9 results in defective cartilage primordia and premature skeletal mineralization. Proc Natl Acad Sci USA, 2001, 98(12): 6698-6703.
[13] Tsuchiya H, Kitoh H, Sugiura F, et al. Chondrogenesis enhanced by overexpression of sox9 gene in mouse bone marrow-derived mesenchymal stem cells. Biochem Biophys Res Commun, 2003, 301(2):338-343.
[14] Nishimura K, Solchaga LA, Caplan AI, et a1. Chondroprogenitor cells of synovial tissue. Arthritis Rheum, 1999, 42(12): 2631-2637.
[15] Johnstone B, Hering TM, Caplan AI, et a1. In vitro chondrogenesis of bone marrow-derived mesenchymal progenitor cells. Exp Cell Res, 1998, 238(1):265-272.
[16] Sekiya I, Colter DC, Prockop DJ. BMP-6 enhances chondrogenesis in a subpopulation of human marrow stromal cells. Biochem Biophys Res Commun, 2001, 284(2): 411-418.
[17] Sekiya IL, Larson BL, Vuoristo JT, et a1. Comparison of effect of BMP-2, -4, and -6 on in vitro cartilage formation of human adult stem cells from bone marrow stroma. Cell Tissue Res, 2005, 320(2):269-276.
[18] Yokoyama A, Sekiya I, Miyazaki K, et a1. In vitro cartilage formation of composites of synovium-derived mesenchymal stem cells with collagen gel. Cell Tissue Res, 2005, 322(2): 289-298.
( 本文编辑:王永刚 )
Induction of rabbit synovial-derived mesenchymal stem cells into the chondrocyte lineage with the synergic stimulation of TGF-β3, BMP-2 and DEX in vitro
FU Pei-liang, CONG Rui-jun, ZHANG Lei, DING Zhe-ru, CHEN Song, LI Lin-tao, XU Zhen-yu, WU Hai-shan, WU Yu-li. Department of Orthopedics, Shanghai Changzheng Hospital, the second Military Medical University, Shanghai, 200003, PRC
ObjectiveTo explore that synovial-derived mesenchymal stem cells ( SMSCs ) differentiated into the chondrocyte lineage induced by transforming growth factor-β3 ( TGF-β3 ), bone morphogenetic protein-2 ( BMP-2 ), and dexamethasone ( DEX ) in vitro culture conditions. After isolation and purification, SMSCs were induced to chondrocytes, which was certifed on the transcriptional and translational levels.MethodsSMSCs were obtained after isolation and purification by the adherence method, which were induced in high glucose Dulbecco modifed Eagle medium ( DMEM ) containing 500 ng/ml BMP-2, 10 ng/ml TGF-β3 and 10-7M DEX in vitro culture conditions. The morphologic changes during the differentiation process were observed using the inverted phase contrast microscope, and collagen I, collagen II and messenger-Ribonucleic Acid ( m-RNA ) expressions of cartilagespecific Aggrecan ( AGN ) were detected by Reverse Transcription-Polymerase Chain Reaction ( RT-PCR ). The immunofuorescence staining was used to detect the expressions of collagen I and II during the differentiation process, and the alkaline toluidine blue staining was used to detect the expressions of cartilage-specifc group-specifc antigen gene ( GAG ) to confrm the capability of SMSCs to differentiate into the chondrocyte lineage.ResultsAfter 14 days’induction, the small spindle SMSCs were gradually changed into the polygonal morphology, just like the chondrocytes.Collagen I, collagen II and expressions of AGN could be detected by RT-PCR. The results of immunofuorescence staining of collagen I and II and alkaline toluidine blue staining were positive. Without the induction, SMSCs basically maintained the spindle-shape morphology, and the gene expressions and staining results were negative. The differences between them were statistically signifcant. Based on the results of immunofuorescence staining, SMSCs expressed collagen I and II after 14 days’ induction in DMEM. Without the induction, SMSCs did not express collagen I or II. It was illustrated that SMSCs differentiated into the chondrocyte lineage after 14 days’ induction in DMEM, which could be used as the seed cells to differentiate into chondrocytes under the same condition.ConclusionsAs a new member in the family of mesenchymal stem cells ( MSCs ), SMSCs show the multi-differentiation potential which is similar to that of bone marrow-derived mesenchymal stem cells ( BMSCs ). After induced in the high glucose DMEM containing 500 ng/ml BMP-2, 10 ng/ml TGF-β3 and 10-7M DEX, SMSCs enter into the chondrocyte lineage at the 14th day, which can be used as the seed cells for the meniscus tissue engineering.
Mesenchymal stem cells; Chondrocytes; Cell transdifferentiation; Transforming growth factors
10.3969/j.issn.2095-252X.2014.02.013
Q23
国家自然科学基金青年科学基金项目 ( 81000798 )
200003上海市长征医院骨科
吴宇黎,Email: wuyuli6019@189.cn
2013-01-30 )

