原位微波消融治疗骨肉瘤术后 43 个月病理随访报告
张余 姚子龙 柯晋 张涛 马立敏 李梅 李丽华 欧阳兰飞 黄华扬 夏虹
原位微波消融治疗骨肉瘤术后 43 个月病理随访报告
张余 姚子龙 柯晋 张涛 马立敏 李梅 李丽华 欧阳兰飞 黄华扬 夏虹
目的评价微波消融术治疗骨肉瘤的中期疗效,探讨瘤段骨的病理学转归。方法对 1 例股骨远端骨肉瘤,患者进行了原位微波消融+内固定保肢治疗,术后随访 43 个月。末次随访时,拆除内固定,术中取股骨 ( 原瘤段骨 ) 中部、远端骨质及其周围软组织进行病理检查。结果该患者手术后 53 个月无瘤生存,肢体功能 MTST 评分 30 分。组织病理提示:瘤段骨中部见少量板层骨小梁、脂肪组织及再生的血管组织;瘤段骨远端骨质可见部分退变坏死及新生骨组织;股骨远端周围软组织镜下可见退变的横纹肌组织、胶原化的纤维结缔组织和神经组织。所有镜下均未见肿瘤细胞。结论该例接受微波消融治疗骨肉瘤患者的中期无瘤生存;术后 43 个月,原瘤段骨中仍有死骨存在,再血管化没有全部完成,仍有再骨折风险。
微波;消融技术;骨肉瘤;病理学,外科;随访研究
骨肉瘤是最常见的原发恶性骨肿瘤[1],伤残率高,20 世纪 70 年代之前,主要治疗方法是截肢术。随着化疗药物的出现和应用,骨肉瘤患者的 5 年生存率已经由之前 10%~20% 上升至现在的 60%~78%[2]。保肢手术患者的 5 年生存率高于80%[3]。有报道瘤段切除+假体重建的保肢手术,并取得了良好的临床效果[4-7]。范清宇等[8-10]报道原位微波消融治疗原发性恶性骨肿瘤中远期临床疗效满意。该方法在充分保护肿瘤周围主要正常组织的前提下,通过局部加热灭活肿瘤细胞,再刮除坏死组织,不仅在很大程度上保留患肢的功能,还具有良好的生物学效应[9,11-14]。有研究表明:肿瘤细胞在43 ℃ 以上出现细胞凋亡[15],微波加热后的骨组织仍然具有一定的力学强度[16-17],微波加热后 3~6 个月以“爬行替代”的方式再生,同时动物实验还证实在微波处理后 6 个月可观察到再血管化过程[18],而临床的 SPE-CT 检查结果认为术后 12 个月才出现明显的血管化[19],有良好的远期结果。然而,原位微波消融手术病例也在近期、远期出现过伤口愈合差,再骨折、复发等并发症的情况,部分学者对该方法的操作程序和规范,客观评价等存在疑问。同时,虽然有学者进行了微波消融后骨组织的组织学变化的动物实验,但我们还没有看到直接观察恶性肿瘤患者的瘤段骨中期的病理转归的报道。
2009 年 1 月,我们对 1 例股骨远端骨肉瘤患者进行了微波消融+内固定保肢手术,术后 43 个月予拆除内固定物时,术中取瘤段中部、远端部分骨质及周围软组织送病理检查。现报道如下。
临床资料
患者,女,13 岁,因“右大腿疼痛 1 个月余”与 2009 年 1 月入院。查体:右股骨远段稍肿胀,无破溃,轻度血管怒张,股骨下内侧轻微压痛,可触及约 2 cm×2 cm 大小质软肿物,活动较差。膝关节活动度:0°~100°,肌力 V 级,肌张力 I,下肢感觉存在,病理反射未引出。实验室检查:碱性磷酸酶:227 μ / L;右股骨 MRI 提示:右股骨下段可见不规则软组织肿块影,边缘欠清,信号均匀,肿块下达骨骺线,未及关节面,考虑恶性肿瘤 (图1 );对患者行“CT 引导下穿刺活检术”,病理检查示:符合骨肉瘤 (图2 )。
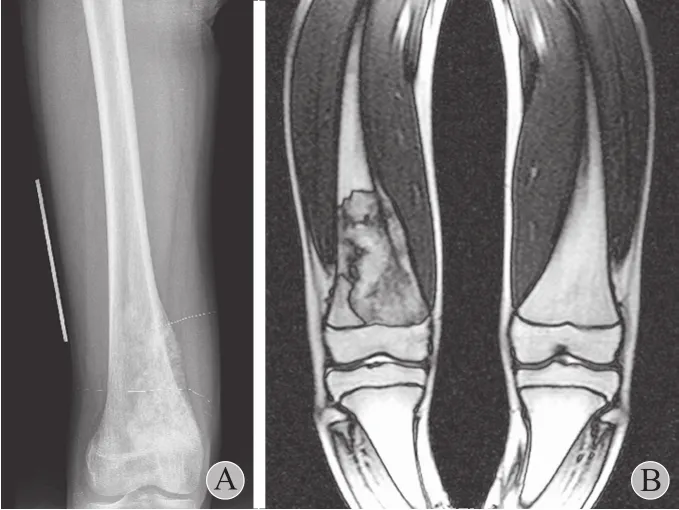
图1 A:手术前前后位 X 线片示右股骨远端骨小梁紊乱,虫蚀样骨质破坏,可见骨膜反应;B:MRI 示右股骨下段可见不规则软组织肿块影,边缘欠清,信号均匀,肿块下达骨骺线,未及关节面Fig.1 A: The preoperative anteroposterior X-ray film showed trabecular bone disorders, moth-eaten bony destruction and periosteal reaction in the right distal femur; B: The MRI image showed illdefined, even and irregular soft tissue shadows in the lower part of the right distal femur. The mass reached the epiphyseal line without entering the articular cavity
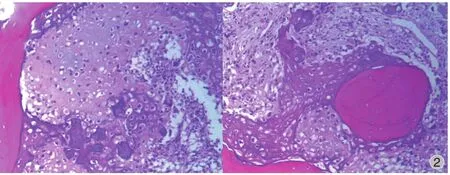
图2 术前穿刺活检,在正常骨小梁间见多量网格状肿瘤性成骨;可见多量梭形、肿瘤细胞,核大深染,胞质略嗜酸性,异型性明显 ( HE ×40 )Fig.2 The preoperative aspiration biopsy showed much latticed and neoplastic ossifcation existed in the normal trabecula. Spindle tumour cells with deep-dyed big nucleolus, eosinophilic cytoplasm and marked pleomorphism were observed ( HE ×40 )
行吡柔比星、顺铂、甲氨蝶呤及异环磷酰胺化疗 1 个疗程,于 2009 年 3 月 13 日行“右股骨下段骨肉瘤微波灭活内固定术[9]”(图3 ),大腿内侧切口,瘤外分离股血管、坐骨神经及可保留肌肉组织,暴露股骨下段肿物及瘤段外正常组织袖。在瘤段骨与周围正常软组织间垫入湿盐水纱布,并在瘤段骨周围正常保留组织上覆盖顺铂水纱布。自距肿瘤近段 5 cm 至股骨远段间断钻孔,间距 1.5 cm,植入 4 根微波天线,微波功率 70~100 瓦,连续输出,同时测温针测定瘤段表面温度超过 60 ℃,维持30 min,冰水持续冲洗周围正常组织以保证温度低于 43 ℃。灭活后刮除坏死组织,并送病检 (图4 ),预防性钉板固定,蒸馏水冲洗后,留置引流管,逐层缝合,包扎。
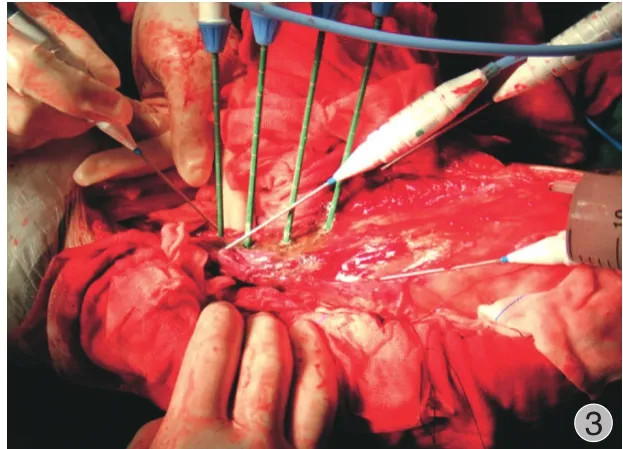
图3 植入式微波灭活肿瘤手术中Fig.3 The process of implantable microwave ablation of osteosarcoma
术后伤口愈合拆线,继续行吡柔比星及顺铂化疗共 5 个疗程。肢体以限制支具保护 2 年,扶拐行走 1 年半。期间每 3~4 个月复查胸片及股骨正侧位片及碱性磷酸酶指标,未见肿瘤复发、转移迹象。于 2012 年 10 月 11 日返院行内固定器拆除术。术前 X 线片示股骨固定牢固,无骨膜反应及软组织块(图5 ),手术中见内固定钉板无松动,骨质完整,较正常骨脆,周围组织呈现反应性增厚。取出内固定钉板,并分别在瘤段骨中部及远端环钻钻孔,将钻取的骨质 ( 股骨中段及远端 ) 连同周围软组织标记好后一同送病理检查 (图6 )。手术后患者支具保护下行走 3 个月。
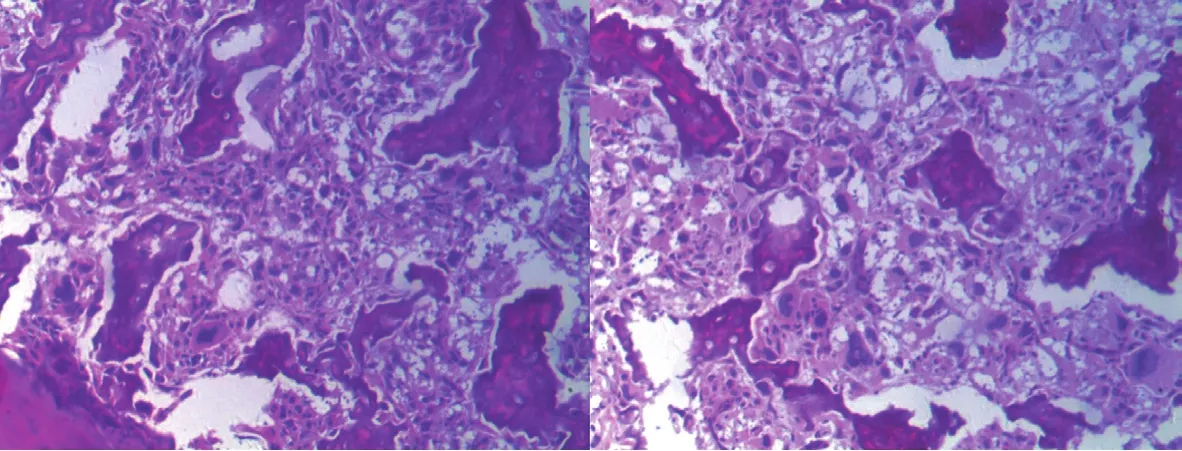
图4 术中切除组织病理检查。可见大量网格状肿瘤性成骨,肿瘤细胞主要表现为退变及点状坏死,部分瘤细胞核固缩、核碎裂及核溶解,间质黏液样变 ( HE ×40 )Fig.4 The pathological results of resected tissues during the operation were stated as following. Much latticed and neoplastic ossification was observed. The main manifestation of tumor cells were degeneration and spotty necrosis. Karyopyknosis, karyorrhexis and karyolysis of some tumor cells and mucoid degeneration in the mesenchyme could be observed ( HE ×400 )
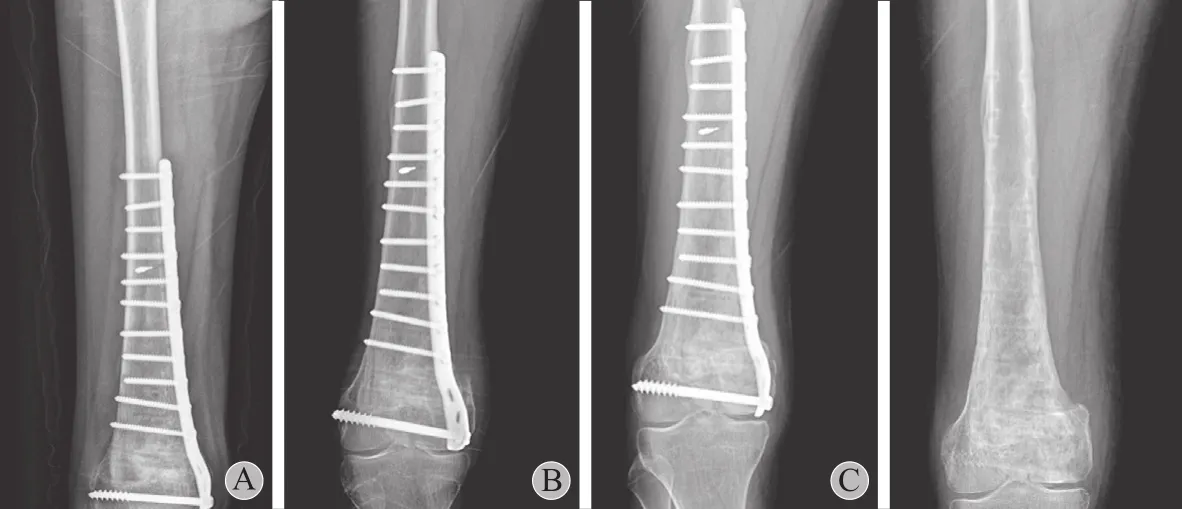
图5 微波灭活术后股骨远端 X 线检查 A:术后 3 天;B:术后 1 年;C:术后43 个月;D:拆除内固定后 3 个月Fig.5 The X-ray examination in the distal femur after microwave ablation A: At 3 days after the operation; B: At 1 year after the operation; C: At 43 months after the operation; D: At 3 months after the internal fxator was removed
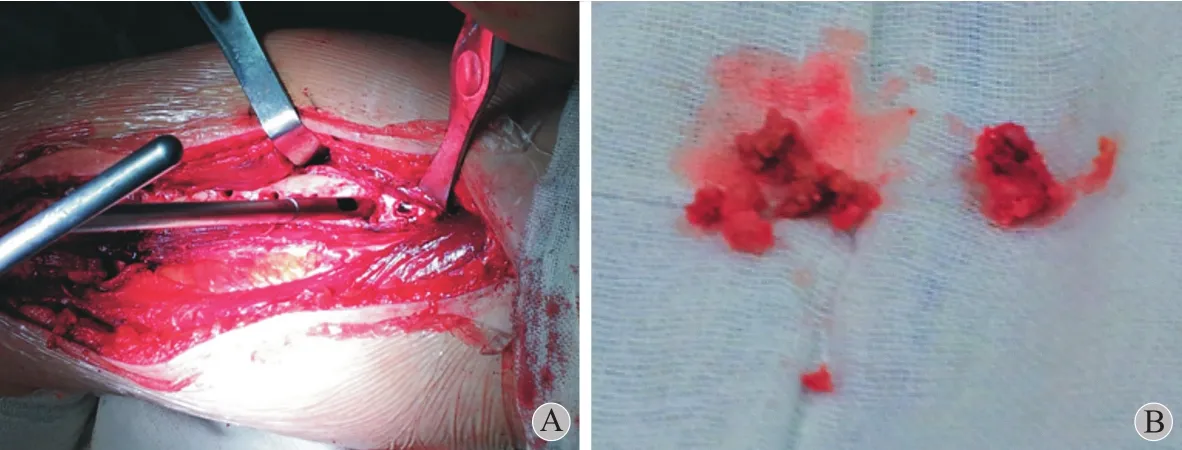
图6 A:术中取股骨中段组织;B:取出的 3 处组织Fig.6 A: Drilling for tissues from the mid-femur during the operation; B: The tissues from 3 different parts
手术后随访 53 个月,仍无瘤生存,肢体功能MTST 评分 30 分 (图7 ),属优。
病理报告 (图8 ):( 1 ) 股骨远端周围软组织:退变的横纹肌组织、胶原化的纤维结缔组织和神经组织,另见散在少许的坏骨组织和钙盐沉着。滑膜组织呈绒毛结节性滑膜炎改变并伴纤维素样坏死及多灶钙盐沉着。未见明确残存肿瘤细胞;( 2 ) 股骨中段骨质:适量板层骨小梁、脂肪组织增生的血管组织。未见明确残存肿瘤细胞;( 3 ) 右股骨远端骨质:镜下主要见退变坏死的骨组织及增生的纤维结缔组织,部分间质退变坏死,未见明确残存肿瘤细胞。
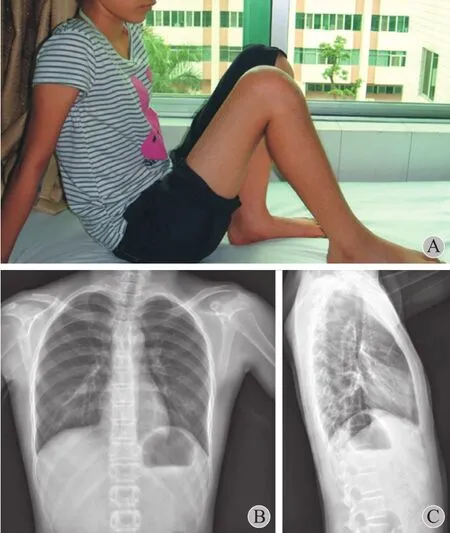
图7 A:术后右膝关节屈曲至 120°;B~C:胸部正侧位片显示肺部无转移征象Fig.7 A: The fexion angle of the right knee joint was 120° after the operation; B-C: The anteroposterior and lateral chest films indicated no pulmonary metastases were found
讨 论
自微波消融技术开展以来,许多学者对微波消融骨肿瘤的疗效及生物学转归进行了探索。本例手术与我们之前所报道的方法类似[20]。术后 43 个月,结合瘤段骨的生物学转归,评估其疗效。
1. 从临床的随访结果看,作为保肢手术方式的一种,原位微波消融灭活术充分保留了患者的自身的正常组织和具有支撑作用的灭活骨组织,在保证患者生存期的同时,最大限度地保留患者的肢体功能,避免了机械假体的疲劳及异体关节的免疫排斥等并发症。本例临床观察 53 个月 ( 2 次术后再随访 10 个月 ),胸片、股骨正侧位片及碱性磷酸酶指标提示未见肿瘤复发、转移迹象,无瘤生存。患膝关节功能恢复良好,MTST 评分达 30 分 (图7 )。当然,本例也进行了新辅助化疗,化疗有效率达到 1 级。但就保肢手术方式来讲,该方法的临床效果是确实的。
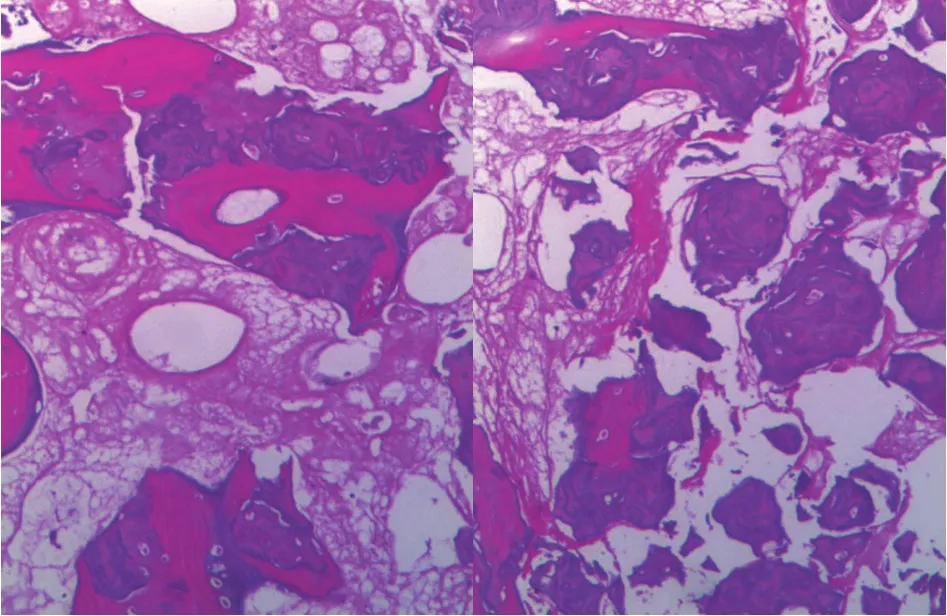
图8 第 2 次手术中的股骨远端病理:镜下可见部分退变坏死及新生骨组织,未见明确残存肿瘤细胞 ( HE ×40 )Fig.8 The pathological results of the distal femur in the second operation were stated as following. Both degeneration and necrosis of the bone and formation of new bone tissues could be observed microscopically. No residual tumor cells were found ( HE ×400 )
2. 从病理结果看,作者所采用的微波消融方法和条件对骨肉瘤的灭活效果是肯定的,安全的,合适的。本例 3 处取材部位病理切片均未发现肿瘤细胞,根据之前的研究结果[21],手术中共植入 4 根微波天线,并沿股骨长轴间隔 1.5 cm 排列,采用 70~100 W 功率,局部加热至 60 ℃,维持 30 min,该条件可全面杀死肿瘤细胞[9]。胡永成等[22]采用 50 ℃,15 min 的条件灭活恶性肿瘤,复发率为 10.1%,骨折发生率为 5.6%,范清宇报道复发率 12%,骨折发生率 8%,前者将骨巨细胞瘤统计在恶性肿瘤范围内。对于局部复发率高于国外的 5%的报道,范清宇[19]认为与保肢手术的适应证选择过宽有密切关系,并非是微波方法自身的问题。目前有学者开始在脊柱肿瘤、转移癌的治疗上采用经皮微波消融技术,取得一定成果。如何让肿瘤的消融区域、加热温度精确可控,是微波消融技术有待解决的问题。
3. 从组织转归看,微波治疗后瘤段骨的组织转归过程是缓慢的、复杂的。范清宇等[19]通过 SPECT检查发现灭活的肿瘤骨段在 1 年或更长的时间内出现再血管化,而我们之前的病理分析认为瘤段的骨再生及再血管化在术后 1 年的时间内无法完成。本例微波灭活后 43 个月,在股骨中段的组织中可观察到骨小梁和血管组织,而在股骨远端瘤段中的血管化和骨再生还没有完全完成,仍可见部分死骨存在,因此,我们在拆除内固定后,仍嘱患者患肢继续支具保护 3 个月。第 2 次手术后 10 个月,即第1 次手术后 53 个月,患者已去除支具正常行走,但患者的再骨折的风险仍然存在。客观评价瘤段骨再生,避免再骨折发生是值得研究的。
4. 对骺板损伤的问题:对未闭的儿童采用微波消融会造成骺板的损伤,导致骺板早闭、骨骺分离和发育障碍[22]。本例手术后 1 年左右出现过跛行,目前未见关节畸形及下肢明显短缩表现,我们猜测微波对骺板造成的损伤是可逆的或者本例的代偿能力强。这个假设的证实还有待于后续病例的探索。
5. 本研究存在下列不足:( 1 ) 本研究为个别病例的组织学观察,尚不能做出量化的统计学分析,结论不一定具有规律性和普遍性;( 2 ) 本例术中所取的病理组织较少,存在漏诊的可能性,但取样过多会增大骨折的风险;( 3 ) 微波高热可以介导免疫学效应[12,23-26],继而产生肿瘤杀伤作用。微波消融治疗后骨肉瘤患者的免疫学变化也是在我们往后的研究中需要解答的问题。
[1] Ottaviani G, Jaffe N. The epidemiology of osteosarcoma. Cancer Treat Res, 2009, 152:3-13.
[2] Messerschmitt PJ, Garcia RM, Abdul-Karim FW, et al. Osteosarcoma. J Am Acad Orthop Surg, 2009, 17(8):515-527.
[3] 范清宇, 马保安, 周勇, 等. 肢体恶性骨肿瘤的微波高温原位灭活保肢术. 中国矫形外科杂志, 2009(11): 801-806.
[4] Belthur MV, Grimer RJ, Suneja R, et al. Extensible endoprostheses for bone tumors of the proximal femur in children. J Pediatr Orthop, 2003, 23(2):230-235.
[5] Frink SJ, Rutledge J, Lewis VO, et al. Favorable long-term results of prosthetic arthroplasty of the knee for distal femur neoplasms. Clin Orthop Relat Res, 2005, 438:65-70.
[6] Funovics PT, Bucher F, Toma CD, et al. Treatment and outcome of parosteal osteosarcoma: biological versus endoprosthetic reconstruction. J Surg Oncol, 2011, 103(8):782-789.
[7] Jeys LM, Kulkarni A, Grimer RJ, et al. Endoprosthetic reconstruction for the treatment of musculoskeletal tumors of the appendicular skeleton and pelvis. J Bone Joint Surg Am, 2008, 90(6):1265-1271.
[8] Fan QY, Ma BA, Zhou Y, et al. Bone tumors of the extremities or pelvis treated by microwave-induced hyperthermia. Clin Orthop Relat Res, 2003, (406):165-175.
[9] Fan QY, Ma BA, Qlu XC, et al. Preliminary report on treatmentof bone tumors with microwave-induced hyperthermia. Bioelectromagnetics, 1996, 17(3):218-222.
[10] Fan Q, Ma B, Guo A, et al. Surgical treatment of bone tumors in conjunction with microwave-induced hyperthermia and adjuvant immunotherapy. A preliminary report. Chin Med J (Engl), 1996, 109(6):425-431.
[11] Carrafiello G, Lagana D, Pellegrino C, et al. Percutaneous imaging-guided ablation therapies in the treatment of symptomatic bone metastases: preliminary experience. Radiol Med, 2009, 114(4):608-625.
[12] Zerbini A, Pilli M, Fagnoni F, et al. Increased immunostimulatory activity conferred to antigen-presenting cells by exposure to antigen extract from hepatocellular carcinoma after radiofrequency thermal ablation. J Immunother, 2008, 31(3):271-282.
[13] Simon CJ, Dupuy DE, Mayo-Smith WW. Microwave ablation: principles and applications. Radiographics, 2005, 25(Suppl 1): S69-83.
[14] Lubner MG, Brace CL, Hinshaw JL, et al. Microwave tumor ablation: mechanism of action, clinical results, and devices. J Vasc Interv Radiol, 2010, 21(8 Suppl):S192-203.
[15] Dewey WC, Thrall DE, Gillette EL. Hyperthermia and radiation--a selective thermal effect on chronically hypoxic tumor cells in vivo. Int J Radiat Oncol Biol Phys, 1977, 2(1-2):99-103.
[16] 吴增晖, 刘景发, 钟世镇, 等. 微波辐射对犬股骨力学性能的影响. 中国临床解剖学杂志, 1999(04):367-368.
[17] 胡永成, 王继芳, 卢世璧, 等. 微波加热对骨组织生物力学的影响. 中华骨科杂志, 1997(10):45-48.
[18] 刘振东, 范清宇, 马宝安, 等. 成年狗股骨微波高温灭活后的再血管化研究. 中华骨科杂志, 1998(11):43-46.
[19] 范清宇, 马保安, 郭爱林, 等. 恶性或侵袭性骨肿瘤患者的微波高温治疗. 中华外科杂志, 1997(08):37-40.
[20] 张余, 柯晋, 陈炳旭, 等. 微波灭活治疗胫骨巨细胞瘤一年后瘤段病理分析(附一例报告并文献复习). 中国骨与关节杂志, 2012, 01(3):246-252.
[21] 柯晋, 尹庆水, 张余, 等. 离体骨的置入式微波消融. 中国组织工程研究与临床康复, 2011(11):1909-1912.
[22] 胡永成, 卢世璧, 王继芳, 等. 恶性骨肿瘤微波原位热疗保留肢体的手术技术. 中华骨科杂志, 2000(07): 25-30.
[23] Panjwani N, Akbari O, Garcia S, et al. The HSC73 molecular chaperone: involvement in MHC class II antigen presentation. J Immunol, 1999, 163(4):1936-1942.
[24] Zerbini A, Pilli M, Penna A, et al. Radiofrequency thermal ablation of hepatocellular carcinoma liver nodules can activate and enhance tumor-specifc T-cell responses. Cancer Res, 2006, 66(2):1139-1146.
[25] 管军, 姚晓平, 吴孟超, 等. 微波组织凝固对晚期肝癌患者抗肿瘤免疫力的影响. 中华物理医学杂志, 1998(03): 42-44.
[26] 庞志刚, 刘超, 郑蔚, 等. 射频消融对肝癌患者血浆sTNFR-1及ICAM-1的影响. 山东医药, 2006(24): 82.
( 本文编辑:李贵存 )
第六届中国国际腰椎外科学术会议通知
中国康复医学会脊柱脊髓专业委员会腰椎研究学组( CSSLS )、国际腰椎研究学会 ( ISSLS )、《中华外科杂志》、《中国脊柱脊髓杂志》主办,上海市医学会骨科专科分会、上海市医学会骨科分会脊柱学组协办,复旦大学附属华山医院骨科、复旦大学脊柱外科中心、华山 ( 国际 ) 应用解剖研究与培训中心 ( PARTI ) 承办的第六届中国国际腰椎外科学术会议,将于 2014 年 3 月 27 日至 29 日在上海扬子江万丽酒店召开。
本次大会将围绕当前腰椎外科领域中的疑难问题和国内外同道关心的焦点问题采用专题病例研讨、学术观点辩论、相关文献综述和资深专家点评的方式,为国内同行带来精彩的学术盛宴。
同时组委会还将在会议期间举行优秀壁报评选活动。欢迎同道们踊跃投稿。
本次会议属于国家级继续教育项目,注册参会者可获得全国继续教育 10 学分。
大会投稿邮箱:mail@lumbar2014.org
大会注册网址:www.lumbar2014.org
组委会联系人:杨彬 021-52887136;13795340877
中国康复医学会脊柱脊髓专业委员会腰椎研究学组
第六届中国国际腰椎外科学术会议组委会
Pathological analysis of the microwave ablation treatment of osteosarcoma in situ: a 43-month follow-up report after the operation
ZHANG Yu, YAO Zi-long, KE Jin, ZHANG Tao, MA Li-min, LI Mei, LI Li-hua, OUYANG Lan- fei, HUANG Hua-yang, XIA Hong. Hospital of Orthopedics, Guangzhou General Hospital of Guangzhou Military Command, Guangzhou, Guangdong, 510010, PRC
ObjectiveTo evaluate the mid-term clinical effects of the microwave ablation treatment of osteosarcoma and to investigate the pathological changes of the bone with tumors.MethodsOne patient with distal femoral osteosarcoma underwent microwave ablation in situ and limb salvage of internal fxation, who was followed up for 43 months after the operation. In the latest follow-up, the internal fxator was removed, and the pathological examination was carried out in the middle ( with primary tumors ) and distal femur and the surrounding the soft tissues.ResultsThe patient was disease-free for 53 months after the operation. The Musculoskeletal Tumor Society ( MSTS ) scoring system was used to evaluate the joint function, and the score for the patient was 30 points. The pathological examination results were stated as following. There were some lamella trabeculas, adipose tissues and regenerative vascular tissues in the middle tumor-bearing femur. In the distal tumor-bearing femur, both partial degeneration and necrosis of the bone and formation of fresh bone tissues could be observed. Meanwhile, degenerated striated muscles, collagenous fbrillar connective tissues and nervous tissues could be noticed in the surrounding soft tissues of the distal femur microscopically. No residual tumor cells were found microscopically.ConclusionsExcellent mid-term clinical effects are obtained in this patient undergoing the microwave ablation treatment of osteosarcoma, who is free of cancer now. Necrosis of the bone still exists and complete revascularization can not been observed in the treated segment at 43 months after the operation, which predicts the possibility of postoperative fractures.
Microwave; Ablation technique; Osteosarcoma; Pathology, surgery; Follow-up study
10.3969/j.issn.2095-252X.2014.02.015
R738.1, Q44
国家自然科学基金面上项目 ( 81271957 );全军医学科技项目“十二五”面上项目 ( CWS11C268 )
510010广州军区广州总医院骨科医院
32013-12-23 )

