大理地区鸽粪中新型隐球菌的分离与鉴定
陶星辰,刘晓英,尚秋菊,杨 静,苏鸿雁*
(1.大理学院基础医学院,云南大理 671000;2.大理学院农学与生物科学学院,云南大理 671003)
大理地区鸽粪中新型隐球菌的分离与鉴定
陶星辰1,刘晓英1,尚秋菊2,杨 静2,苏鸿雁2*
(1.大理学院基础医学院,云南大理 671000;2.大理学院农学与生物科学学院,云南大理 671003)
目的:对大理地区鸽粪中新型隐球菌的带菌率进行调查,为有效避免由鸽粪中隐球菌的感染提供参考依据。方法:采用黑米培养基对140份鸽粪中新型隐球菌进行了分离培养和鉴定。结果:共分离获得46株新型隐球菌,尿素试验均为阳性。结论:大理地区鸽粪中新型隐球菌阳性率较高,为32.9%。
新型隐球菌;黑米培养基;鸽粪
新型隐球菌于1894年被确认为一种人类条件致病性病原微生物〔1〕,且广泛分布于自然界,可以从土壤、蝙蝠洞、腐烂的蔬菜、水果、昆虫以及健康人体体表、口腔、肠道以及鸽粪等多种基质中分离得到,在所有基质中鸽粪中新型隐球菌的阳性率和生物量都是最高的〔2〕。新型隐球菌病的感染途径多是由呼吸道侵入人体,由肺经血行播散时可侵犯所有脏器组织,主要侵犯呼吸系统和中枢神经系统,也可侵犯骨、关节和皮肤〔3-4〕。近年来,新型隐球菌病的发病率在全球范围内呈现持续上升趋势,尤其在AIDS患者中,感染率高达30%〔5〕。为准确评估隐球菌病与鸽粪之间的关系,有效避免由鸽粪污染而引起隐球菌感染的潜在危险,及时有效地预防和控制隐球菌病的发生与传播,对鸽粪中新型隐球菌的带菌率情况进行了调查。
1 材料和方法
1.1样本来源云南省永平县、大理下关镇、南涧县、弥渡县养鸽户鸽棚中的鸽粪。
1.2培养基的制备
1.2.1 黑米培养基的制备 称取70 g黑米,加蒸馏水1 000 mL煮沸约30 min,用四层纱布过滤,再向滤液中加入20 g琼脂粉,补充蒸馏水至1 000 mL,混匀,自然pH,分装于500 mL锥形瓶内,121℃高压灭菌15 min,冷却至50℃后加入0.25 g阿莫西林。
1.2.2 YEPD培养基的制备 称取10 g酵母浸膏粉,20 g蛋白胨,20 g葡萄糖,加蒸馏水1 000 mL,pH值6.0,分装于100 mL锥形瓶内,121℃高压灭菌15 min。
1.2.3 尿素琼脂培养基的制备 称取10 g葡萄糖、20 g琼脂粉、1.0 g蛋白胨、5 g NaCl、2 g KH2PO4、0.012 g酚红,加蒸馏水定容至1 000 mL,121℃高压灭菌15 min,冷却至50℃后加入20%的尿素溶液50 mL,混合均匀后分装试管制斜面,凝固后置4℃冰箱备用。
1.3主要试剂5 mol∕L醋酸钾(乙酸钾98 g,加双蒸水140 mL,加热溶解,用冰乙酸调至pH 5.0,再加双蒸水定容至200 mL,高压灭菌20 min),3%SDS法抽提缓冲液(100 mM Tris-HCI pH 7.5,10 mM Na2EDTA pH 8.0,10 mM DTT 3%SDS),1×TE缓冲液(10 mM Tris-HCl pH 8.0,1 mM EDTA pH 8.0)和2×EsayTaq PCR SuperMix(购自北京全式金生物技术有限公司)。
1.4采集样本采集方法:用无菌竹签从鸽舍随机采取鸽粪标本,放入无菌封口袋带回实验室放入4℃冰箱保存,一周内进行新型隐球菌分离培养。采集时间:2014年3月12日至3月15日。采集量:永平县39份,大理下关镇31份,南涧县40份,弥渡县30份,总计采集140份鸽粪标本。
1.5标本处理方法每个样品称取0.6 g鸽粪置于含有10 mL无菌生理盐水的灭菌试管中,充分搅拌混匀,静置30 min,用移液枪取100 μL上清液,接种于黑米培养基,28℃培养3 d。
1.6标本分离培养及形态鉴定新型隐球菌接种在黑米培养基后可形成酵母型菌落,初期呈白色,3 d后转棕黄色,湿润黏稠,状似胶汁。用接种环挑取典型新型隐球菌菌落,通过墨汁染色,显微镜下观察呈圆形或卵圆形,菌体外有宽厚荚膜的菌株初步鉴定为新型隐球菌,并对其进行划线纯化。
肾上腺为腹膜后位器官,毗邻器官较多,左肾上腺根据其前方在不同的断面毗邻器官,分别为胃底、胰体、降结肠、脾及其动静脉等。毗邻肾上腺的结构发生病变形成类似囊实性肿物时,在影像学容易表现为左肾上腺来源的肿物。故CT读片时未引起注意而易误诊为肾上腺肿瘤或囊肿[4-5]。
1.7尿素酶试验进行形态初检后,将分离纯化的待检菌株接种于尿素琼脂培养基,置于28℃恒温培养箱中,每天观察培养基颜色变化,持续观察7 d。由于新型隐球菌可以产生尿素酶,所以如果培养基颜色变为桃红色或者粉色为阳性,否则为阴性。
1.8分子生物学鉴定
1.8.1 基因组DNA的提取 刮取一接种环纯化后的新型隐球菌接种到锥形瓶中的YEPD液体培养基中,置于28℃培养箱中,置摇床200 r∕min振荡培养16~18 h至对数生长期,用移液枪取l mL YEPD培养液的菌体置于2.0 mL Eppendorf管中,12 000 r∕min离心2 min收集菌体;用无菌水洗涤2次后12 000 r∕min离心2 min,弃上清;在沉淀中加入150 μL 3%SDS抽提缓冲液充分混匀;55℃水浴30 min,期间轻轻来回颠倒数次;加入1×TE缓冲液450 μL颠倒混匀;加入2∕5体积冰冷的5 mol∕L醋酸钾,冰浴10 min后 12 000 r∕min离心5 min,将上清液转至另一干净的Eppendorf管中(同法重复离心1次);加入等体积的异丙醇,轻轻来回颠倒数次混匀,-20℃放置10 min;12 000 r∕min离心10 min,弃上清;沉淀以70%的冷乙醇洗涤3次,风干后加入适量的双蒸水溶解DNA沉淀,放置备-20℃备用〔1〕。
1.8.2 PCR扩增反应总体积为25 μL,模板DNA 1 μL,CN5(GAA GGG CAT GCC TGT TTG AGA G)和CN4(ATC ACC TTC CCA CTA ACA CAT T)各1 μL,2×EsayTaq PCR SuperMix 12.5 μL,ddH2O 9.5 μL。PCR反应条件:94℃5 min,94℃30 s,56℃30 s,72℃30 s,72℃10 min,35个循环。
2 结果
2.1分离结果从140份鸽粪标本中,培养分离鉴定出46株新型隐球菌,总阳性率达32.9%(阳性率=新型隐球菌出现的样本数∕总的样本数×100%,即46∕140×100%=32.9%)。见表1。其中永平县的39份鸽粪标本中分离出14株新型隐球菌,阳性率35.9%,大理市下关镇的31份鸽粪标本中有9株阳性,阳性率29.0%,南涧县40份鸽粪标本中有15株阳性,阳性率37.5%,弥渡县30份鸽粪中有8株阳性,阳性率26.7%。
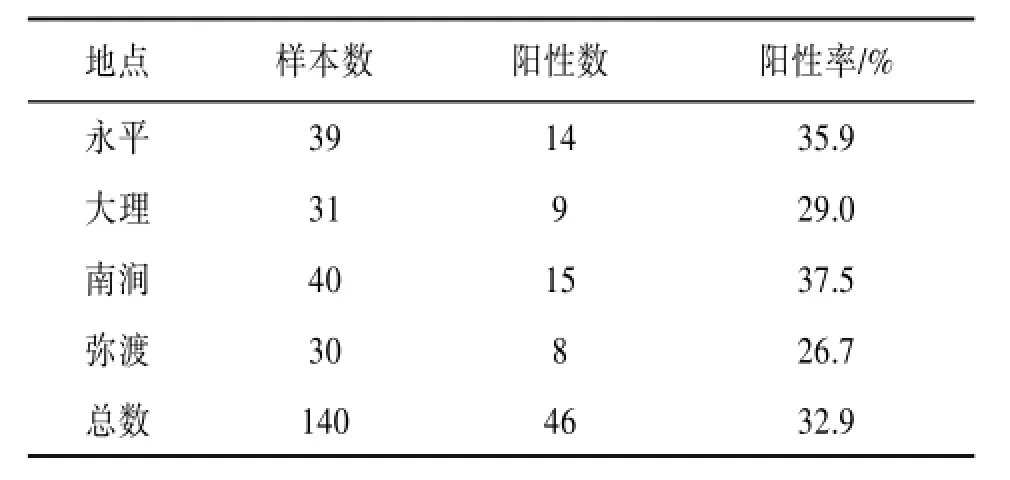
表1 大理地区鸽粪中新型隐球菌调查结果
2.2尿素酶试验结果所有待测菌株在尿素培养基上培养3 d后培养管上部出现了粉红色,直至7 d后培养基均呈桃红色。
2.3 PCR检测引物CN4和CN5被用来快速鉴定新型隐球菌,新型隐球菌PCR扩增目的条带长度约为136 bp〔6-7〕。待测菌株经PCR扩增得到目的条带产物。见图1。长度均约为136 bp,以此可以判断此次分离获得的目的菌株均是新型隐球菌,与培养基分离鉴定和显微形态镜检结果一致。

图1 琼脂糖凝胶电泳部分结果
3 讨论
本次采集了云南省大理州4个县市的的干燥鸽粪140份,阳性率达32.9%,与2010年Zarrin M〔8〕等在伊朗阿瓦士地区鸽群中新型隐球菌阳性率34%的调查结果相近;高于李莉〔5〕等在上海地区调查鸽粪中新型隐球菌22.2%的阳性率和吴媛〔9〕等在北京昌平区调查鸽粪中新型隐球菌4.87%的阳性率。
Swinne-Desgain〔2〕等研究发现新鲜鸽粪中高浓度的氨会抑制新型隐球菌的生长,干燥鸽粪为新型隐球菌提供了一个天然的优良生长环境,在此环境中,新型隐球菌可以分解高浓度的尿素、儿茶酚胺和其它含氮化合物,为其生长提供能量〔10〕。相比之下,暴露于空气中的干燥鸽粪中会比较容易分离到新型隐球菌,此次采集的鸽粪标本为干燥鸽粪,这可能是与其他调查者结果出现差异的原因之一。另外此次研究采用黑米培养基进行新型隐球菌的分离,由于黑米中除含有丰富的蛋白质、氨基酸、植物脂肪、纤维素、维生素、微量元素等,还含有丰富的生物活性物质如黄酮类、花青素、生物碱、胡萝卜素等物质〔11〕,这些物质是新型隐球菌新陈代谢及生长繁殖所必需的原料和能量。新型隐球菌在黑米培养基上形成的菌落较大,湿润,状似胶汁,呈棕黄色,极大的方便了对新型隐球菌的分离,因此,此次分离及检出率较高。
此次研究中4个采样地新型隐球菌的出现频率有一定的差异,这可能与采集方法、样本量、气候及地理距离等有关,确切原因还有待进一步通过实验进行分析。
〔1〕邹先彪.新生隐球菌分子生物学分类方法的研究〔D〕.上海:第二军医大学,2001.
〔2〕KOZEL T R,KWON-CHUNG K J,PERFECT J R,et al. Cryptococcus:from human pathogen to modelyeast〔M〕. Washington,DC:ASM press,2011:1-311.
〔3〕贾祎鹏.STE12α基因对新型隐球菌毒力的影响研究〔D〕.上海:第二军医大学,2009.
〔4〕孔庆涛.氧含量对新型隐球菌形态学及毒力因子影响的初步研究〔D〕.南京:南京大学,2012.
〔5〕李莉,王家春.鸽粪中新型隐球菌的分离和鉴定〔J〕.临床皮肤科杂志,2000,29(4):198-200.
〔6〕MITCHELL T G,FREEDMAN E Z,WHITE T J,et al. Unique oligonucleotide primers in PCR for identification of Cryptococcus neoformans〔J〕.Journal of clinical microbiol⁃ogy,1994,32(1):253-255.
〔7〕LUO G,MITCHELL T G.Rapid identification of pathogen⁃ic fungi directly from cultures by using multiplex PCR〔J〕. Journal of clinical microbiology,2002,40(8):2860-2865.
〔8〕ZARRIN M,JORFI M,AMIRRAJAB N,et al.Isolation of Cryptococcus neoformans from pigeon droppings in Ahwaz,Iran〔J〕.Turkish Journal of Medical Sciences,2010,40(2):313-316.
〔9〕吴媛,赵桂英,李文革,等.北京昌平区鸽粪中新型隐球菌的分离鉴定及其血清型、配型分析〔J〕.中国人兽共患病学报,2011,27(4):283-286.
〔10〕FISKIN A M,ZALLES M C,GARRISON R G.Electron cytochemical studies of Cryptococcus neoformans grown on uric acid and related sources of nitrogen〔J〕.Medical Mycology,1990,28(3):197-207.
〔11〕雷晓燕.黑米色素稳定性的研究〔J〕.沈阳化工大学学报,2013,27(3):215-219.
*通信作者:苏鸿雁,教授.
(责任编辑 毛本勇)
Isolation and Identification of Cryptococcus neoformans from Pigeon Droppings in Dali
TAO Xingchen1,LIU Xiaoying1,SHANG Qiuju2,YANG Jing2,SU Hongyan2*
(1.Pre-clinical College,Dali University,Dali,Yunnan 671000,China;2.College of Agriculture and Biology Science,Dali University, Dali,Yunnan 671003,China)
Objective:To investigate the positive rate of Cryptococcus neoformans in pigeon droppings in Dali and provide a basis for effectively avoiding its infection.Methods:A black rice culture medium was used for isolation and identification of Cryptococcus neoformans in 140 pigeon droppings.Results:46 strains of Cryptococcus neoformans were isolated and urea tests all proved positive.Conclusion:The positive rate of Cryptococcus neoformans in pigeon droppings in Dali was very high(32.9%).
Cryptococcus neoformans;black rice culture medium;pigeon droppings
R379.5
A
1672-2345(2014)08-0060-03
10.3969∕j.issn.1672-2345.2014.08.020
国家自然科学基金资助项目(31060019、31100093);云南省教育厅重大专项资助项目(ZD2010010);云南省中青年学术带头人后备人才资助项目(2012HB-042);云南省高校滇西生物多样性科技创新团队基金资助项目(云教函〔2011〕93号);大理学院质量工程项目(TDⅠ-05)
2014-04-11
2014-05-11
陶星辰,硕士研究生,主要从事微生物与疾病研究.

