里氏木霉与米根霉混合固态发酵产纤维素酶
吴 昊,宋向阳,吴文浩,欧阳嘉,勇 强
(南京林业大学林木遗传与生物技术省部共建教育部重点实验室,南京210037)
里氏木霉与米根霉混合固态发酵产纤维素酶
吴 昊,宋向阳,吴文浩,欧阳嘉,勇 强
(南京林业大学林木遗传与生物技术省部共建教育部重点实验室,南京210037)
以里氏木霉及米根霉单菌固态发酵为对象,考察不同混合发酵形式对里氏木霉与米根霉混合固态发酵产纤维素酶的影响。结果表明:同时接种里氏木霉与米根霉,试验考察的两菌种接种量比1∶ 1(以孢子个数计)及5∶ 1条件下,两菌未产生明显协同产酶作用。米根霉延时(24 h)接种且菌种量比5∶ 1以及米根霉延时(48 h)接种且菌种量比1∶ 1,2种发酵形式产酶情况类似,滤纸酶活(FPA)及羧甲基纤维素酶(CMCase)酶活相对米根霉单菌发酵有所提高,而β-葡萄糖苷酶(β-GA)酶活相对里氏木霉单菌固态发酵结束时分别增加4.66及4.40倍,可以发现两菌产生一定协同作用。在米根霉延时(48 h)接种且菌种量比5∶ 1的发酵形式下,FPA及CMCase在发酵第7天酶活分别达到44.04 IU/g、627.14 U/g(以1 g干曲计),分别是里氏木霉固态单菌发酵产酶达到稳定期时酶活的1.36和1.63倍,两菌产生了有效的协同作用。
里氏木霉;米根霉;混合固态发酵;纤维素酶
纤维素酶的制备技术是全球性的研究热点之一,提高纤维素酶产量和活性一直是核心问题所在。采用单菌产纤维素酶再用酶降解纤维素的工艺,由于存在酶系不完整和个别酶活不高的缺陷,在实践中被证明有很大的局限性。纤维素的降解需要3种酶系协同作用。因此,利用混合菌发酵技术提高纤维素酶酶活的研究日益成为一个重要的发展方向。产纤维素酶真菌混合发酵的微生态原理主要有3点[1-3]:①减弱酶的反馈抑制作用;②酶系互补;③互利共生。目前,国内外对混合发酵菌种研究较多的是木霉、青霉和曲霉[4-9]。根霉(Rhizopus)是一类广泛分布于自然界中的真菌,有多种活性强大的酶系[10]。张帅等[11]研究发现米根霉可作为纤维素酶生产的优良菌种,但国内外对米根霉用于混合菌发酵生产纤维素酶的研究较少。
里氏木霉RUT C-30被认为是目前公认纤维素酶最好的生产菌株之一,为进一步提高其产酶效率,笔者以农林废弃物玉米秸秆及麸皮为底物,首次将相对高产β-葡萄糖苷酶(β-GA)的菌种米根霉AS3.819与里氏木霉RUT C-30进行混合培养,参考已有对里氏木霉与黑曲霉混合发酵形式的研究[12],选取里氏木霉与米根霉接种量比(以孢子个数计)为1∶ 1及5∶ 1,研究米根霉延迟接种时间及不同混合发酵形式对混合菌固态发酵产纤维素酶的影响,以期为高效产纤维素提供理论依据。
1 材料与方法
1.1 材料
1.1.1 菌种
里氏木霉RUT C-30、米根霉AS3.819,由南京林业大学生物化工研究所保藏。
1.1.2 原料
玉米秸秆产自内蒙古呼和浩特、麸皮产自江苏东台,风干储存。原料粉碎后过0.63 mm筛。
1.1.3 培养基
菌种保藏斜面培养基:马铃薯葡萄糖琼脂培养基(PDA)。
固态发酵培养基:绝干玉米秸秆7.5 g,绝干麸皮7.5 g,(NH4)2SO45%(质量分数,下同),KH2PO40.3%,MgSO4·7H2O 0.05%,CaCl20.05%,Mandels微量元素溶液0.05 mL,吐温80 1滴,含水率70%,初始pH 5.0。
1.1.4 主要试剂
3,5-二硝基水杨酸试剂(DNS)、Na2HPO4缓冲液、柠檬酸-NaOH缓冲液、吐温80、对硝基苯酚β-D-葡萄糖苷溶液(pNPG)、1 mol/L Na2CO3溶液、羧甲基纤维素(CMC)悬浮液,国产市售分析纯。
1.2 培养方法
以无菌蒸馏水冲洗斜面培养基制成孢子悬浮液,控制里氏木霉与米根霉孢子悬浮液浓度,使总孢子接入量为1×108个,将孢子悬浮液按照不同接种量及不同接种时间接入500 mL锥形瓶,搅拌至其与固态培养基混合均匀,置于30 ℃恒温箱培养168 h,每隔24 h拌曲1次。
1.3 粗酶液提取方法
称取5 g固体曲,按照1∶ 10(g/mL)加入50 mL pH 4.8的柠檬酸-NaOH缓冲液,1滴吐温80,30 ℃静置浸提1 h后,4 ℃、4 000 r/min条件下离心20 min,收集上清液即为粗酶液。
1.4 分析方法
1.4.1 滤纸酶(FPA)和β-GA测定方法
采用国际理论和应用化学协会(IUPAC)推荐的标准方法[13]测定。
1个滤纸酶(FPA)活力的国际单位(IU)定义为在标准反应条件下每分钟生成1 μmol葡萄糖所需的酶量。1个β-葡萄糖苷酶活力国际单位(IU)定义为标准条件下每分钟生成1 μmol对硝基苯酚所需要的酶量。
1.4.2 CMC酶活测定方法
在25 mL试管中加入0.5 mL适当稀释的酶液和2 g/L羧甲基纤维素悬浮液1.0 mL。于恒温水浴器中振幅80 r/min、温度50 ℃下保温30 min后立即取出再加入3 mL DNS试剂,在100 ℃沸水中煮沸5 min,冷却到室温后,加水定容至25 mL,充分摇匀后于550 nm波长下测定吸光度值。反应生成的葡萄糖的量根据葡萄糖标准曲线求得。1个CMC酶活力单位(U)定义为每分钟生成1 μmol葡萄糖所需的酶量。
1.4.3 里氏木霉、米根霉孢子接种量的测定方法
采用血球计数板及OLMPUS CX40型显微镜(奥林巴斯公司)观测计数。
2 结果与讨论
2.1 单菌固态发酵产纤维素酶
2.1.1 里氏木霉单菌固态发酵产纤维素酶
图1(a)为里氏木霉单菌固态发酵产纤维素酶历程。由图1(a)可知:发酵前4天FPA及CMCase酶活快速增长,趋势明显,酶活分别在第4天达到32.49 IU/g及384.12 U/g(以1 g干曲计)。继续发酵,FPA酶活变化不大,开始呈稳定趋势,CMCase酶活增长缓慢,发酵第6天的比酶活比第4天的只增长1.1%。β-GA酶活始终呈增长趋势,但涨势相对平缓,在第6天酶活达到18.64 IU/g。从培养状态观察,发酵第2天,培养基开始出现结块现象,这是由于霉菌孢子落在适宜的基质上后发芽并产生菌丝[14],导致培养基凝结成块。培养基结块状态于第4天开始缓解,至第5天培养基完全松散,并开始出现大量里氏木霉孢子,说明里氏木霉菌丝体大量衰亡。在此情况下,FPA及CMCase酶活分别在第4天达到32.49 IU/g、384.12 U/g后酶活基本保持稳定。
2.1.2 米根霉单菌固态发酵产纤维素酶
图1(b)为米根霉单菌固态发酵产纤维素酶历程。由图1(b)可知:发酵前2天FPA及CMCase酶活增长明显,发酵第2天酶活分别达到4.76 IU/g、51.54 U/g,之后一直到发酵第6天结束,酶活均无太大增长,基本保持稳定。β-GA酶活始终呈增长趋势,在第6天酶活达到148.74 IU/g。从培养状态观察,培养基从发酵第2天开始产生大量白色菌丝,结块现象严重,培养至第4天白色菌丝体明显减少,培养基结块现象缓解,至第5天白色菌丝完全消失,培养基松散。与里氏木霉单菌发酵相比,米根霉单菌发酵产FPA及CMCase能力大大低于里氏木霉,但其产β-GA能力远高于里氏木霉。
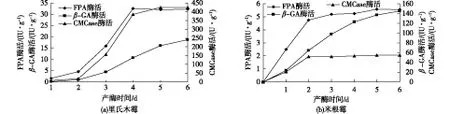
图1 里氏木霉及米根霉单菌固态发酵产纤维素酶历程Fig.2 Time courses of cellulase production by mono-culture of Trichoderma reesei (a) and Rhizopus oryzae (b)
2.2 不同混合发酵形式对混合菌固态发酵产纤维素酶的影响
2.2.1 不同孢子接种比情况下同时接种混合菌发酵产酶历程
主要考察在里氏木霉与米根霉孢子接种量比(以孢子个数计)分别为1∶ 1及5∶ 1时,同时接种混合菌的产酶情况,结果见图2。由图2(a)可知:FPA酶活在发酵第3天达到5.83 IU/g,继续发酵酶活变化不大;CMCase酶活在发酵第4天达到最大值(76.45 U/g),其后随着菌丝体的衰亡,酶活有所下降并在发酵后期保持基本稳定;β-GA酶活自第2天开始持续增长,在第7天酶活达到151.60 IU/g。由图2(b)可知:FPA酶活在第3天达到4.90 IU/g后,继续发酵酶活变化不大;CMCase酶活自第4天达到51.58 U/g后,继续发酵酶活基本保持不变;β-GA酶活同样自发酵第2天开始快速增长,发酵第7天酶活达到153.96 IU/g。比较这两种不同接种比发酵形式,可以发现,两者产酶情况类似,并都与米根霉单菌固态发酵产酶情况基本一致,说明在同时接种混合菌,在接种量比1∶ 1及5∶ 1的情况下,米根霉都在发酵中占据种群优势,导致里氏木霉无法正常生长并主导发酵产FPA,发酵过程中以产β-GA为主,并且相对米根霉单菌发酵并无优势。此实验结果说明这2种发酵形式下,里氏木霉与米根霉并没有形成有效的协同作用。
2.2.2 不同孢子接种比情况下米根霉延时接种24 h混合菌发酵产酶历程
主要考察在里氏木霉与米根霉孢子接种量比分别为1∶ 1及5∶ 1时,米根霉延时接种24 h的产酶情况,结果见图3。由图3(a)可知:当接种量比为1∶ 1时,FPA和CMCase比酶活分别在第3天达到4.89、47.89 U/g,继续发酵酶活基本保持稳定;β-GA酶活于第2天随着米根霉的接入开始持续增长,在第7天酶活达到142.28 IU/g。与米根霉单菌发酵相比,FPA及CMCase酶活均没有明显增长,而β-GA酶活有了明显下降,说明此发酵形式下,里氏木霉的存在对米根霉产β-GA造成一定负面影响,两菌仍未达到有效的协同作用效果。由图3(b)可知,当接种量比为5∶ 1时,FPA及CMCase酶活在前4 d快速增长,分别达到10.10 IU/g、122.73 U/g;β-GA酶活在发酵第3天开始快速增长,到第5天酶活达到99.38 IU/g后增长减缓,在第7天达到105.53 IU/g。在此发酵形式下FPA及CMCase酶活虽然远低于里氏木霉单菌发酵,但β-GA相对于里氏木霉单菌发酵酶活增长约4.66倍。同样,与米根霉单菌发酵相比,β-GA酶活虽然有所降低,但FPA及CMCase酶活均有较大提高。此实验结果说明在此发酵形式下以产β-GA为主,产FPA及CMCase为辅,里氏木霉与米根霉产生了一定协同作用。
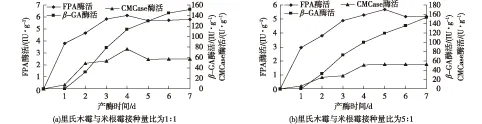
图2 同时接种,里氏木霉与米根霉的接种量比分别为1∶ 1和5∶ 1时混合固态发酵产纤维素酶历程Fig.2 Time courses of cellulase production by mixed-culture at the inoculum ratios of 1∶ 1 (a) and 5∶ 1 (b),inoculated at the same time
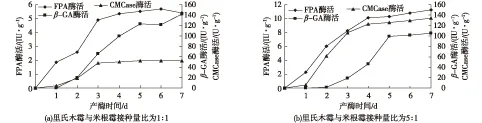
图3 米根霉延时接种24 h,里氏木霉与米根霉接种量比分别为1∶ 1与5∶ 1时混合固态发酵产纤维素酶历程Fig.3 Time courses of cellulase production by mixed-culture at the inoculum ratios of 1∶ 1 (a) and 5∶ 1 (b),delayed inoculation of Rhizopus oryzae for 24 h
2.2.3 不同孢子接种比情况下米根霉延时接种48 h混合菌发酵产酶历程
主要考察在里氏木霉与米根霉孢子接种量比分别为1∶ 1及5∶ 1时,米根霉延时接种48 h的产酶情况,结果见图4。由图4(a)可知:当接种量比为1∶ 1时,FPA和CMCase酶活分别在第4天达到8.34 IU/g和81.21 U/g,继续发酵酶活基本保持稳定;β-GA酶活随着米根霉的接入于第3天开始持续增长,在第6天酶活达到100.59 IU/g后有所下降。此结果与接种量比5∶ 1,米根霉延迟时接种24 h发酵形式下产酶结果类似,说明在此发酵形式下仍以产β-GA为主,产FPA及CMCase为辅,里氏木霉与米根霉产生了一定协同作用。由图4(b)可知:当接种量比为5∶ 1时, FPA、CMCase以及β-GA自发酵开始持续增长,产酶速度在第6天减缓,在第7天酶活分别达到44.04 IU/g、627.14 U/g 和17.14 IU/g。此结果与里氏木霉单菌发酵相比,产酶达到稳定期的时间由于米根霉的延迟接入而延长,但FPA与CMCase均有了显著提高,β-GA酶活基本与里氏木霉单菌发酵相同。此结果说明在这种发酵形式下,里氏木霉与米根霉形成有效的协同作用,互利共生,米根霉的存在促进了里氏木霉产纤维素酶。

图4 米根霉延时接种48 h,里氏木霉与米根霉接种量比分别为1∶ 1与5∶ 1时混合固态发酵产纤维素酶历程Fig.4 Time courses of cellulase production by mixed-culture at the inoculum ratios of 1∶ 1 (a) and 5∶ 1 (b),delayed inoculation of Rhizopus oryzae for 24 h
3 结 论
1)在同时接种里氏木霉与米根霉的发酵形式下,实验考察的2种菌种量比1∶ 1及5∶ 1均以米根霉主导发酵产β-GA为主,发酵情况与米根霉单菌固态发酵基本一致,里氏木霉与米根霉未产生明显协同产酶作用。
2)米根霉延时接种24 h且菌种接种量比5∶ 1以及米根霉延时接种48 h且菌种接种量比1∶ 1 2种发酵形式产酶情况类似,FPA及CMCase酶活相对米根霉单菌发酵有所提高,而β-GA酶活相对里氏木霉单菌固态发酵结束时分别增加4.66及4.40倍,里氏木霉与米根霉产生协同作用,但仍以米根霉产β-GA为主,里氏木霉产纤维素酶为辅。
3)在米根霉延时接种48 h且菌种接种量比5∶ 1的发酵形式下,FPA及CMCase在发酵第7天酶活分别达到44.04 IU/g、627.14 U/g,分别是里氏木霉固态单菌发酵产酶达到稳定期时酶活的1.36和1.63倍。说明在此发酵形式下,里氏木霉与米根霉产生了有效的协同作用,米根霉的存在促进了里氏木霉生产纤维素酶。
综合上述试验结果表明,里氏木霉与米根霉混合固态发酵产纤维素酶是可行的,通过对接种时间及接种比等发酵形式的调整可使混合菌产生有效的协同作用,促进纤维素酶的生产,从而更好地应用于大规模生产纤维素酶的工业发展中。
[1] 陈娜,顾金刚,徐凤花,等.产纤维素酶真菌混合发酵研究进展[J].中国土壤与肥料,2007(4):16-21.
[2] 涂璇,薛泉宏,司美茹,等.多元混菌发酵对纤维素酶活性的影响[J].工业微生物,2004,34(1):30-34.
[3] 熊海燕,王为国,王存文,等.混合菌培养及其在工业上的应用[J].贵州化工,2004,29(3):16-19.
[4] Gutierrez-Correa M,Portal L,Moreno P,et al.Mixed culture solid substrate fermentation ofTrichodermareeseiwithAspergillusnigeron sugar cane bagasse[J].Bioresour Technol,1999,68:173-178.
[5] Brijwani K,Oberoi H S,Vadlani P V.Production of a cellulolytic enzyme system in mixed-culture solid-state fermentation of soybean hulls supplemented with wheat bran[J].Process Biochem,2010,45:120-128.
[6] Dhillon G S,Oberoi H S,Kaur S,et al.Value-addition of agricultural wastes for augmented cellulase and xylanase production through solid-state tray fermentation employing mixed-culture of fungi[J].Ind Crops Products,2011,34:1160-1167.
[7] 王振宇,樊梓鸾.混菌固态发酵生产纤维素酶的研究进展[J].中国林副特产,2007(2):1-3.
[8] 苏香萍,龚大春,陈国华,等.混合菌固态发酵产纤维素酶条件的研究[J].时珍国医国药,2010(12): 3330-3332.
[9] 戴嘉.绿色木霉与黑曲霉固态混菌发酵生产纤维素酶、木聚糖酶和纤维二糖酶复合酶方法的研究[J].轻工科技,2012(5):5-7.
[10] 吴钰洁,牛剑锋,乐超银.根霉3.010产纤维素酶酶学特性研究[J].中国酿造,2009(12):43-45.
[11] 张帅,董基,吴紫俊.米根霉固态发酵橘皮产纤维素酶工艺的优化[J].食品工业,2012(3): 27-31.
[12] 方浩,宋向阳,赵晨,等.里氏木霉与黑曲霉混合发酵产纤维素酶的研究[J].林产化学与工业,2009,29(6):15-19.
[13] Ghose T K.Measurement of cellulose activities[J].Pure Appl Chem,1987,59(2):257-268.
[14] 周德庆.微生物学教程[M].2版.北京:高等教育出版社,2002:53-54.
(责任编辑 荀志金)
Production of cellulase in mixed-culture of Trichoderma reesei and Rhizopus oryzae by solid-state fermentation
WU Hao,SONG Xiangyang,WU Wenhao,OUYANG Jia,YONG Qiang
(Key Laboratory of Forest Genetics & Biotechnology,Ministry of Education,Nanjing Forestry University,Nanjing 210037,China)
We studied the effect of mixed-culture ofTrichodermareeseiandRhizopusoryzaeon cellulose production in solid-state fermentation. Parameters studied include delayed inoculation ofR.oryzaeand different inoculum ratios of the fungi (spore counting). Cellulase production by mono-culture ofT.reeseiorR.oryzaewas used as the control. No obvious synergy of the two fungi was observed when inoculating the mixed fungi at ratios of 1∶ 1 (spores) and 5∶ 1 at the same time. The result of delayed inoculation ofR.oryzaefor 24 h at inoculum ratio of 5∶ 1 was much similar with the result of delaying inoculation ofRhizopusoryzaefor 48 h at inoculum ratio of 1∶ 1. The activities of filter paper activity (FPA) and CMCase were higher than those of mono-culture fermentation ofR.oryzae. The activity ofβ-glucosidase (β-GA) raised about 4.66 and 4.40 times respectively compared with mono-culture fermentation ofT.reesei. Therefore, the synergy was generated between the mixed fungi with a delayed inoculation ofR.oryzae. When delayed inoculation ofR.oryzaefor 48 h at inoculum ratio of 5∶ 1, FPA and CMCase accounted for 44.04 IU/gram dry substrate, 627.14 U/g respectively, which were 1.36 and 1.63 times as those of mono-culture fementation ofT.reesei, respectively, also higher than that of the mono-culture ofR.oryzae.
Trichodermareesei;Rhizopusoryzae;mixed-culture solid-state fermentation;cellulase
10.3969/j.issn.1672-3678.2014.06.001
2013-09-18
国家自然科学基金(30871992);江苏省科技支撑计划(BE2010732);江苏高校优势学科建设工程资助项目
吴 昊(1987—),女,江苏南通人,硕士研究生,研究方向:生物燃料乙醇;宋向阳(联系人),教授,E-mail:xiangyangsong@hotmail.com
TS201.3
A
1672-3678(2014)06-0001-05

