体外模拟3 种消化液对铁皮石斛多糖的消化作用
张冠亚,黄晓君,聂少平,*,崔武卫,2
(1.南昌大学 食品科学与技术国家重点实验室,江西 南昌 330047;2.加拿大农业与农业食品部圭尔夫食品研究中心,安大略 渥太华 N1G 5C9)
体外模拟3 种消化液对铁皮石斛多糖的消化作用
张冠亚1,黄晓君1,聂少平1,*,崔武卫1,2
(1.南昌大学 食品科学与技术国家重点实验室,江西 南昌 330047;2.加拿大农业与农业食品部圭尔夫食品研究中心,安大略 渥太华 N1G 5C9)
本实验采用人体胃肠道模拟系统,体外模拟3 种消化液对铁皮石斛多糖的消化行为。通过高效凝胶液相色谱、铁氰化钾法和高效离子交换色谱分别测定消化后多糖分子质量变化、还原糖含量和单糖组成的情况。结果表明:唾液不能改变铁皮石斛多糖的分子质量;模拟胃液和模拟胃肠液可以降低多糖的分子质量,同时提高多糖溶液中的还原糖含量,但没有检测到单糖。结论:在体外模拟胃肠道的消化体系中,铁皮石斛多糖的分子质量减小,糖苷键发生断裂,但没有游离单糖的释放。
铁皮石斛多糖;体外消化;分子质量;还原糖;单糖
do i:10.7506/spkx1002-6630-201423054
植物多糖是构成生命活动的四大基本物质之一,与维持生命功能有密切关系,具有免 疫调节、抗肿瘤、抗衰老、降血糖、抗凝血等功效。Franz[1]曾报道指出,已发现有近百种植物的多糖没有细胞毒性且应用于生物体毒副作用小。铁皮石斛(Dendrobium off c inale Kimura et Migo)是一种名贵的中药材,主要生长在我国西南和江南各省,自古以来就有“药中黄金”之美誉,民间称其为“救命仙草”[2-3]。体内和体外实验研究表明,铁皮石斛多糖作为一种植物性多糖具有显著的体外抗氧化[4]、增强免疫[5-6]、抗肿瘤[7]、降血糖[8-9]的作用,其应用具有广阔的前景。
消化是一项复杂的体内代谢活动,由于消化系统的复杂性、实验模型难以建立、体内大分子难以控制等因素影响,消化实验难以在活体中进行。体外模拟消化既能在一定程度上真实模仿人体内环境,同时节省了大量资源,方便且易于控制[10]。人体消化系统由消化腺和消化管两部分组成。消化腺包括口腔唾液腺、肝、胰及消化管壁内的小腺体;消化管自上而下包括口 腔、咽、食道、胃、小肠(十二指肠、空肠、回 肠 )和大肠(盲肠、结肠和直肠)[11]。消化作为人代谢和营养物质吸收的关键步骤,是实现将食物大分子物质转化为能被机体吸收的小分子物质,进而被肠道吸收进入机体并通过特定相关代谢部位发挥功能的过程。多糖作为大分子糖类,一般认为是难以在胃肠道被人体消化吸收的[12],因此该特性被利用来制作药物的保护涂层[13]。多糖的主要代谢途径是在结肠处被肠道微生物酵解,产生大量的短链脂肪酸,如乙酸、丙酸和丁酸[14]。但是,一些对 多糖的体外模拟消化实验表明,多糖在人体消化液中是发生着结构和分子质量的变化的[15]。 铁皮石斛多糖作为一种具备多种生理活性的植物多糖,研究它在人体内的代谢特点是一项极具前景和应用性的工作。目前,还没有关于 铁皮石斛多糖在人体上消化道(即食管、胃、 小肠)消化情况的报道。因此本实 验以 人体胃肠道模拟系统为基础,并在实验设计上加以改进[16],希望探索出铁皮石斛多糖在体内的消化情况。
1 材料与方法
1.1 材料与试剂
铁皮石斛多糖,由云南金九地生物科技有限责任公司提供铁皮石斛干品制得[17]。
单糖标品:鼠李糖、阿拉伯糖、半乳糖、葡萄糖、木糖、甘露糖、果糖、核糖、葡萄糖醛酸、半乳糖醛酸 上海国药试剂公司;体外消化酶:胃脂肪酶(56.7 U/mg)、胃蛋白酶(800~2 500 U/mg)、胰酶、胰蛋白酶、胆盐 美国Sigma公司;氯化钠、氯化钾、氯化钙、碳酸氢钠、乙醇、盐酸等均为分析纯。
1.2 仪器与设备
ICS 5000 离子色谱仪(配有金电极和 ICS 5000 色谱工作站) 美国戴安公司;LC 1260高效凝胶液相色谱系统(配有示差检测器和 LC1260 色谱工作站) 美国安捷伦公司;MD 200-1氮气吹扫仪 杭州奥盛仪器有限公司;SHZ-III 型循环真空泵、DE-52AA 旋转蒸发器上海亚荣生化仪器厂;HH-4数显恒温水浴锅 国华电器有限公司;T6紫外分光光度计 北京普析通用仪器有限责任公司;FE 20 pH计 梅特勒-托利多仪器(上海)有限公司;RC806溶出仪 天津天大天发公司。
1.3 方法
1.3.1 体外消化液配制
唾液消化液和体外模拟胃液的配制参考文献[15]。肠电解质溶液:5.4 g NaCl、0.65 g KCl、0.33 g CaCl2溶于 1 L的去离子水。7 g/100 mL胰酶溶液:7 g 胰酶溶于100 mL水,3 000 r/min离心10 min,取上清液待用。4%胆盐溶液:4 g胆盐溶于196 mL水,3 500 r/min离心10 min,取上清液待用。体外模拟肠液[18]:100 mL胰酶溶液中加入100 mL 肠电解质溶液、200 mL胆盐溶液和13 mg胰蛋白酶,混合均匀,用 1 mol/L NaHCO3调节pH值至7。
1.3.2 胃电解质、沸水浴、失活消化酶对铁皮石斛多糖分子质量的影响
在2 mg/mL多糖溶液中分别加入等体积的水和胃电解质溶液,37 ℃恒温于溶出仪作用6 h后取样。将1 mg/mL铁皮石斛多糖溶液置于沸水浴中加热,在15 min时取样。将胃、肠消化液置于沸水浴中加热,分别在5、10、15 min时停止水浴,再与2 mg/mL多糖溶液等体积混合,37 ℃恒温下于溶出仪反应6 h后取样。
以上样液分别过0.22 μm水相膜,经高效凝胶液相色谱测多糖保留时间。色谱条件为:色谱柱为Waters UltrahydrogelTM50 0(7.8 mm×300 mm,10 μm),流动相为NaN3,流速为0.6 mL/min,检测器为RID,柱温箱和检测器的温度均为35 ℃,进样量为20 μL[19]。
1.3.3 体外模拟消化
1.3.3.1 唾液对铁皮石斛多糖的消化作用
2 mg/mL多糖溶液与等体积唾液充分混合后,在37 ℃恒温下反应2、4、6 h后终止反应,将多糖溶液换成去离子水作为空白组,重复上述操作。
1.3.3.2 模拟人体胃液对铁皮石斛多糖的消化作用
将150 mL质量浓度为2 mg/mL多糖溶液与150 mL模拟胃液混合置于溶出仪的溶出杯,密闭。37 ℃恒温、转速为150 r/min、摆动幅度为0.5 mm条件下分别反应2、4、6 h后,通过真空泵移出10 mL反应液,迅速置于沸水浴中5 min终止反应。
1.3.3.3 模拟人体胃肠液对铁皮石斛多糖的消化作用
在1.3.3.2节剩余反应液 (6 h)中加入模拟肠液,使反应液与肠液体积比为10∶3,保持溶出仪工作状态继续反应,在2、4、6 h时终止反应并收集消化液。
1.3.4 模拟消化产物的分子质量测定
取1.3.3.1、1.3.3.3节反应后的样液,4 800 r/min离心10 min,取离心上清液,过0.22 μm水相膜,通过高效凝胶液相色谱LC1260测定其分子质量的变化。色谱条件同1.3.2节。
1.3.5 模拟消化产物的还原糖含量测定
取1.3.3.1、1.3.3.3节的上清液,利用铁氰化钾法测溶液中还原糖含量[20]。测试之前,先用1 mol/L NaHCO3将溶液pH值调至7。取1.5 mL上清液,加入2 mL铁氰化钾试剂,待充分混匀后,沸水水浴加热15 min,然后冷却至室温,于420 nm波长处测定吸光度。
1.3.6 模拟消化产物的单糖含量测定
将1.3.5节的剩余上清液全部装入500~1 000 D透析袋后,将透析袋置于含有50 mL生理盐水的自封袋中,透析时间与模拟消化时间一致。取透析袋外的液体,过0.22 μm水相膜,通过离子色谱检测单糖组成。以生理盐水作为空白对照。
单糖混标溶液配制:称取5 mg单糖标品(L-鼠李糖、D-阿拉伯糖、D-木糖、D-核糖、D-甘露糖、D-葡萄糖、D-半乳糖、L-岩藻糖、D-葡萄糖醛酸和D-半乳糖醛酸)溶于1 L去离子水,即为5 μg/mL混标母液。再将母液稀释成0.5、1、2、4、5 μg/mL梯度,在离子色谱ICS 5000中进样。离子色谱条件:CarboPac PA20分析柱(3 mm×150 m m,6.5 μm)和CarboPac PA 20G保护柱(3 mm×30 mm,6.5 μm),流速为0.5 mL/min,进样量25 μL,检测器为金电极,柱温箱温度为30 ℃,检测器温度为35 ℃[21]。
1.4 数据分析
以上实验均平行3 次,得到的数据经过SPSS 13.0软件处理,用Turkey检验分析显著性。
2 结果与分析
2.1 电解质溶液对铁皮石斛多糖的作用
高效凝胶液相色谱是一种排阻色谱,根据溶质分子尺寸(分子质量、有效体积、流体力 学体积)的差别 进而进行分离和检测。是用来表征高聚物的重要方法[22]。通过多糖的保留时间来测量多糖的分子质量已经成为研究多糖一种基本方法[23]。在同一色谱条件下,保留时间越长,分子质量越小;反之,分子质量越大。
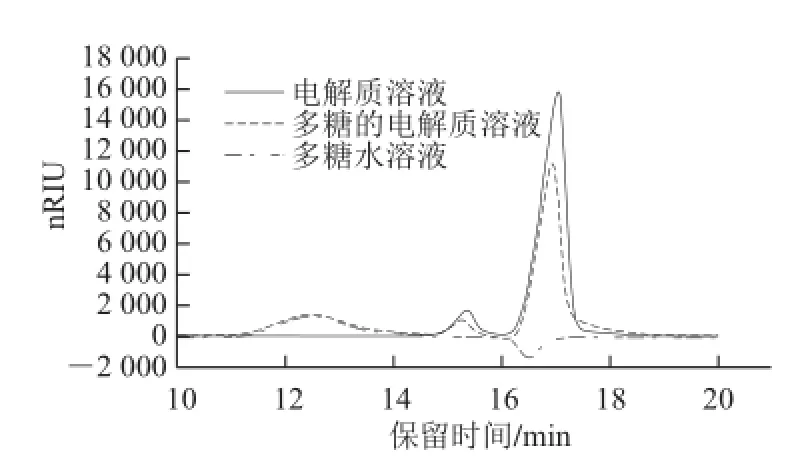
图1 胃电解质对多糖分子质量的影响Fig.1 Effect of gastric electrolyte on the molecular weight of the polysaccharide
本实验通过分 析多糖分子质量变化来直观研究多糖的消化情况,因此排除溶液中其他因素对多糖排阻图谱的表征极为重要。消化液所处的溶液是电解质缓冲液,含有自由移动的离子。它们与多糖在空间上分子的排布可能会相互影响,进而影响多糖的分子质量表征[21]。由胃电解质色谱图(图1)可知,电 解质在15 min之前无峰出现,15.5、17.5 min 有两个峰出现。而多糖的峰出现在12.5 min,且在17 min有一个溶剂倒峰。多糖的电解质溶液12.5 min的峰与多糖峰几乎重合,经计算,该峰的出峰时间与多糖水溶液出峰时间无显著差别,其后在15.5、17.5 min出现的峰比电解质的峰低,这是与多糖的溶剂倒峰叠加所形成。图1表明电解质作为一种缓冲溶液,不会对铁皮石斛多糖的图谱表征产生任何影响。
2.2 沸水浴对多 糖分子质量和消化酶活性的影响
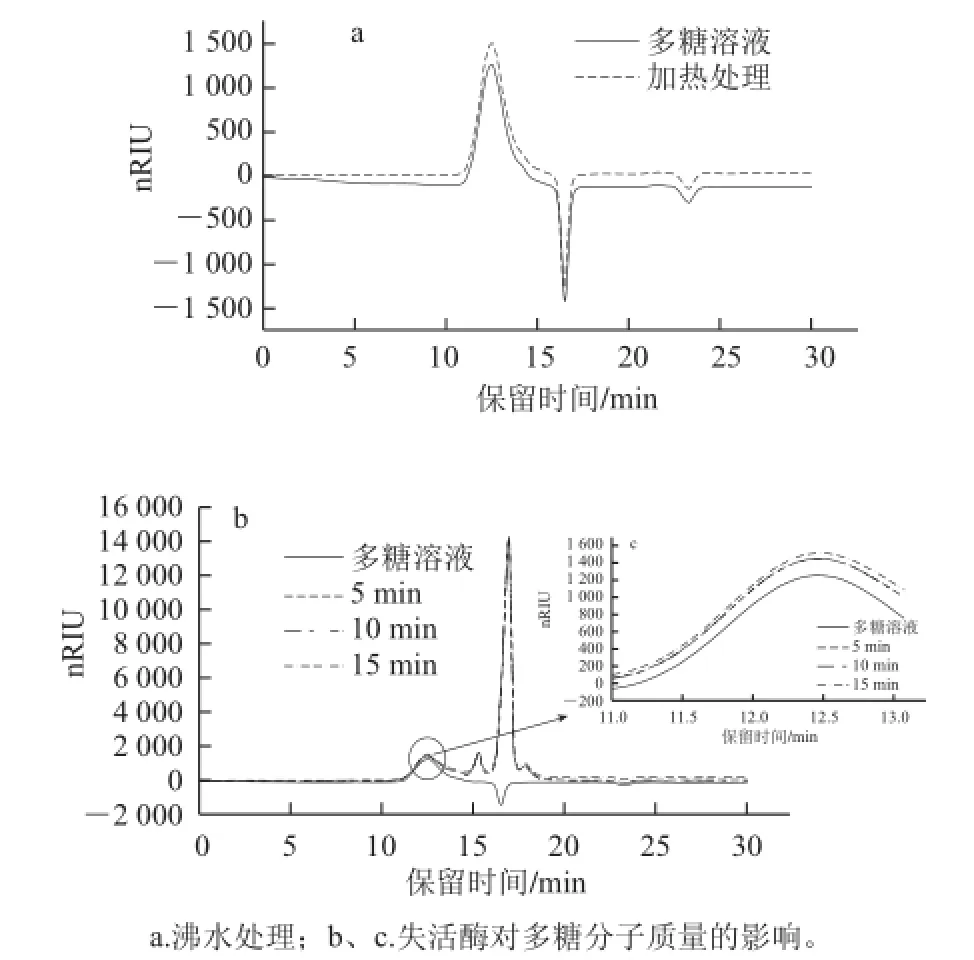
图2 高温和失活的酶对多糖分子质量的影响Fig.2 Effects of boiling water bath heating and inactivation of digestive enzymes on the molecular weight of the polysaccharide
在实验中为了控制消化时间,必须对反应2、4、6 h后的多糖溶液进行沸水浴终止。由图2a可知,多糖溶液加热前后出峰时间是一致的,经过计算,加热前后多糖的洗脱时间均无显著差异(P>0.05),说明沸水加热对多糖的分子质量没有影响。
将胃肠消化液分别沸水加热5、10、15 min后再与多糖混合,结果见图2b、2c。反应后的溶液依旧有信号很强的电解质的色谱峰,同时多糖位置的峰也几乎重合。将出峰时间做显著性分析得知,沸水浴后的消化酶不能改变多糖的分子质量,而该结果与2.3节实验结果对比可发现消化酶已经失去了活性。因此,可以将消化反应的终止条件设定为:沸水水浴5 min。
2.3 模拟消化后分子质量和还原糖含量变化
唾液是与食物接触的第一个消化液,而胃肠道消化是将胃和小肠看成一个消化体系,多糖在胃液中作用了6 h,再进入模拟肠环境继续发生反应。

表1 消化后分子质量和还原糖含量的变化Table1 Changes in molecular weight and reducing sugar content after digestion
经测定,本实验所用的铁皮石斛多糖分子质量为(314.51±6.09)kD。由表1可知,从唾液的消化结果来看,多糖的保留时间无显著变化,即分子质量无显著性差异,还原糖含量也没有显著变化,说明唾液不能消化铁皮石斛多糖,这与Hu Jielun等[15]在车前子多糖体外模拟口腔消化中的结果是一致的。多糖在模拟胃液中,保留时间随时间延长而增加,分子质量逐渐减小,在模拟胃液中反应6 h后分子质量为(244.79±2.99)kD,而还原糖含量也随时间延长而增加,从侧面说明了多糖分子支链产生了变化,糖苷键发生了断裂。多糖在肠道的消化中,分子质量进一步减小,反应2 h后,多糖分子质量减小到(229.91±1.59)kD,与4、6 h的分子质量无显著性差异,还原糖含量也表现出同样的趋势,说明消化反应已经到达了终点。
2.4 模拟消化后的单糖产生情况


图3 多糖消化后的离子色谱图Fig.3 Ion exchange chromatogram of the polysaccharide after digestion
由2.3节结果可知,多糖发生了糖苷键的断裂,可能生成了寡糖或者单糖[24],使得还原糖的含量增加,暴露出更多的还原末端。将反应后的消化液装入500~1 000 D的透析袋,那么只有小分子寡糖或者单糖可以自由进出透析袋。ICS 5000离子色谱系统具有高灵敏度、高效率、低消耗的特点,在单糖组分测定中有许多优势[25]。由图3可知,胃肠道消化液中均没有检测到单糖,表明消化后没有游离单糖的释放。多糖作为大分子物质,其空间结构复杂,主链和支链都是由糖苷键连接而成,糖苷键的断裂会使多糖的分子质量减小,多糖的性质也可能随之发生改变[26]。
3 结 论
本实验通过体外模拟人体消化系统,分别模拟了唾液、胃液和胃肠液对多糖的消化作用。在体外模拟实验中,多糖经过加热处理或者与电解质缓冲液作用均不能对多糖的分子质量产生影响,这为后续实验排除了干扰。实验用的消化酶具有较高的活性,为了控制反应,必须第一时间使酶失活终止反应。消化酶分别经过5、10、15 min的水浴,再与多糖溶液混合,结果显示水浴5 min便可以使酶失去活性。失去活性的酶与多糖混合,不能对多糖的图谱表征产生影响。在此基础上,进一步研究了解3 种消化液在体外模拟消化体系中对多糖的消化作用。唾液不能改变多糖的分子质量,在模拟胃和模拟肠道中,多糖的分子质量降低,同时还原糖含量增加。经过透析的消化液并没有检测到单糖的产生,说明消化过程中并没有产生单糖。综上所述,铁皮石斛多糖在模拟胃肠道消化体系中分子质量降低,糖苷键发生了断裂,但是没有释放出游离的单糖。
参考文献:
[1] FRANZ G. Polysaccharides in pharmacology. Current application and future concepts[J]. Planata Medicine, 1998, 55(6): 493-497.
[2] 付伟丽, 黄作喜, 唐正义, 等. 铁皮石斛多糖研究进展[J]. 内江师范学院学报, 2011, 26(4): 40-44.
[3] 盛家荣, 李志华, 易艳波, 等. 铁皮石斛多糖的研究进展[J]. 广西科学院学报, 2011, 27(4): 338-338.
[4] 鲍素华, 查学强, 郝杰, 等. 不同分子量铁皮石斛多糖体外抗氧化活性研究[J]. 食品科学, 2009, 30(21): 123-127.
[5] 蔡海兰, 黄晓君, 聂少平, 等. 铁皮石斛多糖对RAW264.7细胞分泌TNF-α的影响[J]. 中国药理学通报, 2012, 28(11): 1553-1556.
[6] XIA Linjing, LIU Xiaofei, GUO Huiyuan, et al. Partial characterization and immunomodulatory activity of polysaccharides from the stem of Dendrobium off cinale (Tiepishihu) in vitro[J]. Journal of Functional Foods, 2012, 4(1): 294-301.
[7] 张红玉, 戴关海, 马翠, 等. 铁皮石斛多糖对S180肉瘤小鼠免疫功能的影响[J]. 浙江中医杂志, 2009, 44(5): 380-381.
[8] 李秀芳. 霍山石斛和四种药典石斛多糖降血糖活性比较研究[D]. 合肥: 合肥工业大学, 2012: 17-18.
[9] XING Xiaohui, CUI S W, NIE Shaoping, et al. A review of isolation process, structural characteristics, and bioactivities of water-soluble polysaccharides from Dendrobium plants[J]. Bioactive Carbohydrates and Dietary Fibre, 2013, 1(2): 131-147.
[10] GUERRA A, ETIENCE-MESMIN L, LIVRELLI V, et al. Relevance and challenges in modeling human gastric and small intestinal digestion[J]. Trends in Biotechnology, 2012, 30(11): 591-600.
[11] 石戈, 王健鑫, 刘雪珠, 等. 褐菖鱼由消化道的组织学和组织化学[J].水产学报, 2007, 31(3): 293-302.
[12] XU Xiaofei, XU Pingping, TANG Jian, et al. Gut microbiota, host health, and polysaccharides[J]. Biotechnology Advances, 2013, 31(2): 318-337.
[13] MARONI A, DEL C MD, ZAMA L, et al. Film coatings for oral colon delivery[J]. International Journal of Pharmaceutics, 2013, 457(2): 372-394.
[14] ZHOU Mengyi, PU Chuanliang, XIA Lin, et al. Salecan diet increases short chain fatty acids and enriches beneficial microbiota in the mouse cecum[J]. Carbohydrate Polymers, 2014, 102: 772-779.
[15] HU Jielun, NIE Shaoping, MIN Fangfang, et al. Artificial simulated saliva, gastric and intestinal digestion of polysaccharide from the seeds of Plantago asiatica L[J]. Carbohydrate Polymers, 2013, 92(2): 1143-1150.
[16] CHEN Jianshe, GAIKWAD V, HOLMES M, et al. Development of a simple model device for in vitro gastric digestion investigation[J]. Food & Function, 2011, 2(3/4): 174-182.
[17] 黄晓君, 聂少平, 王玉婷, 等. 铁皮石斛多糖提取工艺优化及其成分分析[J]. 食品科学, 2013, 34(22): 21-26.
[18] BLANQUET S, ZEIJDNER E, BEYSSAC E, et al. A dynamic artificial gastrointestinal system for studying the behavior of orally administered drug dosage forms under various physiological conditions[J]. Pharmaceutical Research, 2004, 21(4): 585-591.
[19] 林慧霞, 聂少平, 殷军艺, 等. 大粒车前子多糖提取工艺优化及其理化性质测定[J]. 食品科学, 2010, 31(22): 226-231.
[20] 张永勤, 王哲平, 宋雨梅, 等. 还原糖测定方法的比较研究[J]. 食品工业科技, 2010, 31(6): 321-323.
[21] 闵芳芳, 聂少平, 万宇俊, 等. 青钱柳多糖在体外消化模型中的消化与吸收[J]. 食品科学, 2013, 34(21): 24-29.
[22] 钟亚兰, 蒋序林. 高效液相色谱表征高聚物[J]. 化学进展, 2010, 22(4): 706-712.
[23] 谢建华, 谢明勇, 聂少平, 等. 青钱柳中多糖含量的测定[J]. 分析试验室, 2007, 26(8): 33-36.
[24] 邹晓莉, 江水, 郑波, 等. 高效阴离子色谱法分离测定蜂蜜和保健食品多糖水解产物中的单糖组成[J]. 四川大学学报: 医学版, 2008, 39(5): 836-838.
[25] 李静, 李仁勇, 梁立娜. 毛细管型离子色谱-脉冲安培法检测枸杞多糖的单糖组成[J]. 分析化学, 2012, 40(9): 1415-1420.
[26] SINGH V, KUMAR P, SANGHI R. Use of microwave irradiation in the grafting modi cation of the polysaccharides-a review[J]. Polymer Science, 2012, 37(2): 340-364.
Effects of Three Digestive Juices on the in vitro Digestion of Dendrobium off cinale Polysaccharide
ZHANG Guan-ya1, HUANG Xiao-jun1, NIE Shao-ping1,*, CUI Wu-wei1,2
(1. State Key Laboratory of Food Science and Technology, Nanchang University, Nanchang 330047, China; 2. Guelph Food Research Centre, Agriculture and Agri-Food Canada, Ottawa N1G 5C9, Canada)
The effects of th ree digestive juices on the in vitro digestion of Dendrobium officinale polysaccharide were investigated by using human gastrointestinal model system in vitro. By using high performance liquid chromatography (HPLC), potassium ferricyanide and high performance iron exchange chromatography (HPIEC), we determined the changes in the molecular weight, reducing sugar content and monosaccharide composition of the polysaccharide after digestion. Results showed that the digestion in saliva did not change the molecular weight of Dendrobium off cinale polysaccharide. The digestion in simulated gastric juice and gastrointestinal juice reduced the molecular weight, and increased the reducing sugar content, but no monosaccharides were detected in the digested solution. Conclusion: After digestion in simulated gastrointestinal system, the molecular weight of Dendrobium off cinale polysaccharide was reduced and the glycosidic bond was broken, but without releasing free monosaccharide.
Dendrobium off cinale polysaccharide; in vitro digestion; molecular weight; reducing sugar; monosaccharides
TS201.2
A
1002-6630(2014)23-0279-05
2014-06-26
“十二五”国家科技支撑计划项目(2012BAD33B06);国家国际科技合作专项(2013DFA32710);教育部“新世纪优秀人才支持计划”项目(NCET-12-0749);江西省对外科技合作计划重点项目(20141BDH80009);江西省高等学校科技落地计划项目(KJLD13004)
张冠亚(1990—),男,硕士研究生,研究方向为食品科学与工程、食品质量与安全。E-mail:1195194129@qq.com
*通信作者:聂少平(1978—),男,教授,博士,研究方向为食品化学与分析、食品营养与安全、糖化学与糖生物学。E-mail:spnie@ncu.edu.cn

