养殖暹罗鳄肉肌原纤维蛋白的理化性质
肖 琨,王锡昌
(上海海洋大学食品学院,上海 201306)
养殖暹罗鳄肉肌原纤维蛋白的理化性质
肖 琨,王锡昌*
(上海海洋大学食品学院,上海 201306)
筛选养殖暹罗鳄肌原纤维蛋白含量最高部位,提取并分析离子强度、pH值和温度对肌原纤维蛋白溶液的溶解性、乳化性和热诱导凝胶特性的影响。结果表明:暹罗鳄尾部肌原纤维蛋白所占比例最高((7.95±0.12) g/100 g,以湿质量计),暹罗鳄尾肉中肌原纤维蛋白主要为肌球蛋白重链、副肌球蛋白、肌动蛋白和原肌球蛋白。在低离子强度条件下,肌原纤维蛋白的溶解度和乳化性较低,但有良好的凝胶特性,随着离子强度的升高,肌原纤维蛋白的溶解度和乳化性升高,凝胶特性则呈现下降趋势。随着pH值升高,肌原纤维蛋白溶解度呈现先迅速下降后升高的趋势,乳化性和凝胶特性则呈现持续缓慢下降的趋势,其中溶解度和保水性在pH 5.5达到最低点。随着热变温度升高,其凝胶特性显著增加,保水性先下降后略有升高,在低温(40 ℃)下有较好的保水性,在80 ℃保水性升高至又一峰值随后下降。结论:肌原纤维蛋白在NaCl浓度0.2 mol/L进行调配,并在80 ℃条件下加热处理,暹罗鳄肉类产品将具有较好的质构特性及保水性。
养殖暹罗鳄;肌原纤维蛋白;溶解性;乳化性;凝胶特性
暹罗鳄是鳄鱼皮革制品的主要原材料来源,尤以其繁殖能力强,饲养成本低、见效快、经济效益显著等优点受到广泛关注。我国自1993年开始引进并养殖暹罗鳄(Crocodylus siamensis),并于2005年被我国国家林业局列入首批可商业经营利用的野生动物名录[1],政策上的鼓励有力促进了暹罗鳄养殖业的发展。但在大量养殖暹罗鳄的同时也造成了一定程度上生物资源的浪费,鳄鱼经剥皮后的部分仍可食用。目前,已有学者[2-3]对暹罗鳄的营养品质、食用品质进行研究,并初步探索制作暹罗鳄肉产品[4],表明暹罗鳄可食部分仍是可利用率很高的生物资源,暹罗鳄肉产品开发市场前景广阔。在研究其营养与食用品质的基础上,对于肌肉蛋白质的功能性质了解成为产品开发的首要步骤。
肌肉蛋白质主要成分是肌原纤维蛋白,占蛋白质含量的50%~60%。肌原纤维蛋白对于肉制品的品质和特性具有非常重要的影响,其功能性质如溶解性、乳化性、凝胶特性、保水性和分散性等对肉制品加工质量影响很大[5]。肌原纤维蛋白凝胶,在溶液界面是肌原纤维蛋白的性质改变,直接影响蛋白的感官性质(肉制品的弹性、多汁性、口感等)[6]。食品蛋白质功能性质的影响因素有很多,内在因素如蛋白质组成、单体或多聚体等;加热条件如加热、酸化、干燥等;以及最为普遍的外在因素,如温度、pH值、盐及表面活性剂等[7]。
本实验对养殖暹罗鳄可食部位肌肉的一般营养成分及蛋白质组分进行研究,随后提取含量最高部位的肌原纤维蛋白,采用十二烷基磺酸钠-聚丙烯酰胺凝胶电泳(sodium dodecyl sulfate-polyacrylamide gel electrophoresis,SDS-PAGE)分析其组成。进一步探讨NaCl浓度、pH值对肌原纤维蛋白溶解性、乳化性和热诱导凝胶特性(硬度、黏性、咀嚼性、保水性)的影响,以及热变温度对热诱导凝胶特性的影响,为暹罗鳄肉类产品开发提供参考依据。
1 材料与方法
1.1 材料与试剂
1.5 岁龄养殖暹罗鳄,平均体质量(18.65±1.06)kg,采自江苏省昆山市正鑫鳄鱼开发有限公司,去皮、骨后保存于-20 ℃冰箱中待测。
牛血清白蛋白(生物试剂) 国药集团化学试剂有限公司;SDS-PAGE相关试剂(生物试剂) 生工生物工程(上海)股份有限公司;催化片(分析纯) 丹麦福斯公司;大豆油(食品级) 益海嘉里食品营销有限公司;其余化学试剂均为分析纯。
1.2 仪器与设备
8400凯氏定氮仪、2050索氏抽提系统 丹麦福斯公司;Avanti J-26XP冷冻离心机 美国贝克曼库尔特有限公司;TA. XT. Plus质构仪 英国Stable Micro System公司;UV2300分光光度计 上海天美科学仪器有限公司;T10 basic高速分散机 德国IKA公司;FE20K pH计美国梅特勒-托利多公司。
1.3 方法
1.3.1 一般营养成分测定[8]
水分含量测定采用GB/T 5009.3—2010《食品中水分的测定》,粗蛋白含量测定采用GB/T 5009.5—2010《食品中蛋白质的测定》,粗脂肪含量测定采用GB/T 5009.6—2003《食品中脂肪的测定》,灰分含量测定采用GB/T 5009.4—2010《食品中灰分的测定》。
1.3.2 蛋白质组分分析
参考Asghar[9]、张丹[10]等对蛋白质组分的分离方法。
1.3.3 肌原纤维蛋白的提取
肌原纤维蛋白的提取参考文献[11-12]的方法,略有改动。称取5 g解冻的均质肌肉于离心管中,加入4 倍体积的标准盐溶液(20 mmol/L磷酸盐缓冲液、0.1 mol/L KCl、2 mmol/L MgCl2、1 mmol/L NaN3、1 mmol/L乙二醇双四乙酸(ethylene glycol tetraacetic acid,EGTA),pH 7.0),高速分散器均质2 min(匀浆3 s,间隔30 s),随后在4 ℃下10 000 r/min离心10 min弃去上清液,收集沉淀,重复3~4 次后再向沉淀中加入4 倍体积0.1 mol/L NaCl,高速分散器均质30 s,用单层100 目纱布过滤,4 ℃下10 000 r/min离心,该纯化步骤重复2~3 次得到肌原纤维蛋白。
1.3.4 肌原纤维蛋白的SDS-PAGE
参考Laemmli[13]的方法对提取得到的肌原纤维蛋白进行SDS-PAGE分析。分离胶质量分数10%,浓缩胶质量分数5%,电泳缓冲液为0.05 mol/L Tris、0.384 mol/L甘氨酸、质量分数0.1% SDS(pH 8.3)的混合溶液。电泳胶的厚度为1 mm,进样量为15 μL,进样质量浓度为1 mg/mL,电泳开始时调节电压为80 V,当样品进入分离胶后将电压调节为120 V。
1.3.5 蛋白质浓度测定
采用双缩脲法,用牛血清白蛋白作为标准蛋白。
1.3.6 肌原纤维蛋白溶解性的测定
[14]的方法,略加改进。向一定量肌原纤维蛋白质加入不同pH值(4.5、5.0、5.5、6.0、6.5、7.0),不同NaCl浓度(0.1、0.2、0.4、0.6、0.8、1.0 mol/L)的盐溶液,配制成0.2 mg/100 mL的蛋白质溶液,均质机均质 1 min,10 000 r/min离心10 min。在改变某个因素条件时,其他因素条件保持不变。采用双缩脲法测定上清液中蛋白含量及样品中总蛋白含量。溶解度按公式(1)计算。

1.3.7 肌原纤维蛋白乳化性的测定
参考文献[15]方法,略加改进。蛋白质溶液配制方法同1.3.6节,取15 mL加入大豆油5 mL高速均质器匀浆1 min制成乳状液,从容器底部吸取50 μL的乳化液加入5 mL的体积分数0.1%的SDS溶液,在500 nm波长处测定吸光度A0,将乳状液静置10 min后测吸光度,记为A10,以SDS溶液为对照。按照公式(2)、(3)计算乳化活性指数(emulsifying activity index,EAI)和乳化稳定性(emulsion stability index,ESI)。
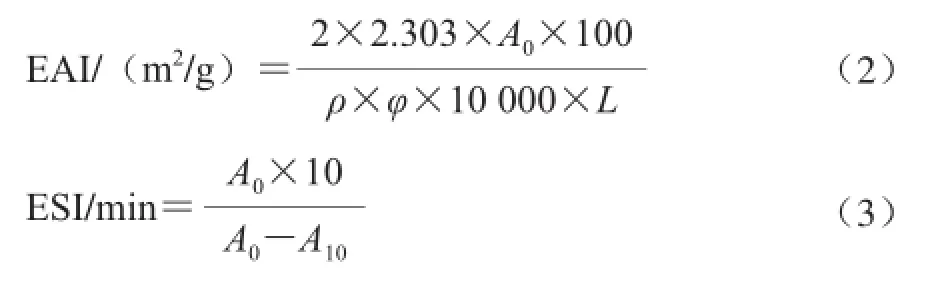
式中:2.303为换算系数;ρ为乳化液形成前水溶液中水解物的蛋白质质量浓度/(g/mL);φ为乳化液中油的体积分数,此处为25%;L为光路长度/cm。
1.3.8 肌原纤维蛋白热诱导凝胶制备
参考文献[5]将蛋白质量浓度调整到40 mg/mL,置于10 mL烧杯中,于水浴中以1 ℃/min从25 ℃升至40、50、60、70、80、90 ℃,并在到达终点温度时于该温度下恒温20 min,随后将烧杯取出,4 ℃下过夜(12 h)测定凝胶相关指标。
1.3.9 肌原纤维蛋白热诱导凝胶质构特性的测定
TA. XT. Plus型质构分析仪探头选取P 0.5,参数设置为穿刺前探头运行速率1.0 mm/s,穿刺时运行速率1.0 mm/s,返回速率1.00 mm/s,压缩距离4.0 mm,触发类型:auto,停留时间5 s,触发力1.0 g,数据搜取速率200 pps。
1.3.10 肌原纤维蛋白热诱导凝胶保水性的测定
参考Kocher等[16]的方法,将制备好的凝胶在4 ℃条件下,经10 000 r/min离心10 min,去除离心分离的液体,记录空离心管质量m、离心前离心管与凝胶总质量m1及离心去除水后离心管与凝胶总质量m2。平行3 次,按公式(4)计算保水性。
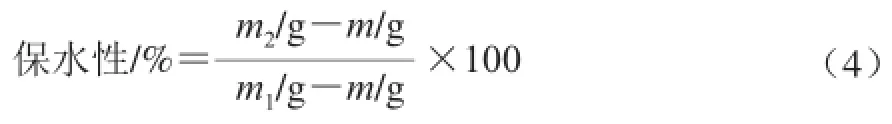
1.4 数据处理
实验数据采用SPSS 20.0及Microsoft Excel 2007进行数据处理与检验分析,以±s表示,P<0.05为差异显著。
2 结果与分析
2.1 养殖暹罗鳄不同部位一般营养成分

表1 养殖暹罗鳄各部位一般营养成分Table1 General nutritional composition of cultured Crocodylus siamensis muscle
由表1可知,养殖暹罗鳄3 个部位肌肉中的粗蛋白及粗脂肪含量均存在显著差异(P<0.05),其中尾肉的粗蛋白含量最高,达91.26%,其次是体肉(89.69%)和腿肉(88.42%)。三者粗蛋白含量均远高于同属鳄形目的扬子鳄肌肉和暹罗鳄肌肉,除腿肉中粗蛋白含量略低于青鱼(88.91%),养殖暹罗鳄主要部位肌肉中粗蛋白含量均高于其他鱼肉及家畜禽肉,并与同属于爬行纲的中华鳖腿肉中粗蛋白(89.66%)含量相近。鸡蛋蛋白质的生物价值极高,而养殖暹罗鳄尾肉粗蛋白含量是鸡蛋蛋白质含量(48.01%,以干质量计)[17]的1.9 倍。养殖暹罗鳄各部位肌肉的粗脂肪含量普遍较低,为3.43%~5.46%,蛋白质与粗脂肪比值为16.43~25.78,是高蛋白低脂肪的良好肉质。
2.2 养殖暹罗鳄不同部位蛋白质组分分析

表2 养殖暹罗鳄不同部位肌肉中蛋白质及非蛋白氮的含量Table2 Protein and non-protein nitrogen contents in different parts of cultured Crocodylus siamensis muscle
肌肉中蛋白质按其溶解性可分为水溶性蛋白质(如肌浆蛋白)、盐溶性蛋白质(如肌原纤维蛋白)和不溶性蛋白质(如基质蛋白)。由表2可知,各部位蛋白质组分基本呈现规律为:肌原纤维蛋白>肌浆蛋白>基质蛋白>非蛋白氮。尾肉中除总基质蛋白含量低于其余部位外,肌原纤维蛋白、肌浆蛋白以及非蛋白氮含量均为最高。
水溶性氮化物包括肌浆蛋白与非蛋白氮,含有大量游离氨基酸、核苷酸等水溶性滋味物质[20]。暹罗鳄3 个主要部位的肌浆蛋白占总蛋白的30%左右,尤其尾肉肌浆蛋白达到31.84%,由此推断鳄鱼肉的滋味丰富,口感独特。暹罗鳄不同部位肌肉中的肌原纤维蛋白含量均为最高,而肌原纤维蛋白是肉类形成弹性凝胶体的主要作用成分,与肉制品的保水性、黏弹性、质地等密切相关。尾肉中肌原纤维蛋白含量显著高于其余部位,因此确定为肌原纤维蛋白功能性质的研究对象。
2.3 养殖暹罗鳄尾肉肌原纤维蛋白SDS-PAGE电泳
由图1可知,养殖暹罗鳄尾部肌肉肌原纤维蛋白主要由分子质量为220 kD的肌球蛋白重链、分子质量为100 kD的副肌球蛋白、分子质量为43 kD的肌动蛋白、分子质量为36 kD的肌钙蛋白、分子质量为35 kD的原肌球蛋白以及一些低分子质量的蛋白,推测为分子质量为23.5 kD的肌球蛋白轻链1及16.8 kD的肌球蛋白轻链2[21]。这一结果与Marino等[22]研究的结果相一致。电泳图谱中杂带较少,说明提取纯度相对较高,本实验方法提取的肌原纤维蛋白可以用于后续实验研究。

图1 养殖暹罗鳄尾部肌肉肌原纤维蛋白SDS-PAGE图谱Fig.1 SDS-PAGE patterns of myofibrillar proteins in tail muscle from cultured Crocodylus siamensis
2.4 养殖暹罗鳄尾肉肌原纤维蛋白功能特性
2.4.1 NaCl浓度对养殖暹罗鳄尾部肌肉肌原纤维蛋白溶解性及乳化性的影响

表3 NaCl浓度对养殖暹罗鳄尾部肌肉肌原纤维蛋白功能性的影响Table3 Effect of NaCl concentration on functional properties of myofibrillar proteins in tail muscle from cultured Crocodylus siamensis
由表3可知,肌原纤维蛋白在低离子强度溶液中溶解度较小,随着盐浓度的增大,其溶解度显著提高,当NaCl浓度达到1.0 mol/L之后,蛋白溶解度的变化趋于平缓。EAI随NaCl浓度的升高而逐渐增大,当浓度达到0.6 mol/L后,EAI增加不显著。ESI在NaCl浓度为0.8 mol/L时达到最高值,其余浓度下无显著性差异。
盐离子与肌原纤维蛋白带相反电荷的基团作用形成双电层,减少了蛋白质分子间的静电作用,增强了蛋白质分子与水分子的作用,从而使得肌原纤维蛋白更好地分散在溶液中,溶解性增大[23]。随着盐浓度增加,蛋白质得以发挥表面活性作用,同时高速搅拌使蛋白质分子与脂肪分子充分结合,更易交联成聚集态[24],因此EAI呈增高趋势。在盐浓度较低时,肌原纤维蛋白溶解度过低,溶液中蛋白质分子相对较少不足以包裹脂肪颗粒,从而导致乳化液静置分层,ESI相对较低。增加盐浓度后,更多的蛋白质分子参与形成蛋白膜来包裹脂肪,阻止脂肪颗粒聚集分层,稳定乳化液,并在0.8 mol/L时达到最高值,随浓度升至1.0 mol/L,盐析作用又使得乳化液稳定性变差[25]。
2.4.2 pH值对养殖暹罗鳄尾部肌肉肌原纤维蛋白溶解性及乳化性的影响

表4 pH值对养殖暹罗鳄尾部肌肉肌原纤维蛋白功能性的影响Table4 Effect of pH on functional properties of myofibrillar proteins in tail muscle from cultured Crocodylus siamensis
由表4可知,在NaCl浓度为0.6 mol/L时,pH 4.5~5.5范围内,肌原纤维蛋白溶解度随pH值增加显著下降(P<0.05),pH 5.5~7.0,肌原纤维蛋白溶解度呈现迅速升高的趋势。肌原纤维蛋白的EAI在等电点pH 5.5之前,随pH值升高整体呈下降趋势,在等电点pH 5.5处降到最低值,随后又有所增加,与刘红彦[26]研究结论相一致。pH值对ESI的影响不显著(P>0.05)。
肌原纤维蛋白的溶解度在pH 5.5处达到最低值,说明该点接近肌原纤维蛋白等电点,与文献报道一致[6,23]。此时蛋白质分子以两性离子形式存在,所带的净电荷最少,蛋白质分子之间作用力减弱,其颗粒更易凝聚而产生沉淀,因此溶解度最小,此时吸附在油水界面蛋白质分子也最少,导致乳化活性指数最低。远离等电点后,蛋白质分子因电荷的静电斥力增加而分散开,表现为溶解度增大[26],蛋白质表面张力降低,疏水性基团暴露在外,在吸附脂肪粒的过程中,蛋白质骨架上的疏水残基移动并定向到油滴表面会发生构象重排[27],从而有利于体系乳化的进行,表现为乳化性升高。
2.4.3 凝胶性
热诱导凝胶性是食品蛋白质的一个最重要功能特性,一定浓度的蛋白质分子加热时会因变性而解折叠发生聚集然后形成凝胶[28]。
2.4.3.1 NaCl浓度对养殖暹罗鳄尾部肌肉肌原纤维蛋白凝胶特性的影响
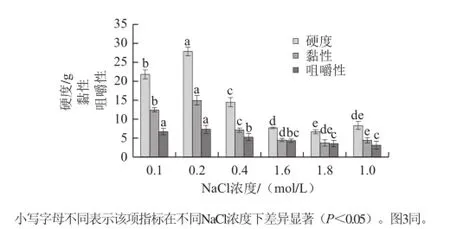
图2 NaCl浓度对养殖暹罗鳄尾部肌原纤维蛋白热诱导凝胶硬度、黏性和咀嚼性的影响Fig.2 Effect of NaCl concentration on the hardness, gumminess and chewiness of myofibrillar protein gel in tail muscle from cultured Crocodylus siamensis

图3 NaCl浓度对养殖暹罗鳄尾部肌原纤维蛋白热诱导凝胶保水性的影响Fig.3 Effect of NaCl concentration on the WHC of myofibrillar protein gel in tail muscle from cultured Crocodylus siamensis
由图2可知,NaCl浓度对养殖暹罗鳄尾部肌原纤维蛋白热诱导凝胶硬度、黏性、咀嚼度3 项指标的影响趋势相同,均随着NaCl浓度的升高呈现先上升后降低趋势,在0.2 mol/L处达到高值,并在0.8 mol/L后变化不再显著。由图3可知,在NaCl浓度为0.1~0.8 mol/L范围内,养殖暹罗鳄尾部肌原纤维蛋白热诱导凝胶保水性随NaCl浓度升高而降低,在处0.8 mol/L处保水性为最低(84.28%),随后显著升高,但比在0.1 mol/L时最高保水性降低了4.77%。
盐对肌原纤维蛋白凝胶的影响机理尚有争议。有研究[29]发现随着盐浓度增高,肌原纤维蛋白凝胶的硬度呈现先升高后下降的趋势,但周逸等[30]研究发现鱿鱼肌原纤维蛋白在低离子浓度下凝胶的硬度较高,随离子强度增强,凝胶特性有所下降。于巍等[31]发现低盐浓度下鱼肉的肌原纤维呈紧密的网络结构,而高盐浓度下形成较为粗糙的凝胶,较强的刚性使得低盐浓度下的肌原纤维蛋白热诱导凝胶的硬度和咀嚼性更高。研究表明[32]低盐浓度下肌球蛋白分子细丝状的形式使得体系具有较强黏性,增强离子强度使肌球蛋白分子以单体的形式存在,导致黏度下降。至于盐对凝胶保水性的影响可如下解释:NaCl能增加盐溶蛋白之间的静电斥力,使蛋白质结构松弛,从而提高盐溶蛋白凝胶的保水性,但随添加量增加凝胶脱水而保水性降低[33]。
2.4.3.2 pH值对养殖暹罗鳄尾部肌肉肌原纤维蛋白凝胶特性的影响

图4 pH值对养殖暹罗鳄尾部肌原纤维蛋白热诱导凝胶硬度、黏性和咀嚼性的影响Fig.4 Effect of pH on the hardness, gumminess and chewiness of myofibrillar protein gel in tail muscle from cultured Crocodylus siamensis
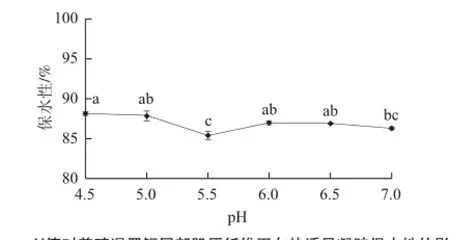
图5 pH值对养殖暹罗鳄尾部肌原纤维蛋白热诱导凝胶保水性的影响Fig.5 Effect of pH on the WHC of myofibrillar protein gel in tail muscle from cultured Crocodylus siamensis
由图4可知,随着pH值的增高,肌原纤维蛋白热诱导凝胶的硬度、黏性和咀嚼性呈现逐渐下降的趋势。硬度在溶液pH 6.0~6.5时差异不显著,在pH 7.0处达到最低值。黏性和咀嚼性在溶液接近中性(pH 6.0~7.0)时没有显著性差异。由图5可知,随pH值升高凝胶的保水性呈现先下降后升高的趋势,在等电点pH 5.5处保水性最低(85.40%),与pH 4.5处最高值相比降低了2.75%。pH 6.0~7.0的偏中性环境,凝胶的保水性无显著性差异,因此在暹罗鳄产品加工过程中无需调节pH值,中性条件即可达到相对较高的保水性。
pH值对凝胶特性的影响表现在对蛋白所带电荷的影响,进而改变蛋白质构型和电荷分布。研究发现[34],溶液pH值在等电点附近(pH 5.5左右),肌球蛋白带电荷最少,形成粗丝状的不均匀网络,使凝胶相对较强的硬度和咀嚼性,这样的结构也不利于凝胶的保水性。而在pH值远离等电点的条件下,蛋白质的净负电荷增加,凝胶内部由于多聚体间的引力使蛋白聚集,形成致密紧凑的网络结构,从而提高凝胶硬度与咀嚼性,并利于束缚水分子,提高凝胶保水性[35],但致密的网络结构相较粗丝状结构会使得凝胶一定程度上丧失黏性。本实验还发现凝胶的硬度在pH值接近中性时并未如他人研究[30]一样呈升高趋势,推测是物种差异导致这一差异,今后可进一步研究暹罗鳄肌肉中影响凝胶在中性条件下质构特性的内部因素。
2.4.3.3 温度对养殖暹罗鳄尾部肌肉肌原纤维蛋白凝胶特性的影响
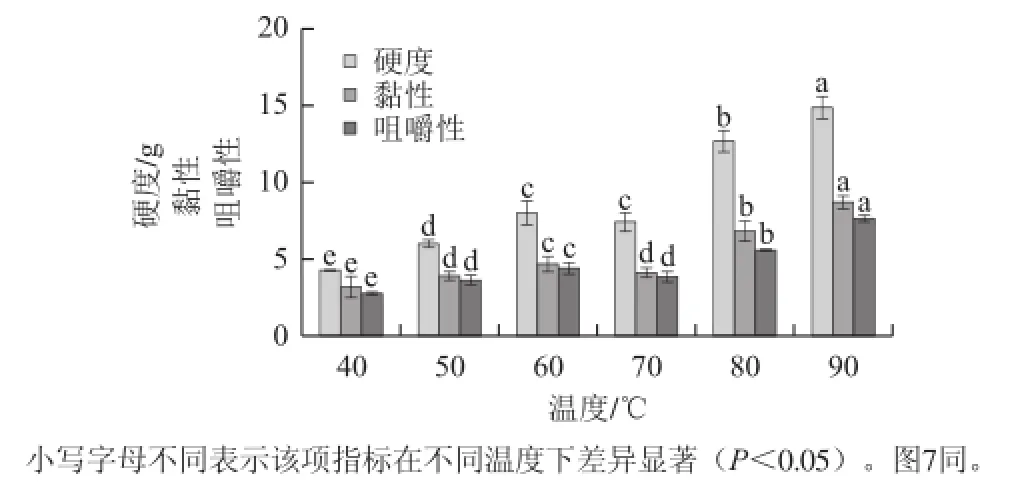
图6 温度对养殖暹罗鳄尾部肌原纤维蛋白热诱导凝胶硬度、黏性和咀嚼性的影响Fig.6 Effect of heating temperature on the hardness, gumminess and chewiness of myofibrillar protein gel in tail muscle from cultured Crocodylus siamensis

图7 温度对养殖暹罗鳄尾部肌原纤维蛋白热诱导凝胶保水性的影响Fig.7 Effect of heating temperature on the WHC of myofibrillar protein gel in tail muscle from cultured Crocodylus siamensis
研究表明[36]线性升温制备的热诱导凝胶质构要优于非线性升温及恒温加热,并且升温速率保持在0.2~1 ℃/min范围内时,形成的凝胶硬度无显著性差异并优于快速升温。因此本实验选择1 ℃/min的升温速率。由图6可知,在40~90 ℃范围内,肌原纤维蛋白凝胶硬度、黏性和咀嚼性均随着温度的升高而上升,在40 ℃时为最低值,90 ℃时达到最高值。凝胶硬度在60~70 ℃时变化不显著,其余各温度的硬度均有显著性差异,而凝胶的咀嚼性和黏性均在50 ℃和70 ℃时不存在显著性差异。由图7可知,凝胶保水性在40 ℃时出现最高值(94.52%),随热变温度升高而显著下降(P<0.05),于60 ℃时到达最低值82.39%,随后又显著上升,在80 ℃升高至87.32%,随后在90 ℃时又略有下降。
加热可直接影响肌原纤维蛋白形成热诱导凝胶,蛋白质在室温(25 ℃)下基本不发生变化,随着热变温度升高,蛋白质分子从天然状态经由各级结构变化到变性状态,变性的程度决定了蛋白质最终的质构特性。温度升到一定程度,肌球蛋白形成复杂的网络结构,肌原纤维蛋白变性逐步完成,形成凝胶,如果温度继续升高会使蛋白质重链降解,已形成的蛋白网络结构会遭到破坏[37],这一温度集中在70~80 ℃[38-39]。本研究中暹罗鳄尾部肌原纤维蛋白凝胶在80~90 ℃下的硬度等质构特性仍在升高,说明暹罗鳄肌原纤维蛋白热诱导凝胶仍未完全形成。由于肌原纤维蛋白溶于高离子强度溶液中,而其在40 ℃的低温下尚未形成凝胶,因此有较好的保水性;随着温度升高,形成的凝胶呈现较为粗糙、多孔的网络结构,保水性随之下降;温度进一步升高,凝胶会通过一些作用力更有规律的排列,逐步形成规则的三维网络结构,更易束缚水,因此温度高于60 ℃后,凝胶的保水性又呈现上升趋势。但当温度升至80 ℃蛋白质的三维网络结构破坏将导致保水性无变化甚至下降。
3 结 论
养殖暹罗鳄尾部肌肉的粗蛋白含量显著高于其余部位,并高于其他鱼肉及家畜禽肉,同时粗脂肪含量较少,是高蛋白低脂肪的优良肉类,其蛋白组成中的肌原纤维蛋白含量也显著高于其余部位,综合分析是养殖暹罗鳄提取肌原纤维蛋白的最佳原料。
功能性研究中发现,离子强度、pH值和热变温度对养殖暹罗鳄肌原纤维蛋白的功能特性有极显著影响。随着NaCl浓度增大,其溶解性增强;蛋白质等点pH值为5.5,该点溶解性最弱。肌原纤维蛋白的乳化性与溶解性密切相关,乳化性随离子强度增加而增强,在等电点处出现最低值。
低盐浓度时肌原纤维蛋白具有良好的质构特性和保水性,随NaCl浓度升高其质构特性变差,却有较好的保水性。pH值在等电点处凝胶质构特性一般,保水性较差。热变终点温度对养殖暹罗鳄肌原纤维蛋白凝胶特性产生尤为显著的影响,质构特性随温度升高呈现逐步上升趋势,保水性在60 ℃出现最低值后又显著上升,直到高温导致凝胶结构破坏。
盐可增加肌原纤维蛋白的溶解性及凝胶特性,但考虑口感需控制添加量,同时pH值的调节并不适用于食品的生产加工,还会增加成本。因此综合本实验研究结果,在暹罗鳄肉类产品开发研制过程中,选取NaCl浓度0.2 mol/L进行调配,并在80 ℃下进行烹饪,可得到较好的质构特性及保水性。为落实养殖暹罗鳄尾肉产品良好特性时盐的加量、pH值及温度的确定值,有关复配添加剂及加热条件对其产品特性的影响,还有待更深入的研究。
参考文献:
[1] 唐樑, 秦明珠. 鳄鱼的药用研究和开发前景[J]. 中外健康文摘: 医药月刊, 2007, 4(10): 66-68.
[2] 肖琨, 王锡昌. 养殖鳄鱼的营养价值和药用功能研究进展[J]. 食品工业科技, 2014, 35(11): 355-358.
[3] 阙婷婷, 谢妍, 郑家闻, 等. 暹罗鳄肌肉营养及腥味成分分析[J]. 浙江大学学报: 农业与生命科学版, 2013, 39(2): 122-132.
[4] 谢妍. 暹罗鳄肌肉营养评价及其肌原纤维蛋白凝胶特性的研究[D].杭州: 浙江大学, 2013: 48-69.
[5] 陈文博. 肌原纤维蛋白热诱导凝胶形成机制研究[D]. 南京: 南京农业大学, 2010: 3.
[6] 李明清. 鲤鱼肌原纤维蛋白功能特性的研究[D]. 哈尔滨: 东北农业大学, 2010: 4.
[7] 王璋, 许时婴, 汤坚. 食品化学[M]. 北京: 中国轻工业出版社, 1999: 123-176.
[8] 何琳, 江敏, 戴习林, 等. 团头鲂不同生长阶段肌肉营养成分分析及评价[J]. 食品科学, 2014, 35(3): 221-225.
[9] ASGHAR A, YEATES N. Systematic procedure for the fractionation of muscle protein, with particular reference to biochemical evaluation of meat quality[J]. Agricultural and Biological Chemistry (Japan), 1974, 38(10): 1851-1858.
[10] 张丹, 王锡昌. 中华鳖肉蛋白质营养特征分析及评价[J]. 食品工业科技, 2014, 35(15): 356-359.
[11] PARSONS N, KNIGHT P. Origin of variable extraction of myosin from myofibrils treated with salt and pyrophosphate[J]. Journal of the Science of Food and Agriculture, 1990, 51(1): 71-90.
[12] PARK D, XIONG Y L, ALDERTON A L. Concentration effects of hydroxyl radical oxidizing systems on biochemical properties of porcine muscle myofibrillar protein[J]. Food Chemistry, 2007, 101(3): 1239-1246.
[13] LAEMMLI U K. Cleavage of structural proteins during the assembly of the head of bacteriophage T4[J]. Nature, 1970, 227: 680-685.
[14] NALINANON S, BENJAKUL S, KISHIMURA H, et al. Functionalities and antioxidant properties of protein hydrolysates from the muscle of ornate threadfin bream treated with pepsin from skipjack tuna[J]. Food Chemistry, 2011, 124(4): 1354-1362.
[15] CUI S W, CHANG Y H. Emulsifying and structural properties of pectin enzymatically extracted from pumpkin[J]. LWT-Food Science and Technology, 2014, 58(2): 396-403.
[16] KOCHER P, FOEGEDING E. Microcentrifuge-based method for measuring water-holding of protein gels[J]. Journal of Food Science, 1993, 58(5): 1040-1046.
[17] 唐修君, 高玉时, 葛庆联, 等. 不同鸡种鸡蛋品质及营养成分比较研究[J]. 家畜生态学报, 2014, 35(1): 35-38.
[18] 汪仁平. 扬子鳄的营养成份初步分析[J]. 四川动物, 1999(2): 9-12.
[19] 朱成科, 黄辉, 向枭, 等. 泉水鱼肌肉营养成分分析及营养学评价[J].食品科学, 2013, 34(11): 246-249.
[20] 丁玉庭, 何晋浙, 朱旭东, 等. 黑豚肌肉的蛋白质组成及肌原纤维蛋白质的冷藏稳定性研究[J]. 食品科学, 1999, 20(10): 12-16.
[21] 陈昌, 王鹏, 徐幸莲. 不同质量比鸡胸肉、鸡腿肉混合肌原纤维蛋白的热诱导凝胶特性[J]. 食品科学, 2012, 33(9): 58-63.
[22] MARINO R, ALBENZIO M, DELLA MALVA A, et al. Proteolytic pattern of myofibrillar protein and meat tenderness as affected by breed and aging time[J]. Meat Science, 2013, 95(2): 281-287.
[23] FENNEMA O R. Food chemistry[M]. New York: Marcel Dekkar Inc, 1996: 1055.
[24] 闫海鹏, 吴菊清, 李美琳, 等. 不同种类肉肌原纤维蛋白乳化及理化特性的研究[J]. 南京农业大学学报, 2013, 36(6): 100-104.
[25] 魏朝贵, 吴菊清, 邵俊花, 等. KCl和MgCl2部分替代NaCl对猪肉肌原纤维蛋白乳化凝胶特性的影响[J]. 食品科学, 2014, 35(5): 89-95.
[26] 刘红彦. 鲤鱼肌肉中肌原纤维蛋白的性质研究[D]. 天津: 天津商业大学, 2012: 17-18.
[27] 邵俊花, 吴菊清, 刘登勇, 等. 肌肉蛋白质乳化凝胶及保油保水性机理研究进展[J]. 食品与发酵工业, 2013, 39(4): 146-150.
[28] XU Xianglian, HAN Minyi, FEI Ying, et al. Raman spectroscopic study of heat-induced gelation of pork myofibrillar proteins and its relationship with textural characteristic[J]. Meat Science, 2011, 87(3): 159-64.
[29] 朱卫星. 猪肉肌原纤维蛋白氧化及其凝胶特性的变化研究[D]. 长沙: 湖南农业大学, 2012: 40-41.
[30] 周逸, 金淼, 徐亦及, 等. 秘鲁鱿鱼肌原纤维蛋白提取和加热条件对其凝胶特性的影响[J]. 食品科学, 2013, 34(14): 126-130.
[31] 于巍, 周坚. 鱼类肌原纤维蛋白热凝及流变特性研究进展[J]. 食品科技, 2007, 32(11): 14-16.
[32] BORDERIAS A, JIMÉNEZ-COLMENERO F, TEJADA M. Viscosity and emulsifying ability of fish and chicken muscle protein[J]. International Journal of Food Scie nce & Technology, 1985, 20(1): 31-42.
[33] 徐大伦, 颜伟华, 杨文鸽, 等. 响应面法优化双髻鲨(Sphyrna z ygaena)肌肉盐溶蛋白的提取和凝胶形成条件[J]. 海洋与湖沼, 2011, 42(2): 289-293.
[34] 徐幸莲, 周光宏, 黄鸿兵, 等. 蛋白质浓度、pH值、离子强度对兔骨骼肌肌球蛋白热凝胶特性的影响[J]. 江苏农业学报, 2004, 20(3): 159-163.
[35] 常青, 黄启超, 胡永金, 等. NaCl离子强度、Mg2+浓度、热变温度和pH对云南地方黄牛肌肉盐溶蛋白凝胶保水性的影响[J]. 食品工业科技, 2009, 30(1): 101-104.
[36] 代佳佳, 韩敏 义, 徐幸莲, 等. 加热速率对鸡胸肉匀浆物凝胶特性影响[J]. 食品科学, 2014, 35(5): 18-22.
[37] 王莉莉, 潘道东. 鹅肉盐溶蛋白提取条件对其凝胶特性的影响[J].中国食品学报, 2010, 10(6): 107-15.
[38] 杨玉玲, 游远, 彭晓蓓, 等. 加热对鸡胸肉肌原纤维蛋白结构与凝胶特性的影响[J]. 中国农业科学, 2014, 47(10): 2013-2020.
[39] 孔保华, 王宇, 夏秀芳, 等. 加热温度对猪肉肌原纤维蛋白凝胶特性的影响[J]. 食品科学, 2011, 32(5): 50-54.
Physico-chemical Properties of Myofibrillar Proteins from Cultured Crocodile (Crocodylus siamensis)
XIAO Kun, WANG Xi-chang*
(College of Food Science and Technology, Shanghai Ocean University, Shanghai 201306, China)
The highest content of myofibrillar proteins of edible parts from cultured crocodile (Crocodylus siamensis) was investigated. The extracted myofibrillar proteins were explored for the effects of NaCl concentration, pH and temperature on their solubility, emulsifying properties and gel properties. The results showed that the content of myofibrillar proteins in tail muscle ((7.95±0.12) g/100 g on a wet weight basis) was the highest; the electrophoretic patterns indicated that the myofibrillar proteins mainly included myosin, paramyosin, actin, tropomyosin and troponin, and at low ionic strength had poor solubility and emulsifying properties but good gel properties. The solubility and emulsifying properties increased with increasing ionic concentration, while the opposite trend was observed for gel properties. With an increase in pH, the solubility dramatically increased first but decreased later, and the emulsifying properties and gel properties showed a trend of slow decline. The solubility and water-holding capacity (WHC) reached the lowest level at pH 5.5. With increasing temperature, the gel properties increased significantly, and the WHC initially decreased followed by a slight increase, reaching a desired level at a lower temperature (40 ℃) . Taken together, good texture quality and WHC of meat products from Crocodylus siamensis can be obtained for myofibrillar proteins with 0.2 mol/L NaCl and heating at 80 ℃.
cultured Crocodylus siamensis; myofibrillar protein; solubility; emulsifying property; gel properties
TS254
A
1002-6630(2014)23-0092-07
10.7506/spkx1002-6630-201423019
2014-06-30
上海市科委工程中心建设项目(11DZ2280300);上海市教委重点学科建设项目(J50704);上海高校知识服务平台《上海海洋大学水产动物遗传育种中心》项目(ZF1206)
肖琨(1989—),女,硕士研究生,研究方向为食品营养与品质评价。E-mail:kunxk@163.com
*通信作者:王锡昌(1964—),男,教授,博士,研究方向为食品营养与品质评价。E-mail:xc_wang@shou.edu.cn

