终末期肾脏病患者桡动脉中膜钙化与核心结合因子α1及Ⅰ型胶原的关系研究
张俊霞,徐金升,靳晶晶,白亚玲,张胜雷,崔立文,张慧然
心血管疾病是终末期肾脏病(end stage renal disease,ESRD)患者的首位死亡原因,研究显示血管钙化尤其中膜钙化是ESRD患者心血管疾病的重要病因[1]。因此,深入了解血管钙化,对降低ESRD患者心血管疾病发病率,提高其生存率有重要意义。近年来发现,血管钙化是一个以血管平滑肌细胞(vascular smooth muscle cells,VSMCs)表型转化为特征的细胞介导的主动调节过程。有前期体外实验研究发现,ESRD患者血清可使大鼠VSMCs 核心结合因子α1(Cbfα1)表达升高,Ⅰ型胶原分泌增加[2],提示ESRD患者血清可刺激VSMCs发生表型转化进而导致钙化。但ESRD患者体内血管钙化的发生机制和确切病因尚不清楚。因桡动脉属于中动脉,对其钙化特点和机制的研究可在一定程度上反映ESRD患者心、脑等中动脉的情况,为此本研究测定了ESRD患者桡动脉中膜钙化及Cbfα1和Ⅰ型胶原的表达情况,旨在探讨桡动脉中膜钙化与Cbfα1和Ⅰ型胶原的关系,为寻求新的早期防治血管钙化的靶点提供参考依据。
1 对象与方法
1.1 研究对象 选择2009年5月—2012年12月在河北医科大学第四医院肾内科住院初次行前臂动-静脉内瘘成形术的ESRD患者62例,其中男38例,女24例;年龄18~81岁,平均(51.6±14.9)岁;原发病:慢性肾小球肾炎15例,糖尿病肾病10例,高血压肾病7例,IgA肾病6例,多囊肾3例,梗阻性肾病2例,多发性骨髓瘤1例,马兜铃酸肾病1例,其他17例。纳入标准:(1)年龄≥18岁者;(2)确诊为慢性肾衰竭(尿毒症期),符合我国及美国肾脏基金会(K-DOQI)对慢性肾脏病分期为ESRD的诊断标准[3-4]者;(3)尚未开始肾脏替代治疗或肾脏替代治疗<2周者;(4)意识清楚,自愿参与本研究,并签署知情同意书者。排除标准:(1)入院前已经存在严重肝脏疾病、恶性肿瘤、原发性甲状旁腺功能亢进或减退症以及近期存在急性炎症疾病者;(2)已参与其他临床试验者。以上均经过本院伦理委员会论证。
1.2 研究方法
1.2.1 标本采集 所有患者行前臂动-静脉内瘘成形术时留取修剪的桡动脉管壁,避免损伤内膜和管壁,10%中性甲醛溶液固定24 h后石蜡包埋。
1.2.2 临床指标检测 患者初次行前臂动-静脉内瘘成形术之前(尚未行血液透析时)均测定空腹血清钙(Ca)、血清磷(P)、三酰甘油(TG)、总胆固醇(TC)、低密度脂蛋白(LDL)、高密度脂蛋白(HDL)、血红蛋白(Hb)、碱性磷酸酶(ALP)、铁蛋白、甲状旁腺素(iPTH)和C反应蛋白(CRP);测量血压;计算体质指数(BMI)。
1.2.3 桡动脉组织学分析
1.2.3.1 钙盐沉积染色 采用Von Kossa染色法将留取的桡动脉组织进行钙盐沉积染色。方法:5%硝酸银溶液避光浸染30 min,再经紫外线照射30 min,伊红复染后脱水、封片。镜下黑色为阳性染色。
1.2.3.2 Cbfα1及Ⅰ型胶原表达的测定 采用免疫组织化学法测定桡动脉管壁Cbfα1及Ⅰ型胶原的表达。方法:切片常规脱蜡,逐级乙醇溶液水化,3%过氧化氢溶液封闭内源性过氧化物酶,加一抗山羊抗人I型胶原(1∶200)、山羊抗人Cbfα1(1∶100)(武汉博士德生物工程有限公司),均置于4 ℃冰箱孵育过夜;二抗室温孵育 30 min ;二氨基联苯胺(DAB)显色,苏木素复染后脱水、透明、封片。镜下棕黄色为阳性染色。
1.2.4 染色结果判定
1.2.4.1 钙盐沉积染色 钙盐沉积分为0~4级。0级:无钙盐沉积;1级:点状沉积;2级:单个片状沉积;3级:多个片状沉积;4级:弥漫性围绕管腔沉积。用von Kossa染片每个标本8张,组织钙化积分取其平均值,并根据组织钙化积分将患者分为无钙化组和钙化组,积分<1.0分纳入无钙化组;1.0~4.0分纳入钙化组,其中1.0~2.5分为轻中度钙化,>2.5~4.0分为重度钙化。
1.2.4.2 免疫组织化学染色 采用半定量法,根据阳性细胞数比例分为4级:≤24%,0分;25%~50%,1分;51%~74%,2分;≥75%,3分。根据染色强度分为4级:阴性,0分;淡黄色,1分;黄色,2分;棕黄色,3分。阳性表达积分为阳性细胞数评分和染色强度评分之和,为0~6分。

2 结果
2.1 ESRD患者桡动脉血管钙化情况 钙盐沉积染色显示,62例ESRD患者桡动脉标本中25例发生血管钙化,发生率为40.3%,其中轻中度钙化22例(35.5%),重度钙化3例(4.8%),均发生在血管中膜(见图1)。
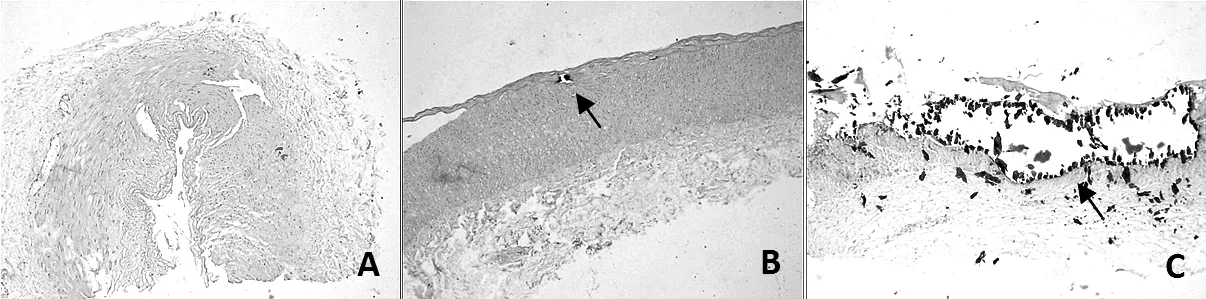
注:图A无钙化;图B轻中度钙化;图C重度钙化;箭头所指为钙化
图1 ESRD患者桡动脉血管钙化情况(Von Kossa染色,×100)
Figure1 Radial artery calcification in ESRD patients
2.2 ESRD患者桡动脉Cbfα1及Ⅰ型胶原的表达情况 根据组织钙化积分,无钙化组37例,钙化组25例。钙化组桡动脉中膜均有Cbfα1及Ⅰ型胶原的阳性表达;无钙化组桡动脉中膜31例(83.8%)Cbfα1阳性表达,19例(51.4%)Ⅰ型胶原阳性表达(见图2)。钙化组Cbfα1及Ⅰ型胶原的阳性表达积分均高于无钙化组,差异有统计学意义(P<0.05,见表1)。
2.3 两组ESRD患者临床指标的比较 钙化组与无钙化组的年龄、BMI、血压、Ca、iPTH、TG、TC、LDL、HDL、Hb、CRP、铁蛋白、ALP比较,差异无统计学意义(P>0.05)。钙化组血清P水平高于无钙化组,差异有统计学意义(P<0.05,见表2)。
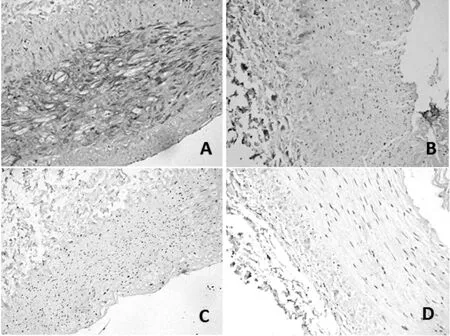
注:A图 Cbfα1阳性表达;B图 Cbfα1阴性表达;C图 Ⅰ型胶原阳性表达;D图 Ⅰ型胶原阴性表达
图2 ESRD患者桡动脉Cbfα1及Ⅰ型胶原的表达情况(免疫组织化学染色,×200)
Figure2 The expression of Cbfα1and collagen I of radial arteries in patients with ESRD
表1 两组桡动脉Cbfα1及Ⅰ型胶原阳性表达积分的比较〔M(QR)〕
Table1 Comparison of Cbfα1and collagen I expression of integral between the two groups
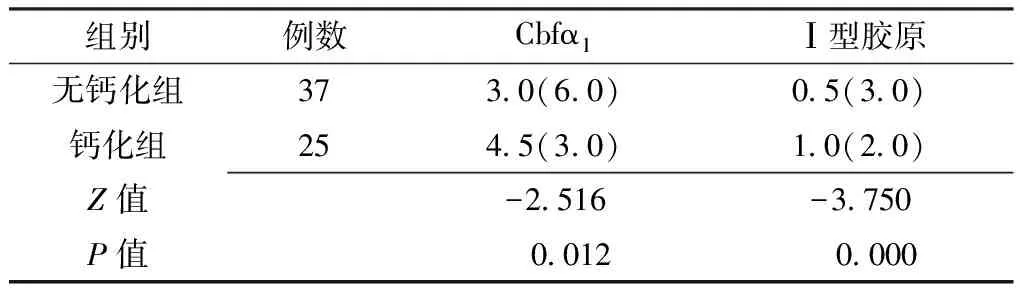
组别例数Cbfα1Ⅰ型胶原无钙化组3730(60)05(30)钙化组2545(30)10(20)Z值-2516-3750P值 0012 0000
注:Cbfα1=核心结合因子α1
2.4 钙化组 Cbfα1及Ⅰ型胶原阳性表达积分与临床指标的关系 Cbfα1阳性表达积分与血清P呈正相关(P<0.05),与年龄、BMI、血压、血清Ca、TG、TC、LDL、HDL、iPTH、Hb、CRP、铁蛋白、ALP无相关性(P>0.05)。Ⅰ型胶原阳性表达积分与血清P呈正相关(P<0.05),与年龄、BMI、血压、血清Ca、TG、TC、LDL、HDL、iPTH、Hb、CRP、铁蛋白、ALP无相关性(P>0.05,见表3)。Cbfα1阳性表达积分与Ⅰ型胶原阳性表达积分呈正相关(r=0.307,P<0.05)。
3 讨论
流行病学研究表明,ESRD人群心血管疾病病死率至少是普通人群的10倍[5],而血管钙化是ESRD患者常见并发症,其作为ESRD患者死亡风险的独立预测因子[6-7],已经受到人们的广泛关注。研究表明,ESRD患者血管钙化常见于血管中膜平滑肌层[8]。与血管内膜钙化不同,血管中膜钙化主要增加血管僵硬度、降低血管顺应性,损害血管舒张功能,从而导致心律失常和猝死。桡动脉与心、脑血管同属中等肌性动脉,对其进行研究有助于早期防治心、脑等中动脉血管钙化,降低ESRD患者心血管疾病病死率。本研究发现,ESRD患者不同程度的桡动脉钙化发生率为40.3%,与近期Freercks等[9]报道相近;且主要发生在血管中膜,提示ESRD患者血管中膜钙化发生率较高,危害性较大。
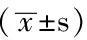
表2 两组ESRD患者临床指标的比较
注:BMI=体质指数,Ca=钙,P=磷,iPTH=甲状旁腺素,TG=三酰甘油,TC=总胆固醇,LDL=低密度脂蛋白,HDL=高密度脂蛋白,Hb=血红蛋白,CRP=C反应蛋白,ALP=碱性磷酸酶;1 mm Hg=0.133 kPa
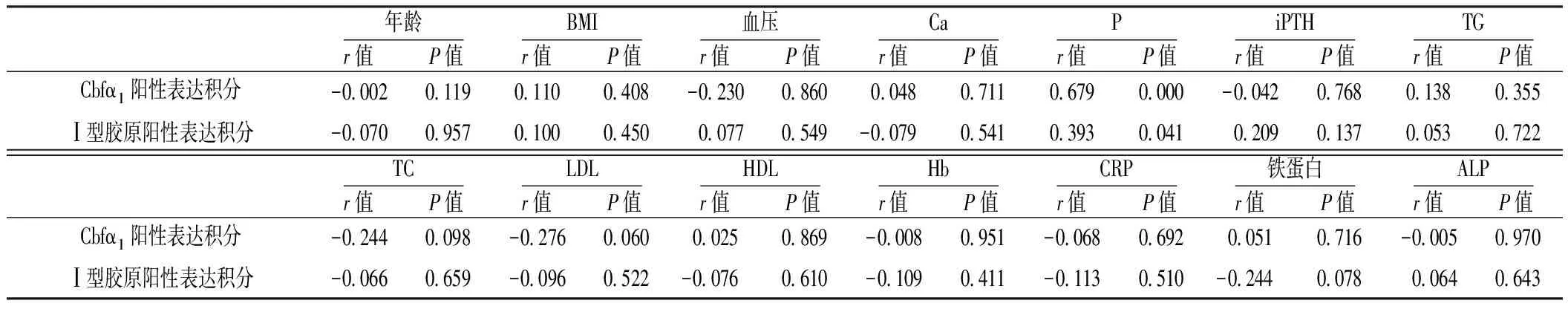
表3 钙化组Cbfα1及Ⅰ型胶原阳性表达积分与临床指标的关系
ESRD患者桡动脉中膜钙化的机制尚不清楚,研究认为血管钙化的主要机制之一是VSMCs发生表型转化[10]。而VSMCs表型转化是细胞严密调节下的转化过程,其中骨源性转录因子Cbfα1是该过程的重要调节因子。Cbfα1是转录因子Runx家族成员之一,是成骨细胞分化和软骨细胞成熟的必需因子[11-12]。在动物体内研究中,以特异性敲除血管平滑肌细胞Cbfα1基因的小鼠为模型,发现其可抑制氧化应激诱导的血管钙化过程[13]。本研究结果显示,桡动脉中膜钙化组Cbfα1及Ⅰ型胶原的阳性表达积分均高于无钙化组。 I型胶原作为细胞外基质的主要成分,约占血管壁胶原成分的60%,属于“间隙胶原”,在血管钙化的发生发展中起着重要作用,与之前细胞实验[2]相一致。本研究还发现,桡动脉血管中膜Cbfα1与Ⅰ型胶原的阳性表达积分呈正相关,这也与目前关于Cbfα1可以正向调节Ⅰ型胶原蛋白基因表达的研究相一致[14]。以上结果均提示Cbfα1、Ⅰ型胶原在ESRD患者桡动脉中膜钙化中起着重要作用,Cbfα1可作为治疗动脉中膜钙化的一个潜在靶点。本研究结果显示,在37例无钙化的血管标本中,仍有31例Cbfα1表达阳性及19例I型胶原表达阳性,说明血管中膜骨特异性蛋白表达可能是血管钙化的早期表现,进一步提示桡动脉中膜钙化是细胞介导的主动过程。
为进一步探讨诱导血管中膜VSMCs表型转化的因素,本研究分析了两组患者的临床指标,结果发现钙化组血清P水平高于非钙化组;进一步相关分析显示,血清P水平与Cbfα1及Ⅰ型胶原的阳性表达积分亦呈明显正相关,与Li等[15]的体外实验相一致。提示在ESRD患者中高磷血症通过诱导中膜平滑肌细胞高表达Cbfα1,进而分泌I型胶原参与钙化。但高血清P诱导VSMCs发生表型转化的具体分子机制仍需进一步研究证实。
综上所述,ESRD患者桡动脉中膜钙化的发生率较高,其可能与高P诱导血管中膜VSMCs表型转化,促使I型胶原表达增加有密切关系。Cbfα1作为VSMCs表型转化的重要调节因子有望成为治疗ESRD患者血管中膜钙化的重要靶点。然而,本研究也有一定的局限性,如因桡动脉组织标本留取较为困难,所以纳入研究的样本量相对较少。因此今后还需扩大样本量并设计基础实验进一步探讨ESRD患者中膜钙化的机制。
1 London GM.Cardiovascular calcification in uremic patients:clinical impact on cardiovascular function[J].J Am Soc Nephrol,2003,14(9 Suppl 4):S305- S309.
2 白亚玲,徐金升,牛哲哲,等.尿毒症血清对血管平滑肌细胞钙化及Ⅰ型胶原表达的影响[J].山东医药,2013,53(26):5-8.
3 刘章锁,王沛.K/DOQI指南关于慢性肾脏病分期的临床指导意义[J].中国实用内科杂志,2008,28(1):21-24.
4 National Kidney Foundation.K/DOQI clinical practice guidelines for chronic kidney disease:evaluation,classification,and stratification [J].Am J Kidney Dis,2002,39(2 Suppl 1):S1-S266.
5 Foley RN,Parfrey PS,Sarnak MJ.Clinical epidemiology of cardiovascular disease in chronic renal disease[J].Am J Kidney Dis,1998,32(5 Suppl 3):S112-S119.
6 Raggi P,Bellasi A,Gamboa C,et al.All-cause mortality in hemodialysis patients with heart valve calcification[J].Clin J Am Soc Nephrol,2011,6(8):1990-1995.
7 杜正光.终末期肾病患者血管钙化及其防治进展[J].实用心脑肺血管病杂志,2011,19(4):692.
8 Giachelli CM.The emerging role of phosphate in vascular calcification[J].Kidney Int,2009,75(9):890-897.
9 Freercks R,Swanepoel C,Carrara H,et al.Vascular calcification in South African dialysis patients:ethnic variation,prevalence,detection and haemodynamic correlates[J].Nephrology(Carlton),2012,17(7):607-615.
10 Chen NX,Moe SM.Vascular calcification:pathophysiology and risk factors[J].Curr Hypertens Rep,2012,14(3):228-237.
11 Komori T,Yagi H,Nomura S,et al.Targeted disruption of Cbfα1 results in a complete lack of bone formation owing to maturational arrest of osteoblasts[J].Cell,1997,89(5):755-764.
12 Otto F,Thornell AP,Crompton T,et al.Cbfα1,a candidate gene for cleidocranial dysplasia syndrome,is essential for osteoblast differentiation and bone development[J].Cell,1997,89(5):765-771.
13 Sun Y,Byon CH,Yuan K,et al.Smooth muscle cell-specific runx2 deficiency inhibits vascular calcification[J].Circ Res,2012,111(5):543-552.
14 Kern B,Shen J,Starbuck M,et al.Cbfα1 contributes to the osteoblast-specific expression of type I collagen genes[J].J Biol Chem,2001,276(10):7101-7107.
15 Li X,Yang HY,Giachelli CM.Role of the sodium-dependent phosphate cotransporter,Pit-1,in vascular smooth muscle cell calcification[J].Circ Res,2006,98(7):905-912.

