肝癌治疗过程中加入辛伐他汀的临床疗效分析
马 琳
肝癌(HCC)一般在诊断时由于其扩散常常是晚期的,残余肝功能下降一般也是无法手术和治疗的。因此,找到最佳延缓疗法来尽量延迟癌症的进程是急迫的。肝动脉化疗栓塞术(TACE)疗法在阻止癌症生长及延长患者存活时间上都取得了成功。另外,3-羟基-3-甲基戊二酰辅酶A还原酶(HMGR)抑制剂他汀类药物已经在体内和体外的研究证实存在抑制癌细胞生长和HCC转移的作用[1-4],Kawata等[5]用HMGR抑制剂普伐他汀治疗结肠癌是有效的,在临床随机试验中患者存活时间从9个月延长到18个月,所以存在明显缩小肿瘤和他汀类药物抗肿瘤转移的作用。本课题研究了在治疗HCC过程中HMGR抑制剂辛伐他汀的临床效果,现报道如下。
1 资料与方法
1.1 一般资料 选取2012年2月—2013年12月在聊城市人民医院接受TACE治疗的HCC患者183例,其中男149例(81.4%),女34例(18.6%);年龄为30~84岁,平均为(59±5)岁;病程为1~26年,平均为(11.0±6.7)年;60例(32.8%)HCC患者是由乙醇性肝硬化引起,41例(22.4%)是由慢性丙型肝炎引起,13例(7.1%)是由慢性乙型肝炎引起,55例(30.0%)是由其他肝特异性疾病(如血红蛋白沉着或者自身免疫肝炎)引起,14例(7.7%)是由数种决定性因素(如慢性丙型肝炎+滥用酒精)引起。其中52例(28.4%)患者接受了HMGR抑制剂辛伐他汀疗法作为TACE疗法的附加。将患者分为TACE组131例和辛伐他汀+TACE组52例,两组在年龄、性别、病原学、病程及化疗疗程数上差异均无统计学意义(P>0.05),具有可比性(见表1)。
1.2 研究方法
1.2.1 VISUM-HCC记录 患者数据和治疗记录均来自聊城市人民医院住院患者病例,本研究选取了Schöniger-Hekele等[6]的 VISUM-HCC,即HCC的Vienna生存模式,记录HCC临床分期(见表2)。肿瘤和淋巴结的大小是建立在初始诊断时影像技术如CT、MRI和超声波的基础上进行评估的。可以确认一个肿瘤直径≥8 cm意味着该肿瘤已占据了超过50%的肝脏,单个淋巴结直径>1 cm被认为是扩大的,使用超声波、增强CT显影或血管造影发现门静脉血栓形成的存在。

表2 VISUM-HCC记录
注:阶段1为孤立肿瘤无血管侵犯,阶段2为孤立或多发肿瘤临近血管,阶段3为肿瘤侵犯血管一级分支或局部淋巴结转移;PVT=门静脉血栓,AFP=甲胎蛋白
1.2.2 TACE治疗 所有183例患者都接受了一个或多个疗程的TACE治疗。TACE操作如下:介入的先决条件是6 h的空腹时间,被刺破的表皮区域首先需要加强消毒,接着介入科医生进行局部麻醉,紧接着在右侧股动脉使用无菌盖和穿刺,即经股动脉穿刺术插入一个4-French Cobra 的导管。在腹腔干探针之后,进行腹动脉血管的数字减影血管造影(DSA)。间接门静脉造影用来观察门静脉是否径直流过。在探索性的血管造影术之后,通过50 mg吡柔比星和5 ml碘化油乳化液的透视控制来识别和选取肝脏肿瘤供血动脉,接着用X射线显示在肿瘤中保留的碘化油。由于碘化油选择性地堆积在肿瘤毛细血管中,碘化油和吸收性明胶海绵使血管闭塞,因此并发症的风险是比较低的。介入治疗后6周,对碘化油分布和肿瘤的大小进行随访CT扫描,可以确定在血浆中的甲胎蛋白(AFP)含量。根据临床参数和患者的状态,6~10周后进行栓塞疗程。
1.2.3 辛伐他汀治疗 共计52例患者除了接受TACE治疗还接受辛伐他汀疗法。附加辛伐他汀疗法是随机开展的。所有参与的患者开始时候的剂量是20 mg/d,对药物副作用耐受性强的增加到40 mg/d。在医疗过程中,讨论治疗的耐受性,然后决定是否需要增加剂量。共计30例患者接受了辛伐他汀20 mg/d的剂量,其余22人接受了40 mg/d的剂量。辛伐他汀疗法的平均持续时间是38周。
1.2.4 观察指标和疗效判定 观察两组患者预后淋巴结是否肿大、AFP值、肿瘤大小等。存活时间被定义为初始诊断日期到患者死亡之间的时间,比较两组患者的存活时间。
1.3 统计学方法 采用SPSS 15.0 统计套装软件(SPSS Inc,Chicago,IL)进行统计分析。计量资料采用t检验,计数资料采用χ2检验。采用Cox 回归方法来进行多变量分析,采用Kaplan-Meier 方法来进行肿瘤存活分析,生存曲线比较采用log-rank检验,以P<0.05为差异有统计学意义。
2 结果
2.1 两组存活率比较 研究期间,共计133例(72.7%)患者死亡,50例(27.3%)患者存活,其中30例(22.9%)是TACE组,20例(38.5%)是辛伐他汀+TACE组;二者存活率间差异有统计学意义(χ2=4.53,P<0.05)。
2.2 两组观察指标比较 两组治疗前各指标间差异均无统计学意义(P>0.05),而治疗后在淋巴结是否肿大间差异有统计学意义(P<0.05,见表3)。
2.3 辛伐他汀对存活时间的影响 Kaplan-Meier 分析显示,辛伐他汀+TACE组患者的平均存活期(20.9个月)比TACE组患者(12.0个月)长,差异有统计学意义(P=0.003,见图1)。
2.4 一元分析 为了排除其他变量影响,分别对肝特异性预后及影响因素进行了Kaplan-Meier法分析。使用一元log-rank测试预后相关因素包括性别、胆红素、AFP、肿瘤大小、淋巴结、VISUM-HCC阶段和凝血酶原活动度。重要因素包括胆红素、AFP、肿瘤大小以及VISUM-HCC阶段,非重要因素包括性别、淋巴结和凝血酶原活动度。
2.4.1 不同胆红素水平对存活时间的影响 胆红素≤2 mg/dl的患者(n=135)比胆红素>2 mg/dl(n=48)有更好的存活效益(P=0.014),其平均存活期是15.9个月(见图2)。
2.4.2 不同AFP值对存活时间的影响 AFP值≤125 kU/L的患者(n=111)平均存活时间为18.5个月,比AFP值>125 kU/L(n=71)平均存活时间长(P=0.001,见图3)。

图1 是否使用辛伐他汀的Kaplan-Meier 存活曲线
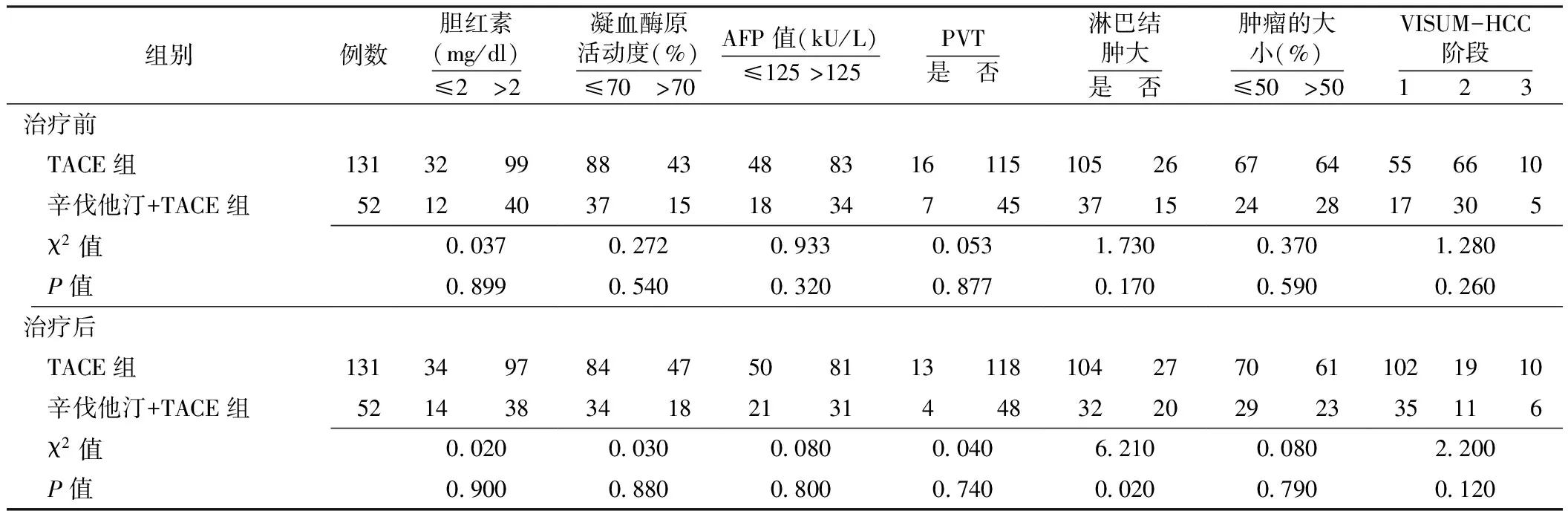
表3 两组治疗前、后的临床指标比较
注:HCC=肝癌

图2 不同胆红素水平者的Kaplan-Meier 存活曲线

图3 不同甲胎蛋白水平者的Kaplan-Meier存活曲线
2.4.3 不同肿瘤大小对存活时间的影响 肿瘤体积≤50%的患者(n=99)平均存活时间为18.0个月,比肿瘤体积>50%的患者(n=84)平均存活时间12.7个月长(P=0.001,见图4)。
2.4.4 不同VISUM-HCC阶段对存活时间的影响 VISUM-HCC阶段1的患者(n=137)存活时间优于阶段2的患者(n=30,P=0.001)和阶段3的患者(n=16,P=0.001,见图 5)。
2.5 多元分析 多元分析的重要变量与一元分析是相同的:胆红素、AFP与肿瘤的大小。此多元分析得出辛伐他汀、血浆中AFP值以及肿瘤大小为存活的预后变量,胆红素是非预后变量。对于AFP值高于125 kU/L的患者,死亡率风险高于较低AFP值的2倍多。肿瘤≥50%的患者死亡率风险是肿瘤直径较低的1.612倍。辛伐他汀OR值为0.457(P=0.0004),可以作为HCC患者存活的独立预前因素,是生存差异的另一个重要参数,驳斥了导致假阳性结果干扰的假设(见表4)。

图4 不同肿瘤大小者的Kaplan-Meier 存活曲线

图5 不同VISUM-HCC 阶段者的Kaplan-Meier存活曲线

表4 影响肝癌预后的因素Cox回归分析
3 讨论
本研究结果表明,通过服用辛伐他汀,HCC患者的存活期延长,两组生存曲线间差异有统计学意义,所以可以假定在所有病例中使用辛伐他汀疗法可以延长患者存活时间。近年来,HCC治疗已经得到改进,趋于稳定。对于大多数患者,HCC通常是由慢性肝脏疾病或者损伤和肝功能受损导致,预后仍然较差[7]。
TACE作为一种缓解的治疗措施,HCC病灶主要由肝动脉供给,而周围肝组织血流是通过门静脉的分支培育的。通过动脉注射化疗药物和随后的闭塞,可以增加HCC患者的血药浓度,并延长化疗剂的效果[8-10]。但是TACE没有完全使肿瘤坏死,是延缓性的治疗方法之一。因此本研究表明仅使用TACE治疗的患者没有积极长期的效果,患者1年后的存活比例小于50%,3年后的存活比例低于10%。在TACE治疗中接受辛伐他汀作为辅助治疗的患者组中,在大约21个月后,仍然有大约一半的患者存活,3年后20%的患者依然活着。辛伐他汀结合TACE的疗效解释了他汀类药物作用的分子基础,通过抑制HMGR作为胆固醇生物合成的第一步,显示了他汀类药物除了降血脂还有其他效果,如通过阻碍细胞的生长减少法尼基化的Ras致癌基因[11],因此降低了肿瘤细胞的生长[12-13]。
此外,他汀类药物抑制细胞体外转移,诱导细胞凋亡。Sutter等[2]研究显示在他汀类药物影响下降低细胞生长和诱导HCC细胞凋亡。Taras等[3]在动物研究中表明,用辛伐他汀治疗大鼠HCC,降低转移率,原发肿瘤略有下降。由于在化疗栓塞后,不完全坏死的残余肿瘤仍然存在,所以通过他汀类药物作用抑制其余肿瘤生长,肿瘤生长进程被延缓了,导致存活期延长,快速增殖的肿瘤细胞膜结构也需要胆固醇,因此服用他汀类药物降低胆固醇,也影响了肿瘤细胞生长。Kubota 等[14]研究显示亲水性他汀类药物比亲脂性他汀类药物对健康的肝细胞的肝毒性或细胞凋亡影响要少。由于肝硬化HCC患者体内的残余肝只有小部分,这对于HCC的治疗有积极作用。辛伐他汀的低肝毒性作用,使已经限制了细胞活性的细胞不会有更大影响。在肿瘤治疗过程中使用化疗药物的主要问题之一是肿瘤细胞耐药性[12],原因在于激活了Raf/ MEK / ERK信号传导途径使肿瘤细胞中的胆固醇浓度增加[15-17],通过抑制HMGR在胆固醇生物合成中的限速步骤减少类异戊二烯化合物的形成。类异戊二烯不仅是在激活Ras,还在胆固醇生物合成的方面发挥作用[18]。由于他汀类药物影响肿瘤细胞对化疗药物的敏感性,用洛伐他汀治疗结肠癌及在结肠癌细胞中描述表现出5-氟尿嘧啶(5-FU)和顺铂使细胞凋亡率增加[19]。
大量的临床试验证实他汀类药物在肿瘤治疗中的效果,但他汀类药物治疗并不总是表现好的方面。前瞻性临床研究显示,在辛伐他汀治疗中,增加患乳腺癌的风险为5.2%[20],在回顾性分析中,服用他汀类药物会增加乳腺癌折叠风险10.5倍[21],其他临床研究中显示在服用他汀类药物的患者中,乳腺癌的发病率没有差异[22-24]。大量的观察研究发现,他汀类药物治疗不会增加乳腺癌的发病率[25],随后的流行病学研究甚至表明了其预防效果。结直肠癌分子流行病学研究显示使用他汀类药物至少5年的患者发生结肠癌的风险降低47%[26],进一步的病例对照研究证实他汀类药物在乳腺癌[27-28]和前列腺癌[29-30]的预防作用,服用他汀类药物比服用降低胆固醇胆汁酸螯合剂患者,癌症的风险降低28%[31]。在多次临床研究随机试验中,他汀类药物治疗的效果已经得到证实。本研究显示,辛伐他汀+TACE组平均存活时间为20.9个月,高于TACE组的12.0个月。同样,在辛伐他汀治疗后6个月和1年后肿瘤的生长降低。
体外研究显示使用高剂量他汀类药物可以减少肿瘤生长,达到预期效果。然而这些高剂量药物由于在体内的副作用难以维持。他汀类药物对细胞生长作用更多的是抑制细胞生长而不是细胞毒性作用,长期低剂量治疗效果可能比短期大剂量更有效[32]。与单一的抗增殖作用相比,增加其他细胞毒性药物活性,较低剂量的他汀类药物效果更好。因此在癌症治疗中的他汀类药物与化疗或其他癌症疗法结合使用比单独治疗更适用。总之,本研究结果表明,辛伐他汀治疗可以延长HCC患者的生存时间,对HCC患者来说是一种有效的治疗药物。
1 Paragh G,Fóris G,Paragh G Jr,et al.ifferent anticancer effects of fluvastatin on primary hepatocellular tumors and metastases in rats[J].Cancer Lett,2005,222(1):17-22.
2 Sutter A,Maaser K,Höpfner M,et al.Cell cycle arrest and apoptosis induction in hepatocellular carcinoma cells by HMG-CoA reductase inhibitors.Synergistic antiproliferative action with ligands of the peripheral benzodiazepine receptor[J].J Hepatology,2005,43(5):808-816.
3 Taras D,Blanc JF,Rullier A,et al.Pravastatin reduces lung metastasis of rat hepatocellular carcinoma via a coordinated decrease of MMP expression and activity[J].J Hepatology,2007,46(1):69-76.
4 Wang J,Xu Z,Zhang M.Downregulation of survivin expression and elevation of caspase-3 activity involved in pitavastatin-induced HepG 2 cell apoptosis[J].Oncol Rep,2007,18(2):383-387.
5 Kawata S,Yamasaki E,Nagase T,et al.Effect of pravastatin on survival in patients with hepatocellular advanced hepatocellular carcinoma.A randomized controlled trial[J].Br J Cancer,2001,84(7):886-891.
6 Schöniger-Hekele M,Müller C,Kutilek M,et al.Hepatocellular carcinoma in Central Europe:Prognostic features and survival[J].Gut,2001,48(1):103-109.
7 Johnson PJ.Hepatocellular carcinoma:Is current therapy really altering outcome?[J].Gut,2002,51(4):459-462.
8 Pelletier G,Ducreux M,Gay F,et al.Treatment of unresectable hepatocellular carcinoma with lipiodol chemoembolization:A multi center randomized trial.Groupe CHC[J].J Hepatology,1998,29(1):129-134.
9 Bruix J,Llovet JM,Castells A,et al.Transarterial embolization versus symptomatic treatment in patients with advanced hepatocellular carcinoma:Results of a randomized controlled trial in a single institution[J].Hepatology,1998,27(6):1578-1583.
10 Ryder SD,Rizzi PM,Metivier E,et al.Chemoembolisation with lipiodol and doxorubicin:Applicability in British patients with hepatocellular carcinoma[J].Gut,1996,38(1):125-128.
11 Goldstein JL,Brown MS.Regulation of the mevalonate pathway[J].Nature,1990,343(6257):425-430.
12 Allal C,Favre G,Couderc B,et al.RhoA prenylation is required for promotion and cell growth and transformation,cytoskeleton organization,but not for induction of SRE transcription[J].J Biol Chem,2000,275(40):31001-31008.
13 Ogunwobi O,Beales I.Statins inhibit proliferation and induce apoptosis in Barrett′s esophageal adenocarcinoma cells[J].Am J Gastroenterology,2008,103(4):825-837.
14 Kubota T,Fujisaki K,Itoh Y,et al.Apoptotic injury in cultured human hepatocytes induced by HMG-CoA reductase inhibitors[J].Biochem Pharmacol,2004,67(12):2175-2186.
15 Weinstein-Oppenheimer CR,Henriquez-Roldan CF,Davis JM,et al.Role of the Raf signal transduction cascade in the in vitro resistance to the anti-cancer drug doxorubicine[J].Clin Cancer Res,2001,7(9):2898-2907.
16 Wong WW,Dimitroulakos J,Minden MD,et al.HMG-CoA reductase inhibitors and the malignant cell:The statin family of drugs as triggers of tumor-specific apoptosis[J].Leukemia,2002,16(4):508-519.
17 Banker DE,Mayer SJ,Li HY,et al.Cholesterol synthesis and import contribute to protective cholesterol increments in acute myeloid leukemia cells[J].Blood,2004,104(6):1816-1824.
18 Jakobisiak M,Golab J.Potential antitumor effects of statins[J].Int J Oncology,2003,23(4):1055-1069.
19 Cafforio P,Dammacco F,Gernone A,et al.Statins activate the mitochondrial pathway of apoptosis in human lymphoblasts and myeloma cells[J].Carcinogenesis,2005,26(5):883-891.
20 Dimitroukalos J,Ye LY,Benzaquen M,et al.Differential sensitivity of various pediatric cancers and squamous cell carcinomas to lovastatin-induces apoptosis:therapeutic implications.Clin Cancer Res,2001,7(1):158-167.
21 Elzouki AN,Eriksson S.Risk of hepatobiliary disease in adults with severe alpha-1-antitrypsin deficiency(PiZZ):Is chronical virus hepatitis B or C an additional risk factor for cirrhosis and hepatocellular carcinoma?[J].Eur J Gastroenterology Hepatology,1996,8(10):989-994.
22 Farazi PA,DePinho RA.Hepatocellular carcinoma pathogenesis:From genes to environment[J].Nat Rev Cancer,2006,6(9):674-687.
23 Friis S,Poulsen AH,Johnsen SP,et al.Cancer risk among statin users:A population-based cohort study[J].Int J Cancer,2005,114(4):643-647.
24 Ghosh AK,Majumder M,Steele R,et al.Hepatitis C virus NS5A protein protects against TNF-alpha mediated apoptotic cell death[J].Virus Res,2000,67(2):173-178.
25 Lamerz R,Runge M,Stieber P,et al.Use of serum PIVKA-II(DCP) determination for differentiation between benign and malignant liver disease[J].Anticancer Res,1999,19(4):2489-2493.
26 Larsson O.Cell cycle-specific growth inhibition of human breast cancer cells induced by metabolic inhibitors[J].Glycobiology,1993,3(5):475-479.
27 Law M,Rudnicka AR.Statin safety:A systematic review[J].Am J Cardiol,2006,97(8):52-60.
28 Marcelli M,Cunningham GR,Haidacher SJ,et al.Caspase-7 is activated during lovastatin-induced apoptosis in the prostate cell line[J].LNCaP Cancer Res,1998,58(1):76-83.
29 Marcos A,Ham JM,Fisher RA,et al.Single-center analysis of the first 40 adult-to-adult living donor liver transplants using the right lobe[J].Liver Transplantation,2000,6(3):296-301.
30 Sherman M.Hepatocellular carcinoma:Epidemiology,risk factors,and screening[J].Semin Liver Dis,2005,25(2):143-154.
31 Shin S,Sung BJ,Cho YS,et al.An anti-apoptotic protein human survivin is a direct inhibitor of caspase-3 and-7[J].Biochemistry,2001,40(4):1117-1123.
32 Shellman YG,Ribble D,Miller L,et al.Lovastatin-induced apoptosis in human melanoma cell lines[J].Melanoma Res,2005,15(2):83-89.

