高危型HPV-DNA检测联合薄层液基细胞学对宫颈癌筛查研究
刘珂,邹志宁,邓琼琼
(武宁县中医院检验科,江西武宁332300)
·检验与临床·
高危型HPV-DNA检测联合薄层液基细胞学对宫颈癌筛查研究
刘珂,邹志宁,邓琼琼
(武宁县中医院检验科,江西武宁332300)
目的评价高危型HPV-DNA检测联合薄层液基细胞学检查(TCT)对宫颈癌及癌前病变筛查的效果。方法对妇产科门诊的1380例病人分别进行薄层液基细胞学检查、高危型人乳头状瘤病毒DNA检测,以病理组织学诊断结果为金标准。结果高危型HPV-DNA阳性率26.74%,病理学检查CINⅡ及其以上病人为51例,以组织病理学结果为金标准,CINⅡ及以上为阳性,薄层液基细胞学、高危HPV-DNA和高危HPV-DNA联合薄层液基细胞学检查方法的敏感度分别为82.35%、86.27%、96.07%,特异度分别为86.38%、83.52%、80.36%,正确诊断指数分别为68.73%、69.79%、76.43%。结论高危型HPVDNA检测联合薄层液基细胞学检查在宫颈癌前病变的筛查中有很高的敏感度和正确诊断指数。
人乳头状瘤病毒;薄层液基细胞学;宫颈癌
DOI∶10.3969/j.issn.1674-1129.2014.06.048
宫颈癌是目前常见危害女性健康的恶性肿瘤之一,由于宫颈癌有着一个较长的、可逆转的癌前病变期,人乳头状瘤病毒(HPV)感染所致宫颈癌已被公认是一个感染性癌[1],早期患者的治愈率高达90%,因此,对宫颈癌的研究一直受到人们的关注[2]。薄层液基细胞学检查(Thinprep cytologic test, TCT)是目前应用最广泛的筛查技术,具有较高的细胞学诊断准确性和敏感性。目前流行病学和生物学资料已经证明高危型HPV-DNA感染是宫颈癌及癌前病变的主要原因。本研究通过TCT,高危型HPV-DNA及TCT联合高危型HPV-DNA检测三种方法筛查宫颈病变患者,探索最佳筛查宫颈癌及癌前病变的方法。
1 材料与方法
1.1 选择对象2011年1月-2012年12月,在我院妇产科就诊具有白带异常、性接触性出血、阴道出血妇女1380例,年龄27~69岁,平均39.7岁。分别进行TCT检查、高危型HPV-DNA检测或以上两种方法联合检查和通过阴道镜取活检,以组织学诊断为金标准。
1.2 实验方法
1.2.1 TCT检测用专用的宫颈细胞采样刷,刷取宫颈转化区细胞,保存于专用保存液中。细胞学诊断标准采用TBS(The Bethesda System)分类法,即∶阴性和异常上皮细胞。异常上皮细胞包括异常鳞状上皮细胞和异常腺上皮细胞。异常鳞状上皮细胞分为意义不明确的不典型鳞状细胞(ASCUS),低度鳞状上皮内病变(LSL),高度鳞状上皮内病变( HSL),鳞状上皮细胞癌(SCC)。异常腺上皮细胞指不典型腺细胞(ACC)和腺癌(GC),细胞学检查阳性诊断标准为LSL及以上的病变。
1.2.2 高危型HPV-DNA检测根据美国Digene公司研制的HPV-DNA HC-2方法(Hybrid Cupture,HC-2),按照操作规定,对标本进行目前已知的13种致癌型HPV-DNA(16、18、31、33、35、39、45、51、52、56、58、59、68型)的检测,根据其诊断标准,HPV-DNA≥1.0ng/L为阳性。
1.2.3 阴道镜下病理组织学检查方法使用深圳金科威公司的SLC-2000型电子阴道镜进行检查操作,对可疑病灶进行镜下定位活检,对镜下未发现明显病灶,则取3、6、9、12点进行活检。所有病理标本由两名专门的病理医师进行阅片,作出最后的诊断。诊断分为:正常或炎症,宫颈上皮内瘤样病变(CIN),按轻、中、重分为CINⅠ、CINⅡ、CINⅢ或原位癌(CIS)、鳞癌,、腺癌。为统一细胞学与组织学诊断标准,根据TBS标准LSL即CINⅠ,HSL包括CINⅡ和CINⅢ。
1.3 统计学方法采用SPSS 16.0录入数据,并进行分析。
2 结果
2.1 宫颈细胞学TCT检查结果ASCUS患者171例(12.39%,171/1380),LSIL患者96例(6.96%,96/1380),HSIL患者36例(2.60%,36/1380),SCC患者4例(0.29%,4/1380)。
2.2 高危HPV检查结果本次检查的妇女中高危型HPV-DNA检测阳性共369例,阳性率为26.74%,经病理确诊的宫颈病变HPV阳性率分别为CINⅡ83.33%(15/18)、CINⅢ或原位癌90%(18/ 20)、鳞癌84.61%(11/13)。
2.3 病理学检查结果该人群宫颈高危鳞状上皮瘤变及癌(CINⅡ及以上)现患率为3.7%(51/1380),检查结果为CINⅡ18例,CINⅢ或原位癌20例,鳞癌13例。
2.4 三种筛查方法的综合比较以组织病理学结果为金标准,CINⅡ及以上为阳性,计算TCT、高危HPV-DNA和高危HPV-DNA联合TCT检查方法的敏感度、特异度、阳性预测值、阴性预测值和正确诊断指数。见表1。
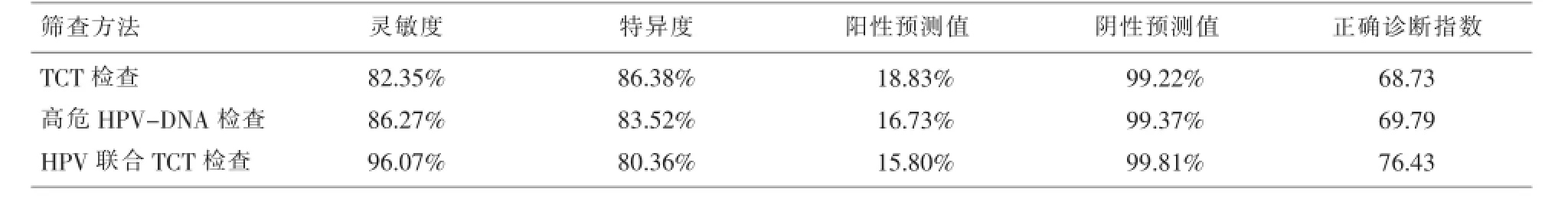
表1 宫颈癌各筛查方法的诊断效果评价
3 讨论
目前的流行病学调查研究与分子生物学都证明,高危型HPV感染是宫颈癌发病的主要因素。本次研究发现,高危型HPV-DNA阳性率为26.74%,与沈艳红[3]在我国山西省进行的宫颈癌调查的结果接近,可能与妇科门诊病人中的高危人群比较集中有关。单独以高危型HPV-DNA检测进行筛查CINⅡ及其以上的病变的敏感度达86.27%,与Wright[4]报告敏感度84%和Schiffman[5]报告的敏感度88%相近,比巴氏涂片的敏感度高25%~30%[6]。国外有研究发现,CIN的自然转归,无HPV感染患者CIN逆转的发生是HPV持续感染的4倍。因此,及时预测CIN的转归,高危型HPV-DNA检测对筛查CINⅡ、CINⅢ和早期宫颈癌的敏感度很高,HC-Ⅱ检测对于临床正确处理CIN,无疑是至关重要的[7]。从宫颈癌前病变发展成宫颈癌,是一个较长时间的过程,大约10年左右。级别越高,发展成癌的可能性越大,级别越低,自然消退的可能性越大。大部分的CINⅠ不治疗也能自然消退。故本研究以CINⅡ及其以上病变为阳性检出率。
本研究单独以细胞学TCT检查宫颈病变患者,并以病理学检查结果为金标准,发现敏感度为82.35%,阴性预测值为99.22%。TCT是1996年由美国食品和药品管理局批准应用于临床诊断宫颈疾病的方法,它采用固定样式的扫帚式刷子按规定手法进行操作,旋转式刷拭,不留死角,刷头全部进入细胞保存液,不会丢失标本。经混合后制成的涂片均匀一致,使细胞具有代表性,因此灵敏度较高。另外此项技术还具有可重复性的优点。其不足之处在于检测者之间存在主观差异。
本次研究发现TCT联合高危型HPV-DNA检测敏感度为96.07%,正确诊断指数为76.43,比单独TCT检测和HPV-DNA检测的灵敏度和正确诊断指数都高出不少,反映这两个检测方法结合可互相弥补缺点和不足,最大程度发现阳性病人,减少漏诊率。TCT制作的单层细胞片可一次取样多次重复制片,并可供HPV检测,不需另外采样,不增加病人的麻烦。早期发现宫颈癌可以及时采取干预措施,提高患者的生存率。因此TCT联合高危型HPV-DNA检测是最佳的筛查宫颈癌的方法。
[1]王长奇,王康,陈燕萍,等.HPV多重感染与宫颈病变关系的分析.实验与检验医学,2012,30(2)∶166-168.
[2]米贤军,白宝敏,熊小英,等.宫颈癌及癌前病变筛查方法对比研究[J].医药论坛杂志,2005,26(24)∶16.
[3]沈艳红,陈凤,黄曼妮,等.我国山西省子宫颈癌高发区人乳头瘤病毒感染调查[J].中国医学科学院学报,2003,25(4)∶381-385.
[4]Wright TV Jr.Denny L,Kulm L,et al,HPV-DNA testing of self-collected vaginal samples compared with cytologic screening to detect cervical cancer[J].JAMA,2000,283(1)∶81-86.
[5]Schiffman M,Herrern R,Hildesheim A,et al.HPV-DNA testing in cervical cancer screening results from women in a high risk province in Costa Rica[J].JAMA,2000(1)∶87-93.
[6]Clavel C,Masure M,Bory JP,et al,Human papilloma virus testing in primary screening for the detection of high-grade cervical les ions∶a study of 7932 women[J].Br J Cancer,2001,84(12)∶1616-1623.
[7]刘凤英,徐晓明,刘毅智,等.子宫颈癌组织中人乳头状瘤病毒16 E6 mRNA表达与survivin蛋白表达的相关性[J].中华妇产科杂志,2005,40(9)∶629.
R446.19,R446.62,R737.33
A
∶1674-1129(2014)06-0767-02
2014-04-29;
2014-08-07)

