不同剂量右美托咪定对全身麻醉苏醒期应激反应的影响
于铁莉,岳文慧△,王金城,李 艳,李汝泓,张晓侠,王志学
(1.承德医学院附属医院麻醉科,河北承德 067000;2.河北医科大学第三医院麻醉科,石家庄 050051)
盐酸右美托咪定是一种新型、高选择性的α2肾上腺素能受体激动剂,具有镇痛、镇静和抑制交感活性等作用[1]。对呼吸抑制作用小,能减轻应激反应,减少全身麻醉后的术后并发症[2]。气管拔管是全身麻醉过程中应激反应较强的时期,可造成患者血压升高,心率加快,严重者甚至发生心肌梗死或心律失常。因此全身麻醉苏醒期的平稳对患者至关重要,也是麻醉医师的管理目标。本研究通过比较全身麻醉期间持续应用不同剂量的盐酸右美托咪定,观察拔管期血流动力学及应激反应的变化,寻找其在临床应用中合理的量效关系,为临床应用提供一定的依据。
1 资料与方法
1.1一般资料 本研究所有病例均获得了本院伦理委员会和患者本人的同意。选择择期全身麻醉下行胃癌根治术患者90例,ASA分级为Ⅰ~Ⅱ级,年龄40~65岁,体质量45~80 kg,体质量指数(BMI)<30 kg/m2。心肺功能均正常,无神经及内分泌系统疾病,无电解质紊乱。分为3组,每组各30例。3组患者的性别、年龄、体质量及手术时间差异无统计学意义(P>0.05)。见表1。
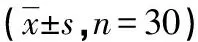
表1 3组患者的一般情况
1.2方法
1.2.1麻醉方法 所有患者均常规禁饮食,进入手术室后开放静脉通路,监测心电图(ECG)、心率(HP)与血氧饱和度(SpO2)。局部麻醉下行桡动脉穿刺,建立有创血压监测。静脉注射盐酸戊乙奎醚0.5~1.0 mg。将200 μg /2 mL盐酸右美托咪定用0.9%生理盐水稀释到50 mL(4 μg/mL)。中剂量组(D1组)诱导前10 min内缓慢泵入右美托咪定负荷剂量0.5 μg/kg,术中以0.5 μg·kg-1·h-1维持泵入;高剂量组(D2组)诱导前10 min内缓慢泵入右美托咪定负荷剂量0.8 μg/kg,术中以0.8 μg·kg-1·h-1维持泵入;对照组(C组),诱导前及术中均给予等量的生理盐水。3组均持续输注至缝皮前。在给予右美托咪定负荷剂量后开始诱导,3组患者麻醉诱导用药均为咪达唑仑0.1 mg/kg,顺苯磺酸阿曲库胺0.15 mg/kg,芬太尼3~5 μg/kg,丙泊酚2 mg/kg。诱导后行气管内插管,要求一次成功,排除困难插管患者。然后进行机械通气,调整通气参数:潮气量8~10 mL/kg,频率10~12次/min,维持呼气末二氧化碳分压(PETCO2)35~40 mm Hg,吸呼比(I∶E)1∶1.5,呼气末正压通气(PEEP)为0。术中以2%~3%七氟醚维持,顺式阿曲库铵按需给药,并根据术中监测情况给予芬太尼1~3 μg/kg,手术结束前30 min,并不再追加任何静脉麻醉药,缝皮前停止泵入右美托咪定及吸入药。
1.2.2监测指标 记录3组患者的手术结束时(T1)、拔管后即刻(T2)、拔管后5 min(T3)各时点HR、收缩压(SBP)、舒张压(DBP)、平均动脉压(MAP),并抽取各时点动脉血测量血浆皮质醇(Cor)和血糖(Glu)水平。记录拔管时间和不良反应情况,如呼吸抑制、高血压、低血压、HR加快、心动过缓、寒颤等。

2 结 果
2.13组患者血流动力学变化 组间比较:在T1与T3时刻3组患者HR、SBP、DBP、MAP比较差异无统计学意义(P>0.05);在T2时刻C组患者的HR、SBP、DBP、MAP明显高于D1组和D2组(P<0.05),D1组与D2组相比差异无统计学意义(P>0.05)。组内比较:C组患者的HR、SBP、DBP、MAP在T2时刻,明显高于T1和T3时刻(P<0.05);D1与D2组各时点HR、SBP、DBP、MAP变化不大(P>0.05)。见表2。
2.2Cor与Glu浓度变化 3组患者的Cor与Glu浓度在T1~T3时刻均呈现一致增加。组间比较:在T3时点C组的Cor与Glu浓度均明显高于D1、D2组,差异有统计学意义(P<0.05);D1和D2组虽有升高,但两组间变化差异无统计学意义(P>0.05)。组内比较:各组在T3时点Cor、Glu浓度均升高,与T1时刻比差异有统计学意义(P<0.05)。见表3。
2.3拔管时间的比较 3组患者拔管时间比较,C组(5.10±3.12)min与D1组(5.50±3.14)min之间差异无统计学意义(P>0.05);C组和D1组短于D2组(8.01±2.02)min,差异有统计学意义(P<0.05)。
2.4不良反应发生情况 3组患者在麻醉清醒期均未发生躁动,高血压与HR加快的发生率C组明显高于D1和D2组(P<0.05);D2组出现心动过缓与低血压与D1组相比有增多的趋势,但两组间比较差异无统计学意义(P>0.05)。见表4。
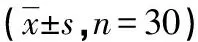
表2 3组患者苏醒期血压、HR的变化
a:P<0.05,与D1、D2组比较。
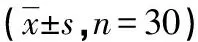
表3 3组患者苏醒期Cor及Glu的变化
a:P<0.05,与D1、D2组比较;b:P<0.05,组内比较。
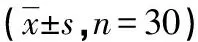
表4 3组患者的不良反应情况
a:P<0.05,与 D1、D2组比较。
3 讨 论
右美托咪定是高选择性的α2肾上腺素能受体激动药,具有抑制交感活性,镇痛作用强,可控性好,不抑制呼吸等优点。能够维持围术期心血管系统的稳定性,减轻应激反应[3],同时降低全身麻醉药的用量,这在大量的临床试验中已经得到证实[4-5]。本研究在此基础上进一步比较了能够有效抑制全身麻醉拔管引起的应激反应的用药剂量。
在全身麻醉苏醒期,由于麻醉减浅,手术切口的疼痛以及吸痰、气管拔管等气道内刺激,会导致患者交感神经系统的过度兴奋,引起一些应激激素的分泌[6],如Cor、去甲肾上腺素、肾上腺素和β内啡肽等释放。Cor是反映机体应激水平的一个较敏感指标,有时用来专指“应激激素”。血浆Cor浓度与Glu水平也有着密切的相关性,随着Cor浓度的迅速升高,可直接和间接升高Glu,而高Glu也是影响预后转归的重要指标[7]。因此,本研究选择了血浆Cor与Glu浓度来判断不同剂量右美托咪定抑制应激反应的程度,寻找达到平稳麻醉的合理剂量。
右美托咪定作为麻醉的辅助用药,能够有效的抑制手术和麻醉引起的交感神经兴奋,避免术中血流动力学的剧烈波动,减少心血管等不良事件的发生[8]。在本研究中,3组患者的血浆Cor及Glu浓度在整个过程中均呈现一致增加,但在拔管后5 min C组的Cor与Clu浓度均明显高于D1、D2组,而D1、D2组虽有升高,但两组间差异无统计学意义(P>0.05)。这说明3种方法均不能完全抑制应激反应的发生,但应用右美托咪定组的应激反应较轻。在血流动力学波动上,C组患者在苏醒期波动较大,组内比较血压和HR差异有统计学意义(P<0.05),而D1、D2组血压和HR在各时点变化不明显(P>0.05);组间比较发现:对照组在各时点血压和HR变化均较D1和D2组明显,尤其在插管毕即刻血流动力学变化差异有统计学意义(P<0.05)。这说明右美托咪定能较好地维持心血管系统的稳定性。
本研究中,3组患者的拔管时间D2组明显长于其他两组(P<0.05);D1组和C组之间差异无统计学意义(P>0.05)。说明随着右美托咪定剂量的加大,呼吸恢复时间会延长,拔管时间明显延长。有研究证明[9],应用较大剂量的右美托咪定产生明显镇静时,可轻微减少分钟通气量,但仍然不会出现动脉血氧或pH的变化,而且对高碳酸血症的兴奋性通气反应性始终存在。而随右美托咪定血药浓度增加,呼吸频率会相应增加,从14 次/min增至25 次/min。本研究中D2组拔管时间延长,可能与增加右美托咪定剂量而引起分钟通气量减少有关。不良反应上C组较D1、D2组多,尤其是高血压和HR加快,差异有统计学意义(P<0.05);D2组不良反应比D1组有增多趋势,且拔管时间延长。所以认为0.5 μg·kg-1·h-1的右美托咪定更适于临床应用。
综上所述,中等剂量的右美托咪定能够安全有效的维持患者全身麻醉苏醒期的血流动力学稳定性,较好地抑制全身麻醉拔管引起的应激反应。
[1]Menda F,Kóner O,Sayin M,et al.Dexmedetomidine as an adjunct to anesthetic induction to attenuate hemodynamic response to endotracheal intubation in patients undergoing fast-track CABG[J].Ann Card Anaesth,2010,13(1):16-21.
[2]吴新民,许幸,王俊科,等.静脉注射右美托咪定辅助全身麻醉的有效性和安全性[J].中华麻醉学杂志,2009,27(9):773-776.
[3]Yildiz M,Tavlan A,Tuncer S,et al.Effect of dexmedetomidine on haemodynamic responses to laryngoscopy and intubation:perioperative haemodynamics and anaesthetic requirements[J].Drugs R D,2006,7(1):43-52.
[4]Shukry M,Kennedy K.Dexmedetomidine as a total intravenous anesthetic in infants[J].Paediatr Anaesth,2007,17(6):581-583.
[5]Anschel DJ,Aherne A,Soto RG,et al.Successful intraoperative spinal cord monitoring during scoliosis surgery using a total intravenous anesthetic regimen including dexmedetomidine[J].J Clin Neurophysiol,2008,25(1):56-61.
[6]Talke P,Chen R,Thomas B,et al.The hemodynamic and adrenergic effects of perioperative dexmedetomidine infusion after vascular surgery[J].Anesth Analg,2000,90(4):834-839.
[7]Mccowen KC,Malhotra A,Bistrian BR.Stress-induced hyperglycemia[J].Crit Care Clin,2001,17(1):107-124.
[8]Wijeysundera DN,Naik JS,Beattie WS.Alpha-2 adrenergic agonists to prevent perioperative cardiovascular complications:a meta-analysis[J].Am J Med,2003,114(9):742-752.
[9]Ebert TJ,Hall JE,Barney JA,et al.The effects of increasing plasma concentrations of dexmedetomidine in humans[J].Anesthesiology,2000,93(2):382-394.

