CD147在膀胱尿路上皮癌组织中的表达及临床意义
刘 敏,毛向明,薛义军,邹晓峰,袁源湖,肖日海,张国玺,伍耿青,王晓宁
(1.南方医科大学附属南方医院泌尿外科,广州 510515;2.赣南医学院第一附属医院泌尿外科,江西赣州 331000)
目前,临床上用于评估膀胱尿路上皮癌患者预后的分子标记物不多。以往的研究结果表明基质金属蛋白酶(matrix metalloproteinases,MMPs)在恶性肿瘤的浸润和转移等方面发挥着关键作用。CD147被称为细胞外基质金属蛋白酶诱导因子,该蛋白能够刺激与肿瘤相关的基质成纤维细胞或内皮细胞分泌产生MMPs,从而促进恶性肿瘤的进展[1-2]。到目前为止,尽管文献中已有关于CD147与膀胱尿路上皮癌患者关系的研究报道[3-4],但研究结果不尽一致,而且就CD147是否可以作为预测该肿瘤预后的分子标记物仍不明确。本研究采用组织芯片技术和免疫组织化学方法,检测108例膀胱尿路上皮癌患者中CD147的表达状况,探讨CD147与膀胱尿路上皮癌患者的临床病理特征及其与预后的关系。
1 资料与方法
1.1一般资料 收集赣南医学院第一附属医院2011年9月至2013年7月接受手术治疗的121例膀胱尿路上皮癌患者的石蜡标本。纳入标准:(1)无其他部位的原发肿瘤;(2)术前均未接受过放射治疗和化疗(包括膀胱灌注);(3)具有明确的死亡原因;(4)临床资料、病理资料和随访资料完整。所有病例均经组织学检查明确确诊为膀胱尿路上皮癌。在组织芯片制作过程中,13例患者的标本丢失,故实际有108例患者纳入本研究。108例患者中男91例,女17例;年龄31~82岁,中位年龄58.1岁。临床分期按国际抗癌联盟(UICC)-TNM标准:浅表性癌(Ta~T1)38例,浸润性癌(T2~T4)70例;肿瘤病理分级按WHO标准:G115例,G236例,G357例;肿瘤数目:单发74例,多发34例;肿瘤大小:<3 cm 47例,≥3 cm 61例;经尿道膀胱肿瘤电切术35例,膀胱部分切除术30例,膀胱全切除术43例。另取20例正常膀胱黏膜组织作为对照分析,所有标本均经10%甲醛溶液固定及石蜡包埋。另收集赣南医学院第一附属医院2011年9月至2013年7月手术切除的新鲜膀胱尿路上皮癌患者20例的组织标本及对应的癌旁组织,患者均经病理证实为膀胱尿路上皮癌。患者男14例,女6例;年龄36~75岁,中位年龄55.3岁。UICC-TNM临床分期:Ta~T112例,T2~T48例;WHO病理分级:G17例,G210例,G33例。每例分别取癌组织和癌旁组织(距离癌组织 5 cm以外,经病理诊断证实无癌细胞浸润),所有标本获取后均迅速置于液氮中快速冷冻,后转至-80 ℃冰箱内保存,用于RT-PCR和Western blot检测。该研究获得赣南医学院第一附属医院医学伦理委员会的批准及所有患者的知情同意。
1.2主要试剂与仪器 兔抗人CD147多克隆抗体购自美国Santa Cruz公司;TRIzol 试剂、转录酶、Taq酶、cDNA合成试剂盒、PCR试剂盒及引物等均购自上海生工生物工程技术服务有限公司;免疫组织化学SP试剂盒和DAB 显色试剂盒购自北京中杉金桥生物技术有限公司;蛋白定量试剂盒及化学发光检测试剂盒购自美国Pierce公司;石蜡切片机购自德国Leica公司;组织微阵列仪购自Beecher公司;GeneAmp PCR System9700扩增仪购自美国PE公司。
1.3方法
1.3.1临床病理及随访资料的收集 回顾性收集了所有患者的性别和年龄等一般人口学资料,以及肿瘤的大小、数目、病理分级、临床分期、淋巴结转移情况和生存时间等资料。生存时间以月计算,对于死亡患者,生存时间为手术日至死亡之日的时间;对于生存患者,生存时间为手术日至最后一次随访时间。随访采用电话随访和信访等方式。
1.3.2RT-PCR方法 TRIzol法提取总RNA,紫外分光光度计法测定RNA纯度,选择吸光度值1.8~2.0之间的RNA样本,反转录成cDNA,以cDNA为模板进行PCR扩增。CD147基因上游引物序列:5′-GCA CCA GCA CCT CAG CCA CGA-3′,下游引物序列:5′-CTC CTG CGT CTT CCT CCC CGA GC-3′。以GAPDH作为内参照,GAPDH上游引物序列:5′-GGA AGG TGA AGG TCG GAG TA-3′,下游引物序列:5′-CCT GGA AGA TGG TGA TGG G-3′。PCR反应条件如下:94 ℃预变性5 min;94 ℃变性30 s,56 ℃退火30 s,72 ℃延伸30 s,共30个循环;最后72 ℃延伸5 min。PCR扩增产物经2%琼脂糖凝胶电泳,以CD147/GAPDH条带灰度值的比值表示CD147 mRNA的相对表达量。
1.3.3Western blot方法 RIPA组织裂解液提取总蛋白,BCA法检测蛋白浓度,十二烷基硫酸钠-聚丙烯酰胺凝胶电泳(SDS-PAGE)分离蛋白质,半干法电转移至聚偏氟乙烯(PVDF)膜上,5%脱脂奶粉37 ℃封闭2 h,加入兔抗人CD147多克隆抗体(1∶500稀释),4 ℃孵育过夜,次日用TBST洗涤3次,加入过氧化物酶标记的羊抗兔二抗(1∶5 000稀释),37 ℃孵育2 h,TBST溶液洗膜3次,化学发光法显色,以CD147/GAPDH条带积分光密度值的比值表示CD147 蛋白的相对表达量。
1.3.4组织芯片的构建 采用美国Beecher公司的组织阵列仪制作组织芯片,具体构建过程按文献[5]所描述的方法进行。
1.3.5CD147免疫组织化学染色 采用SP免疫组织化学染色法检测CD147蛋白的表达,DAB显色,具体操作按说明书进行。CD147多克隆抗体工作浓度为1∶100,一抗用PBS代替作为阴性对照,已知的阳性切片作为阳性对照。
1.3.6免疫组织化学染色结果判定 由2位事先不知临床及随访资料的病理科医师读片2次以上,出现判断结果不一致时,共同讨论决定。CD147以肿瘤细胞质或细胞膜出现棕黄色颗粒为阳性,根据Reimers等[6]研究报道,高倍视野(×400)下,每张切片观察5个视野,计数200个肿瘤细胞,依据CD147反应阳性细胞显色强度及范围进行评价:(1)阴性(-):无阳性细胞染色;(2)低表达(+):显色浅或染色略深的细胞数小于或等于30%;(3)中度表达(++):染色略深的细胞数大于30%或显色深的细胞数小于或等于50%;(4)高表达(+++):显色深的细胞数大于50%。

2 结 果
2.1RT-PCR结果 20例膀胱尿路上皮癌组织中,CD147 mRNA相对表达量为0.967±0.133;对应癌旁组织中,CD147相对表达量为0.223±0.096,两组比较差异有统计学意义(P<0.01)。见图1。
2.2Western blot结果 20例膀胱尿路上皮癌组织中,CD147蛋白相对表达量为0.766±0.103;对应癌旁组织中,CD147蛋白相对表达量为0.165±0.055,两组比较差异有统计学意义(P<0.01)。见图2。
2.3免疫组织化学结果
2.3.1CD147蛋白的表达 CD147蛋白主要定位在肿瘤细胞的细胞膜和细胞质中,肿瘤间质和细胞核未见染色,见图3。108例膀胱尿路上皮癌组织中,29例(26.9%)为CD147阴性表达,27例(25.0%)为低表达,36例(33.3%)为中度表达,16例(14.8%)为高表达,即CD147蛋白阳性表达率为73.1%(79/108)。20例正常膀胱黏膜组织中,19例为CD147阴性表达,1例为CD147弱阳性表达。见图3。

T:肿瘤组织;N:癌旁组织。
图1 RT-PCR检测CD147 mRNA在膀胱尿路上皮癌组织和癌旁组织中的表达

T:肿瘤组织;N:癌旁组织。
图2 Western blot检测CD147蛋白在膀胱尿路上皮癌组织和癌旁组织中的表达

A:CD147在正常膀胱黏膜组织中阴性表达;B:CD147在膀胱尿路上皮癌组织中低表达;C:CD147在膀胱尿路上皮癌组织中中度表达;D:CD147在膀胱尿路上皮癌组织中高表达。
图3 CD147在正常膀胱黏膜和膀胱尿路上皮癌组织中的表达(免疫组织化学染色100,200×)
2.3.2CD147表达与临床病理特征的关系 CD147表达与膀胱尿路上皮癌患者的性别、年龄以及肿瘤数目无关(P>0.05),而与肿瘤细胞临床分期(P=0.003)、病理分级(P=0.011)、淋巴结转移(P<0.001)和肿瘤大小(P=0.024)有关,见表1。
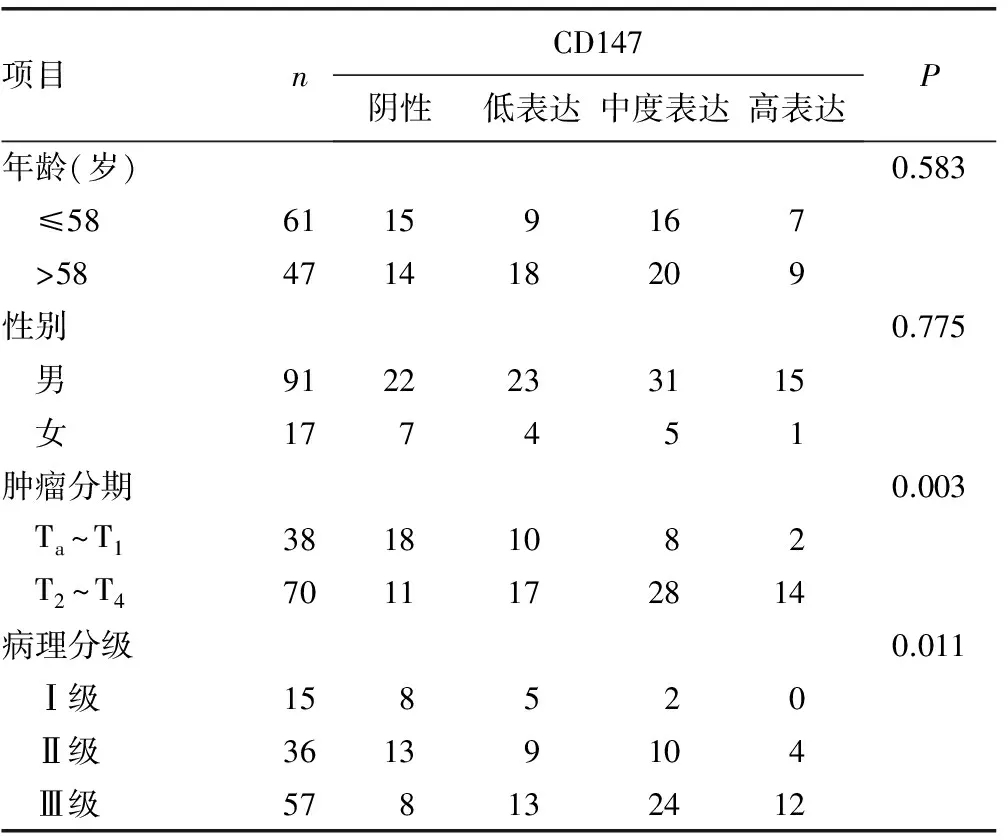
表1 108例膀胱尿路上皮癌临床病理参数与CD147表达水平的关系(n)

续表1 108例膀胱尿路上皮癌临床病理参数与CD147表达水平的关系(n)
2.4CD147与患者预后的关系
2.4.1生存时间 本组随访时间为11~86个月,中位随访时间62.7个月,失访8例,随访率92.6%,总体5年生存率为59%,见图4。CD147中度或高表达者总体5年生存率为36%,CD147阴性或低表达者总体5年生存率为80%。CD147中度或高表达者术后生存时间明显低于CD147阴性或低表达者,差异有统计学意义(Log-rank=24.130,P<0.01)。见图5。

图4 108例膀胱尿路上皮癌患者生存曲线
2.4.2单因素生存分析 单因素生存分析结果表明,肿瘤临床分期、病理分级、淋巴结转移、肿瘤大小和CD147表达状态是影响胱尿路上皮癌患者预后的重要因素(P<0.05),见表2。
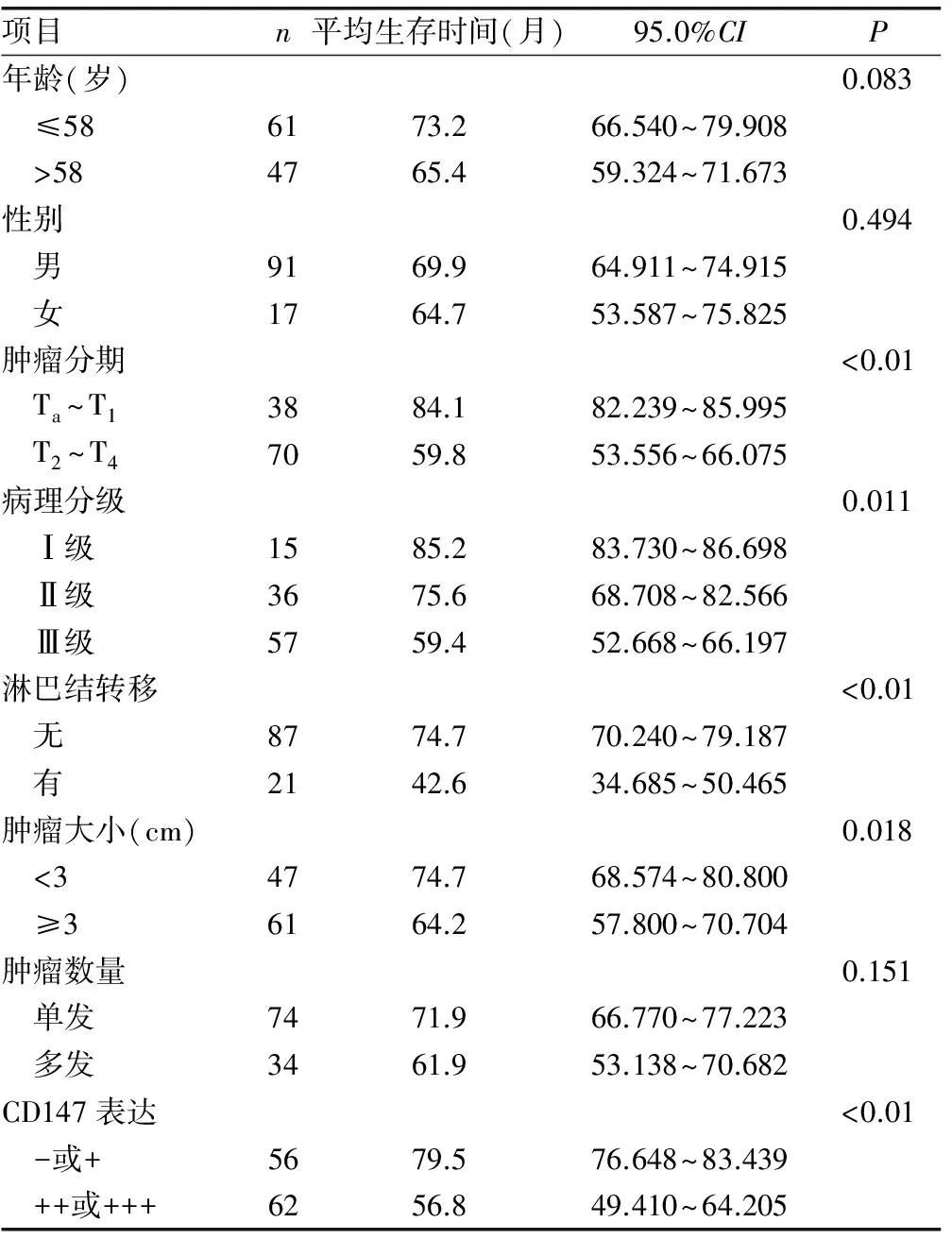
表2 108例膀胱尿路上皮癌患者生存预后的单因素分析(Log-rank检验)
2.4.3多因素生存分析 将肿瘤临床分期、病理分级、淋巴结转移、肿瘤大小和CD147表达状态等单因素分析中发现有预后意义的因素选入COX多因素风险比例模型,经检验发现,肿瘤临床分期(P=0.014)、病理分级(P=0.039)、淋巴结转移(P=0.001)和CD147表达状态(P=0.003)是影响膀胱尿路上皮癌患者预后的独立因素,见表3。

表3 108例膀胱尿路上皮癌患者生存预后的COX多因素生存分析结果
3 讨 论
在我国,膀胱尿路上皮癌是泌尿系统最常见的恶性肿瘤,其生物学行为复杂多变。尽管肿瘤的临床分期、病理分级在评价患者的预后中起重要作用,但这些指标尚不能完全反映该肿瘤的生物学特性。CD147是一种新的细胞表面黏附分子,属于免疫球蛋白超家族成员,分子量约为58×103,是一种单链跨膜糖蛋白。CD147主要参与细胞与细胞或细胞与基质之间的相互作用,刺激肿瘤相关的基质成纤维细胞或内皮细胞分泌产生MMPs,CD147也可作用于邻近的肿瘤细胞,相互诱导以促进MMPs释放并降解基质[1-2],从而促进恶性肿瘤的进展。此外,Tang等[7]研究表明CD147还可通过诱导血管内皮生长因子(VEGF)的表达而促进肿瘤新生血管的形成。
众多研究证实,CD147在正常组织中无表达或表达极少,而在胆囊癌、肝癌、前列腺癌、宫颈癌等多种肿瘤组织中均存在高表达,而且其表达水平与肿瘤的侵袭和转移密切相关[8-11]。到目前为止,已有研究就CD147在膀胱尿路上皮癌组织中的表达情况进行了探讨,但研究结果不尽一致,分析其原因可能与样本量小、实验过程中易产生误差等因素有关。陈清标等[3]等应用免疫组织化学法检测58例膀胱尿路上皮癌组织中CD147的表达情况,结果显示CD147表达与肿瘤病理分级、临床分期呈正相关,即临床分期越晚,病理分化越差,CD147阳性表达率愈高。韩金利等[4]等应用免疫组织化学法对45例膀胱尿路上皮癌组织研究发现,CD147表达与肿瘤病理分级相关,而与临床病理分期无明显相关性。但是,他们的研究由于缺乏随访资料,未能对CD147与膀胱尿路上皮癌患者的预后进行探讨。所以,关于CD147在膀胱尿路上皮癌组织中表达的临床意义值得继续深入研究。
本研究中,mRNA和蛋白水平上检测了20例膀胱尿路上皮癌组织中CD147的表达情况,RT-PCR和Western blot结果表明,肿瘤组织中CD147表达明显高于相应的癌旁组织,差异有统计学意义(P<0.01)。另外,本研究应用可靠性、可重复性好的组织芯片和免疫组织化学技术,检测了CD147在108例膀胱尿路上皮癌组织和20例正常膀胱黏膜组织中的表达情况。结果表明,膀胱尿路上皮癌组织中CD147蛋白阳性表达率达73.1%(79/108),正常膀胱黏膜上皮仅1例有弱阳性表达,这一结果提示CD147蛋白在膀胱尿路上皮癌中呈高表达,其表达可能与膀胱癌的发生相关。研究还发现CD147表达与膀胱癌的肿瘤大小、临床分期、病理分级及淋巴结转移相关;其中,肿瘤大于或等于3 cm患者中CD147表达明显高于肿瘤小于3 cm的患者;临床分期高、病理分级低的患者中CD147表达明显增强;同时,CD147在淋巴结转移患者中的表达明显高于无淋巴结转移患者中的表达;以上结果提示CD147表达可能与膀胱癌细胞的增殖及侵袭能力有关,其高表达可能有助于膀胱癌细胞的增殖及侵袭,这与陈清标等[3]、韩金利等[4]的报道较为一致。此外,在其他肿瘤中也均有报道称CD147表达与肿瘤的侵袭和转移相关[8-11]。
此外,在本研究探讨了CD147表达与膀胱癌患者预后的关系,结果显示CD147中度表达或高表达患者的术后生存时间明显低于CD147阴性或低表达患者,提示CD147表达与患者的预后相关,其高表达患者预后不良。同时,COX多因素生存分析表明CD147表达、肿瘤临床分期、病理分级及淋巴结转移可作为影响膀胱癌患者预后的独立因素。因此,本研究结果表明CD147表达的检测可能有助于膀胱癌患者的预后评估。
目前,关于CD147在膀胱癌中的作用机制尚不明确。其中,研究发现CD147可刺激成纤维细胞或内皮细胞分泌产生MMPs降解基质,并诱导VEGF的表达,从而促进肿瘤的发生。此外,有研究报道称CD147可作为亲环素A的细胞表面信号受体,参与细胞的增殖过程[12-13],也可通过干扰NO/cGMP介导的Ca2+内流来调控肿瘤细胞的转移潜能[14],而Ca2+是几条信号途径的共同调节点,参与多种肿瘤的浸润和转移,并影响患者的预后[15]。在本研究中,CD147的表达与膀胱癌的发生相关,其表达与膀胱癌患者的临床分期、淋巴结转移及预后相关,提示CD147高表达可能有助于膀胱癌的发生、膀胱癌细胞的增殖及侵袭,影响患者的预后。为此,结合上述文献报道,推测其作用机制可能与MMPs、VEGF及NO/cGMP介导的Ca2+通路相关,但仍有待于后续研究证实。
总之,本研究结果提示CD147蛋白有望成为一种新的判断膀胱尿路上皮癌患者预后的分子生物学指标;同时,本研究有可能为膀胱尿路上皮癌的分子靶向治疗提供新的靶点和思路。
[1]Kanekura T,Chen X,Kanzaki T.Basigin(CD147)is expressed on melanoma cells and induces tumor cell invasion by stimulating production of matrix metalloproteinases by fibroblasts[J].Int J Cancer,2002,99(4):520-528.
[2]Sun J,Hemler ME.Regulation of MMP-1 and MMP-2 production through CD147/extracellular matrix metalloproteinase inducer interactions[J].Cancer Res,2001,61(5):2276-2281.
[3]陈清标,毕学成,何慧婵,等.CD147蛋白在膀胱癌组织中特异性表达的临床研究[EB/OL].中华临床医师杂志:电子版,2010,4(3):273-277.
[4]韩金利,谢文练,黄健,等.人膀胱癌组织中细胞外基质金属蛋白酶诱导因子的表达[J].癌症,2003,22(11):1158-1161.
[5]Hidalgo A,Pia P,Guerrero G,et al.A simple method for the construction of small format tissue arrays[J].J Clin Pathol,2003,56(2):144-146.
[6]Reimers N,Zafrakas K,Assmann V,et al.Expression of extracellular matrix metalloproteases inducer on micrometastatic and primary mammary carcinoma cells[J].Clin Cancer Res,2004,10(10):3422-3428.
[7]Tang Y,Nakada MT,Kesavan P,et al.Extracellular matrix metalloproteinase inducer stimulates tumor angiogenesis by elevating vascular endothelial cell growth factor and matrix metalloproteinases[J].Cancer Res,2005,65(8):3193-3199.
[8]Michele C,Madigan A,Kingsley J,et al.The role of extracellular matrix metalloproteinase inducer protein in prostate cancer progression[J].Cancer Immunol Immunother,2008,57(9):1367-1379.
[9]Wu W,Wang R,Liu H,et al.Prediction of prognosis in gallbladder carcinoma by CD147 and MMP-2 immunohistochemistry[J].Med Oncol,2009,26(2):117-123.
[10]Li HG,Xie DR,Shen XM,et al.Clinicopathological significance of expression of paxillin,syndecan-1 and EMMPRIN in hepatocellular carcinoma[J].World J Gastroenterol,2005,11(10):1445-1451.
[11]Sier CF,Zuidwijk K,Zijlmans HJ,et al.EMMPRIN-induced MMP-2 activation cascade in human cervical squamous cell carcinoma[J].Int J Cancer,2006,118(12):2991-2998.
[12]Xu D,Hemler ME.Metabolic activation-related CD147-CD98 complex[J].Mol Cell Proteomics,2005,4(8):1061-1071.
[13]Li M,Zhai Q,Bharadwaj U,et al.Cyclophilin a is overexpressed in human pancreatic cancer cells and stimulates cell proliferation through CD147[J].Cancer,2006,106(10):2284-2294.
[14]Miuawrodriquez F,Chechile-Tomiolo G,Salvador-Bayarri J,et al.Multivariate analysis of the prognostic factors of primary superficial bladder cancer[J].J Urol,2000,163(1):73-78.
[15]Jiang JL,Zhou Q,Yu MK,et al.The involvement of HAb18G/CD147 in regulation of store-operated Calcium entry and metastasis of human hepatoma cells[J].J Biol Chem,2001,276(50):46870-46877.

