以羟丙基-β-环糊精及聚乙二醇为基质的硝苯地平骨架缓释片的制备及特性
姜升阳,赵 朋,#,杨骏宇,姜东林△
(1.南通大学第三附属医院心内科,江苏无锡 214041;2.江南大学药学院,江苏无锡 214122)
硝苯地平(nifedipine,NP)是临床治疗心血管疾病的一线药[1],属于二氢吡啶类钙离子通道拮抗剂,口服后在胃肠道快速吸收,但是由于其显著的肝脏首过效应和较短的体内半衰期,每天须服药2~3次,生物利用度降低,引起血药浓度波动,引发头痛、面部潮红和心率加速等不良反应[2-4]。因而如何提高NP的生物利用度,减少血药浓度波动,降低不良反应从而改善NP的治疗效果,是NP口服剂型研究的目标。本研究拟配制NP的羟丙基-β-环糊精(hydroxypropyl-beta-cyclodextrin,HPC)包合物,通过直接压片法制备以HPC和聚乙二醇(polyethylene glycol,PEG)为基质的NP骨架缓释片,研究其对NP的缓释性能及药物代谢动力学特征。
1 材料与方法
1.1 仪器与试剂 紫外可见光分光光度计(Jasco v-570,日本华洋科仪公司);高效液相色谱系统(Agilent 1200,安捷伦科技有限公司);冷冻干燥机(Labconco plus 12,美国Labconco公司);实验型压片机(YP-1400,上海顺仪科技公司);药物溶出仪(Hanson Research SR8-Plus,美国Hanson公司);Promosil C18色谱柱(PM551505-0,苏州莱顿科学仪器有限公司)。HPC(Mw 1540,10 g,上海西格玛奥德里奇贸易有限公司);NP(批号100338-201001,纯度99.9%,100 mg,中国食品药品检定研究院);PEG(Mw 4000,上海梯希爱化成工业发展有限公司);NP胶囊(含20 mg NP粉末,囊材为明胶)由本院制剂室提供;成年新西兰大白兔[苏州大学实验动物中心,实验动物合格证号:SYXK(苏)2007-0035]单独饲养于(23±3)℃、相对湿度(55±5)%,12 h明暗交替环境中。
1.2 方法
1.2.1 HPC对NP的相溶解度测定 相溶解度测定依据Higuchi等[5]报道的方法进行:将过量NP溶解至含有0.05 M KCl和不同浓度HPC的磷酸盐缓冲液(pH5.8)中,25 ℃震荡水浴2 d,使NP溶解度达平衡态,整个实验过程在暗室中进行,以避免NP变性。离心分离溶液,测定其在λ = 350 nm条件下的吸光度,计算NP浓度,绘制NP随HPC浓度升高的相溶解度图,判断包合常数。
1.2.2 以HPC和PEG为基质的NP骨架缓释片的制备 以所测定的包合常数为质量比,称取NP粉末和HPC,将NP加至HPC的溶液中,25 ℃震荡水浴2 d使NP完全溶解,冷冻干燥后,获取NP和HPC包合物粉末。将PEG碾磨、过筛(孔径400 μm)后获得PEG细粉,继按表1所示处方组成各组药物,选用直径为10 mm平冲头,以单冲YP-1400实验型压片机采用直接压片法制备NP骨架缓释片、NP-PEG片和NP-HPC片(单片质量200 mg,NP的质量百分数为20%)。
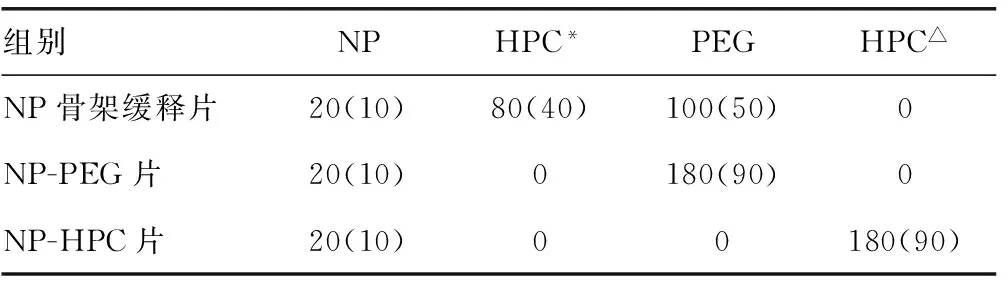
表1 不同处方组成NP片剂的单片组分质量 及百分含量比较[mg(%)]
*:存在于NP-HPC包合物中的复合HPC;△:游离HPC。
1.2.3 体外释放试验 采用Hanson Research SR8-Plus药物溶出仪以50 rpm搅拌,以浆法在(37.0±0.5)℃下释放,测定各种NP片剂的体外释放度,释放溶液为500 mL人工胃液(pH=1.2)/肠液(pH=7.6)。
1.2.4 动物实验及血药浓度测定 将20只雄性新西兰大白兔(体质量2.5~3.0 kg,南通大学第三附属医院实验动物伦理学委员会批准)分为NP骨架缓释片组、NP-PEG片组、NP-HPC片组和NP胶囊组,每组5只。实验动物于实验前保持饮水充分,禁食24 h后采取灌胃法给药,按组分别给予NP骨架缓释片、NP-PEG片、NP-HPC片及NP胶囊,NP剂量均为20 mg。于灌胃结束后开始计时,分别于给药后0.5、1、2、3、4、5、7、9 h和12 h采集各组兔耳静脉血。体内药物浓度分析按范国荣等[6]所述方法进行:在0.5 mL兔血浆中加入0.1 mL 0.1 M NaOH溶液和5.0 mL乙酸乙酯-正己烷(3∶2)溶液,混匀后3 500 r/min离心5 min,吸取上层有机相,35 ℃水浴中连接氮气干燥,残留物用100 μL流动相涡旋振摇溶解,取50 μL进样分析(以上所有操作均在避光条件下进行)。NP定量采用色谱峰面积测定法,血浆NP浓度测定则采用外标法,色谱条件:Promosil C18色谱柱(5 μm,4.6 mm×150 mm);流动相为甲醇∶水(65∶35,含磷酸二氢钠缓冲溶液4 mmol/L);紫外检测波长为350 nm;室温条件;流速1.0 mL/min。

2 结 果
2.1 NP在HPC作用下的相溶解度及包合常数 依据吸光度分析获得HPC和NP的相溶解度图,NP的表观溶解度随着HPC浓度的增加而线性增加,符合Higuchi等[5]确立的相溶解度线图AL模型,显示NP与HPC按摩尔比1∶1形成包合复合物,因而在NP骨架缓释片的制备试验中采用摩尔比1∶1制备NP与HPC的包合物,见图1。
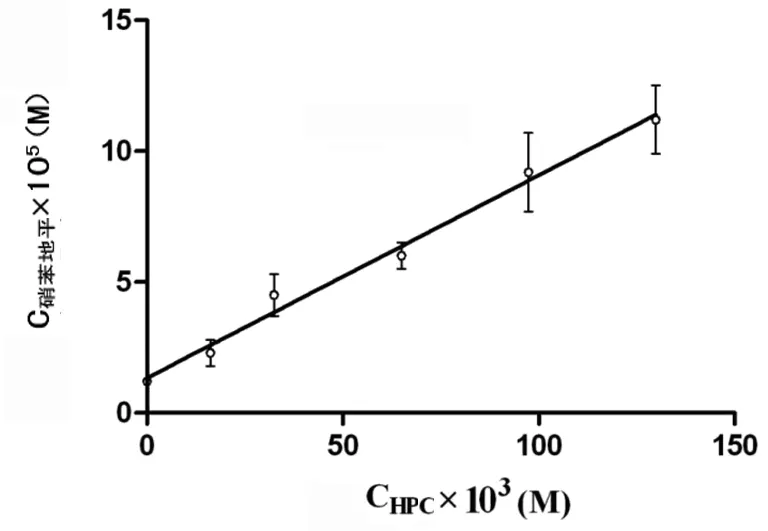
图1 HPC对NP的相溶解度(R2=0.989 5)
2.2 NP骨架缓释片在模拟胃/肠液环境中的释放 在模拟胃液(pH 1.2)中测得3种NP剂型释放曲线,NP-PEG片剂中NP在0.5 h时累计释放率即达到85.6%,于1 h近于完全释放;NP-HPC片剂中NP累积释放率达到80%的时间为5 h,此后随着片剂中NP含量降低,释放速率下降,与NP-PEG片剂相比,NP-HPC片剂缓释效应明显增强,而NP骨架缓释片在5 h时的累积释放率仅为36.4%,其释放曲线接近于零级释放曲线,显著低于NP-HPC片剂(P<0.05)。在模拟肠液(pH 7.6)的环境中,NP-PEG片完全释放的时间为7 h,在前1 h内,NP-HPC片和NP骨架缓释片的释放度差异无统计学意义(P>0.05),而在2~12 h的释放区间各识相点,NP骨架缓释片的释放度低于NP-HPC片的释放度(均P<0.05)。见图2。

*:P<0.05,与相同时间点NP-PEG片组比较;△:P<0.05,与相同时间点NP-HPC片组比较。
图2 不同剂型NP在模拟胃/肠液环境中的释放曲线(n=5)

*:P<0.05,与NP骨架缓释片组比较。
图3 不同剂型NP体内药物动力学曲线(n=5)
2.3 NP骨架缓释片体内药物动力学曲线 给新西兰大白兔喂服不同剂型NP后,测得体内药物动力学参数(表2),并绘制药物动力学曲线(图3),数据显示NP-骨架缓释片组的AUC0-12、Cmax及tmax均显著高于NP-HPC片组、NP-PEG片组及NP胶囊组(均P<0.01或<0.05)。

表2 各组药时曲线下面积(AUC0-12)、最高血药浓度 (Cmax)和时间(tmax)比较
*:P<0.01,与NP胶囊组比较;△:P<0.05,与NP-PEG片组和NP-HPC片组比较。
3 讨 论
NP目前广泛应用于高血压及稳定型冠心病的临床治疗[1,7],其缓释剂型能够延长NP体内释放时间,维持平稳的血药浓度。目前人们已探讨了多种NP缓释剂型,其中,高分子骨架缓释片制备方法简单易行,工艺参数易于调控,目前已得到了广泛的应用[8-9]。有研究表明,以丙烯酸树脂为基质,并以湿法制粒工艺制备NP骨架缓释片,其硬度优良,缓释性能符合美国药典要求[10],而以硬脂酸和乙基纤维素为基质的骨架型和膜控型缓释微丸对NP同样具有缓释作用[11]。
本研究选择HPC与PEG作为骨架缓释片的基质,PEG分子能够增加NP的溶解度,而HPC的溶胀效应能够延缓NP的释放过程,故作者将NP与HPC配制形成包含物后与PEG混合,继而直接压片获得NP骨架缓释片,并测定其体外药物缓释作用以及在新西兰大白兔体内的药代动力学参数。结果发现,NP的表观溶解度随着HPC浓度的增加而线性增加,符合Higuchi等[5]确立的相溶解度线图AL模型,故在NP骨架缓释片的制备试验中NP与HPC可采用摩尔比1∶1制备包合物,而NP骨架缓释片在模拟胃液(pH 1.2)试验中的5 h累积释放率仅为36.4%,其缓释效应明显强于NP-HPC片组(80%)及NP-PEG片组(100%)。在模拟肠液(pH 7.6)的释放体系中,释放初期,NP骨架缓释片与NP-HPC片的释放度无差异,但随着释放时间的增加,NP骨架缓释片的释放度与NP-HPC片组比较显著降低,缓释效应更加显著。这主要是由于NP与HPC形成包合物,HPC的疏水作用也参与了NP的缓释过程,而作为对照的NP-HPC片中,因HPC与NP未形成包合物,NP的释放主要依靠HPC的溶胀作用,故其NP的缓释效应较弱,这一机制有别于羟丙基甲基纤维素缓释制剂的药物释放机制[12-13],而包合物在模拟肠液中的稳定性强于模拟胃液。在动物实验中,NP骨架缓释片组的AUC0-12、Cmax及tmax均显著高于NP-HPC片组、NP-PEG片组及NP胶囊组(均P<0.01或<0.05),说明NP骨架缓释片的缓释作用能够增加NP的血药浓度,增加药时曲线下面积,延长NP作用时间,能够显著提高NP的生物利用度。
综上所述,本研究的NP缓释片剂制备,工艺简单,缓释效果理想,临床上可对该缓释片作用机制及安全性作进一步探讨,为患者提供更多的临床NP剂型用药选择。
[1]Derosa G,Maffioli P.Nifedipine and telmisartan for the treatment of hypertension:the TALENT study[J].Expert Rev Cardiovasc Ther,2011,9(12):1499-1503.
[2]Magee LA,Dadelszen P.The management of severe hypertension[J].Semin Perinatol,2009,33(3):138-142.
[3]纪文娟,李成建,张慧.硝苯地平不良反应[J].中国误诊学杂志,2010,10(6):1494-1495.
[4]Chan LW,Sahota DS,Yeung SY,et al.Side-effect and vital sign profile of nifedipine as a tocolytic for preterm labour[J].Hong Kong Med J,2008,14(4):267-272.
[5]Higuchi T,Connors KA.Phase-solubility techniques[J].Adv Anal Chem Instr,1965,4(2):117-212.
[6]范国荣,胡晋红,林梅,等.国产硝苯地平速释胶囊在健康人体内的药代动力学[J].药学服务与研究,2001,1(1):25-27.
[7]Lundy A,Lutfi N,Beckey C.Review of nifedipine GITS in the treatment of high risk patients with coronary artery disease and hypertension[J].Vasc Health Risk Manag,2009,5(1):429-440.
[8]Tsutamoto T,Tsutsui T,Maeda K,et al.Effects of long-acting calcium channel antagonists on neurohumoral factors:comparison of nifedipine coat-core with amlodipine[J].J Cardiovasc Pharmacol,2003,41 Suppl 1:S77-81.
[9]Lutz D,Pabst G,Dahmen W,et al.Bioavailability of new nifedipine preparations in man.1.Pharmacokinetics of nifedipine in the form of sustained-release tablets[J].Arzneimittelforschung,1985,35(12):1840-1842.
[10]柴佩华,邓怡萱,丁宇.丙烯酸树脂水分散体在制备硝苯地平骨架缓释片中的应用[J].中国医药工业杂志,2010,41(8):591-594.
[11]余裕炳,涂家生.硝苯地平骨架型和膜控型缓释微丸的制备及比较[J].药学与临床研究,2010,18(3):235-238.
[12]Ishikawa T,Watanabe Y,Takayama K,et al.Effect of hydroxypropylmethylcellulose (HPMC) on the release profiles and bioavailability of a poorly water-soluble drug from tablets prepared using macrogol and HPMC[J].Int J Pharm,2000,202(1/2):173-178.
[13]Yan G,Li H,Zhang R,et al.Preparation and evaluation of a sustained-release formulation of nifedipine HPMC tablets[J].Drug Dev Ind Pharm,2000,26(6):681-686.

