美洲大蠊提取物对肝纤维化大鼠NF-κB和α-SMA表达的影响*
刘丽辉,李 武,马得宏,陈一晖,王宏图,张 禄,徐雪美,冉慧粉
(昆明医科大学第一附属医院感染科,昆明 650032)
在前期研究中,本课题组采用四氯化碳复制小鼠肝纤维化模型,结果表明,美洲大蠊提取物(APA)对小鼠实验性肝纤维化具有一定的保护作用,能够明显改善小鼠受损肝脏的病理形态,降低肝纤维化程度[1]。为了进一步研究APA对肝纤维化的治疗作用,本研究改用大鼠作为肝纤维化模型,观察APA对四氯化碳所致大鼠肝纤维化模型是否同样有治疗作用,并探讨其抗纤维化的机制是否与其抑制大鼠肝纤维化组织中核转录因子-κB(NF-κB)和α-平滑肌肌动蛋白(α-SMA)的表达有关。
1 材料与方法
1.1 实验动物 SPF级SD雄性大鼠40只,胎龄5~6周,体质量120~150 g,由昆明医科大学动物科提供。实验过程中饲养条件相同,而且定期清洁、消毒。动物合格证号:SCXK(滇)2011-0004。40只大鼠分成4组,即正常对照组、模型组、APA组和三七丹参组。造模当日即开始灌胃,每天1次,连续7周,直至动物处死。正常对照组和模型组动物按20 mL/kg体质量蒸馏水灌胃,三七丹参组按20 mL/kg体质量灌胃,用量为1 g/kg; APA组给予2.5%原药20 mL/g体质量灌胃(0.5 g/kg,相当于临床60 kg成人每日用量的50倍)。20%四氯化碳橄榄油溶液按5 mL/kg给大鼠颈背部皮下注射,每周2次,连续7周。正常对照组动物仅皮下注射相同剂量的橄榄油溶液。
1.2 试剂 四氯化碳(分析纯)由昆明泽浩科技有限公司提供,商品编号:1017499。橄榄油(化学纯),由昆明泽浩科技有限公司提供,商品编号:GC1270。NF-κB、α-SMA免疫组化试剂盒由美国Santa Cruz公司提供。Masson试剂盒由福州迈新生物有限公司提供。APA(肝龙)原药由昆明赛诺制药有限公司提供,批号:03122001。三七丹参片由昆明医科大学第一附属医院制剂室提供,批号:20120513,每片0.33 g(含生药0.26 g)。
1.3 方法
1.3.1 标本采集与观察指标 观察动物的体质量、食欲、精神状况。第7周末,先用乙醚吸入麻醉,立即剖开腹部,找到腹主动脉,用止血钳夹闭腹主动脉的近心端,用采血针后接针筒轻轻平行插入腹主动脉近心端,放开止血钳,抽吸针筒,血液即流入针筒内,将血液迅速转移到加有抗凝剂的离心管中。立即取肝脏左叶中部、左叶及右上叶前部,进行组织病理及免疫组织化学检查。采用全自动生化分析仪测定丙氨酸氨基转移酶(ALT)、天门冬氨酸氨基转移酶(AST)、清蛋白(Alb)。
1.3.2 病理组织学检查 石蜡包埋肝脏组织、切片,进行HE和Masson染色,光镜下观察切片,按高志良标准进行GS分级(G为炎性活动度,S为纤维化程度)。
1.3.3 免疫组织化学法检查 石蜡包埋肝组织,常规切片,放入55 ℃烤箱中3 h以上,取出切片进行脱蜡,用蒸馏水冲洗切片3~5次,用修复液修复,滴加NF-κB和α-SMA一抗(NF-κB和α-SMA按1∶100的浓度进行稀释),放入4 ℃冰箱中过夜,然后滴加二抗,放入温箱内30 min,再进行染色,树胶封片。采用彩色病理图文报告分析系统在光镜下(×200)计算阳性染色面积,即每个视野棕黄色阳性面积占视野总面积百分比(%)的方法来表示。

2 结 果
2.1 大鼠一般情况 正常对照组处死前状态良好,体质量均大于模型组。模型组大鼠出现饮食减少、尿黄、皮毛粗糙无光泽、乏力、纳差、便溏。模型组和APA组大鼠实验过程中各死亡1只。
2.2 APA对实验性肝纤维化大鼠肝功能的影响 与模型组相比,APA和三七丹参均能显著改善大鼠的肝功能,且APA组疗效优于三七丹参组(P<0.01),但是APA组与三七丹参组的Alb水平差异无统计学意义(P>0.05),见表1。
2.3 解剖及病理形态学表现 解剖发现模型组大鼠肝脏肿大,质硬,颜色灰暗,表面出现小颗粒状结节,而其余3组大鼠肝脏颜色较模型组红润,边缘规则。HE和Masson染色结果见图1。正常对照组大鼠肝小叶结构完整,肝索排列整齐,无肝细胞变性坏死及纤维组织增生(图1A及图1E)。模型组大鼠肝细胞大量脂肪变性,弥漫性点状坏死及可见部分灶状坏死,汇管区有大量炎性细胞浸润,胶原纤维大量增生并形成假小叶(见图1B及图1F)。APA组和三七丹参组肝细胞变性坏死减轻,弥漫性点状坏死、胶原纤维增生减少,肝纤维化程度降低(见图1C、1D、1G、1H)。

表1 APA对实验性肝纤维化大鼠肝功能的影响
△:P<0.01,与正常对照组比较;▲:P<0.01,与模型组比较;◆:P<0.01,与APA组比较。
2.4 大鼠肝脏GS分级 等级资料采用秩和检验和Ridit分析,结果显示,APA组和三七丹参组与模型组相比,大鼠肝组织炎性活动度分级及肝纤维化分期差异均有统计学意义(P<0.01),而APA组与三七丹参组比较,大鼠肝脏炎性活动度分级及肝纤维化分期差异均无统计学意义(P>0.05),见表2。

表2 各组大鼠炎性活动度分级及肝纤维化分期(n)
△:P<0.01,与正常对照组比较;▲:P<0.01,与模型组比较。
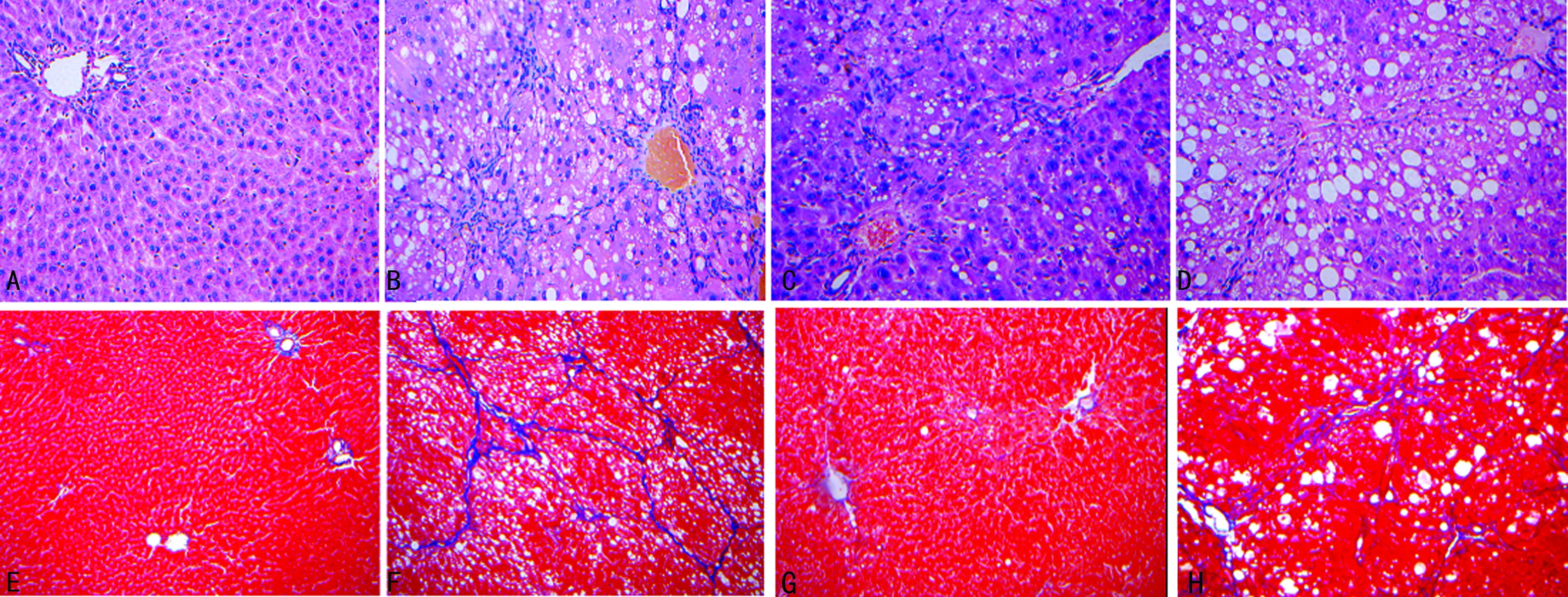
A:正常对照组(×200);B:模型对照组(×200);C:APA组(×200);D:三七丹参组(×200);E:正常对照组(×100);F:模型对照组(×100);G:APA组(×100);H:三七丹参组(×100)。
图1 各组大鼠肝组织HE(×200)及Masson(×100)染色结果
2.5 免疫组织化学检测结果 NF-κB和α-SMA在正常肝组织的所有细胞中均微量表达。NF-κB主要分布在细胞核内及部分胞质,而α-SMA主要在肝细胞的胞质中表达。镜下观察模型组大鼠肝组织中NF-κB和α-SMA蛋白表达广泛,其阳性染色面积均高于正常对照组、APA组和三七丹参组(P<0.01),且呈现深棕黄色。而APA组与三七丹参组比较,NF-κB蛋白阳性染色面积表达差异无统计学意义(P>0.05),α-SMA蛋白阳性染色面积表达差异有统计学意义(P<0.01),见表3。
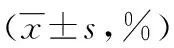
表3 各组大鼠肝组织中NF-κB和α-SMA阳性表达 面积的比较
△:P<0.01,与正常对照组比较;▲:P<0.01,与模型组比较。
3 讨 论
肝纤维化是多种因素作用的结果,越来越多的国内外学者认为肝纤维化主要是由于多种细胞因子激活肝星状细胞,导致细胞外基质的沉积和降解减少。本实验主要观察了NF-κB和α-SMA两个因子在肝脏中的表达情况,并探讨APA抗大鼠实验性肝纤维化的作用机制。
NF-κB是众多细胞因子和炎性介质表达的主要转录因子,是多种信号转导途径的汇聚点[2]。NF-κB蛋白正常情况下与IκBa结合存在于肝脏多种细胞的细胞质中,当NF-κB受到一些反式信号通路激活时(主要是IκB激酶),它可以使IκBa蛋白泛素化和降解,导致NF-κB激活并向细胞核移位,从而导致肝星状细胞(HSC)活化并呈现NF-κB的核转位活性[3]。活化的HSC内NF-κB活性增强,导致肿瘤坏死因子-α(TNF-α)、白细胞介素-6(IL-6)、细胞间黏附分子(ICAM)-1、转化生长因子(TGF)-β1等NF-κB下游致炎因子表达增强,放大了肝脏炎性损伤反应[4]。长时间的炎性反应导致肝脏的纤维化。
α-SMA被视为肝纤维化的一个很好的标志物,有研究表明氧化应激在HSC活化过程中起了重要的作用,可以刺激HSC活化并转化为α-SMA阳性的成纤维细胞[5]。此外,虽然α-SMA也可以由其他类型的细胞来表达,但是α-SMA被称为HSC活化的一个可靠标志[6]。HSC在正常情况下是静态的,它的激活使过量的胶原蛋白沉积在肝脏而导致肝纤维化[7]。
本实验病理形态学和血液生化检查结果表明,APA能显著降低肝纤维化分期程度和改善肝功能,对四氯化碳所致的大鼠肝纤维化有一定的防治作用。本研究尚发现NF-κB和α-SMA在模型组中高度表达,而在APA组和三七丹参组中表达相对较少,即纤维化程度越高,NF-κB和α-SMA表达水平相对较高。由此可以推断APA抗纤维化作用可能与其可以降低肝纤维化组织中NF-κB和α-SMA的表达水平有关。进一步深入研究APA与肝纤维化的关系及其潜在的机制具有深远意义,将为治疗肝纤维化药物开拓新的道路。
[1]李武,段丽芳,何贵清,等.不同剂量美洲大蠊提取物抗小鼠实验性肝纤维化的研究[J].中华肝脏病杂志,2009,17(12):948-951.
[2]张彩华,姜妙娜,李寒妹,等.肝复康对肝纤维化大鼠肝组织NF-κB、MMP-2和TIMP-2表达的影响[J].临床肝胆病杂志,2011,14(3):169-172.
[3]Watson MR,Wallace K,Gieling RG,et al.NF-kappaB is a critical regulator of the survival of rodent and human hepatic myofibroblasts[J].J Hepatol,2008,48(4):589-597.
[4]周宇,陈科全,叶石才,等.核因子-κBp65反义寡核苷酸对肝纤维化作用的实验研究[J].中华肝脏病杂志,2009,29(4):254-257.
[5]张志勇,金武丕,许晓俊.核转录因子-κB与酒精性肝病的研究进展[J].临床肝胆病杂志,2010,26(3):269-271.
[6]Leung TM,Fung ML,Liong EC et al.Role of nitric oxide in the regulation of fibrogenic factors in experimental liver fibrosis in mice[J].Histol Histopathol,2011,26(2):201-211.
[7]Wu LM,Wu XX,Sun Y,et al.A novel synthetic oleanolic acid derivative(CPU-II2) attenuates liver fibrosis in mice through regulating the function of hepatic stellate cells[J].J Biomed Sci,2008,15(2):251-259.

