肝衰竭患者血清免疫球蛋白检验的临床意义
陈文惠
肝衰竭患者血清免疫球蛋白检验的临床意义
陈文惠
目的探讨慢性乙型肝炎肝衰竭患者血清免疫球蛋白变化及其临床意义。方法采取免疫比浊法对慢性乙型肝炎肝衰竭患者(肝衰竭组)进行血清免疫球蛋白IgG、IgM、IgA检测,同时与血清总胆红素(TBiL)、凝血酶原活动度(PTA)、白蛋白(ALB),进行对比研究,分析其关联因素;并与慢性乙型肝炎(轻度)患者(对照组)对比研究。结果两组患者免疫球蛋白数值与病情程度成正相关,病情愈重,免疫球蛋白升高愈明显,与PTA、TBiL、ALB变化比较具有相似的临床意义。结论乙型肝炎患者血清免疫球蛋白水平变化能直接反映肝细胞受损程度,对患者预后评估与TBiL、PTA、ALB具有相同临床意义。
乙型肝炎;肝衰竭;免疫球蛋白
肝脏是人体最大的腺体,也是主要的内分泌器官之一,参与糖、脂肪、蛋白质、维生素、水盐及矿物质代谢;也是药物氧化、还原、水解反应的主要场所,许多酶类物质、白蛋白、总胆红素、凝血因子、激素、补体等物质由肝脏合成、代谢和灭活;肝脏也是人体最大的免疫器官,参与细胞免疫及体液免疫调节。本研究通过对慢性乙型肝炎、乙肝肝衰竭患者免疫球蛋白测定,探讨其临床意义,报告如下。
资料与方法
一、一般资料
选取我院2008年1月至2012年12月间慢性乙型肝炎肝衰竭(慢加急型)患者50例(简称肝衰竭组),门诊慢性乙型肝炎患者(轻度)50例(简称对照组)作为研究对象。肝衰竭组男性37例,女性13例,年龄18~70岁,平均年龄43.4岁;对照组男性39例,女性11例,年龄19~75岁,平均年龄39.7岁,二组在性别、年龄均无明显差异(P>0.05),具有可比性。
二、检验方法
1.标本采集
所有患者清晨空腹12 h,无菌条件采静脉血液5 mL,要求生化抗凝试管,采集后30 min内送检验室。肝衰竭组采血标本时间均在疾病进展期(7~15 d),对照组在任意时间内。
2.仪器、试剂与方法
仪器使用罗氏诊断MODULAR DPP型全自动生化分析仪;免疫球蛋白、总胆红素试剂盒由罗氏(上海)有限公司提供,免疫球蛋白采用免疫比浊法测定,总胆红素采用重氮比色法测定;PTA使用希森美康公司生产的CA-7000自动凝血分析仪,试剂盒由希森美康医用电子(上海)有限公司提供,采用凝固法测定。
三、统计学处理
应用SPSS14.0统计软件对数据进行处理分析,计量资料以x±s表示,组间比较采用配对t检验,以P<0.05为差异有统计学意义。
结果
一、二组患者检验结果
肝衰竭组免疫球蛋白水平、TBiL较对照组明显升高,ALB较对照组明显降低,P<0.01,具有统计学差异,见表1。
二、肝衰竭组不同阶段免疫球蛋白及TBiL、PTA、ALB比较
肝衰竭组在发病不同时期,TBiL、PTA、ALB、免疫球蛋白水平均随病情变化而变化,组间比较有明显差异,P<0.05,具有统计学意义,见表2。
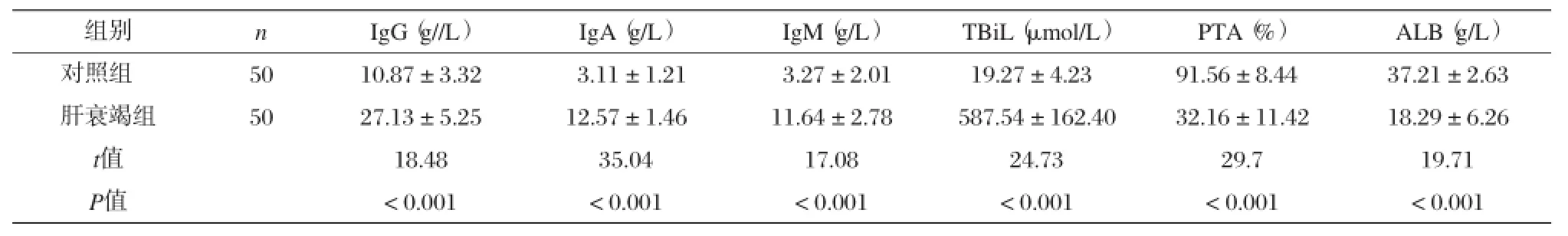
表1 2组患者免疫球蛋白、TBiL、PTA、ALB变化比较(x±s)
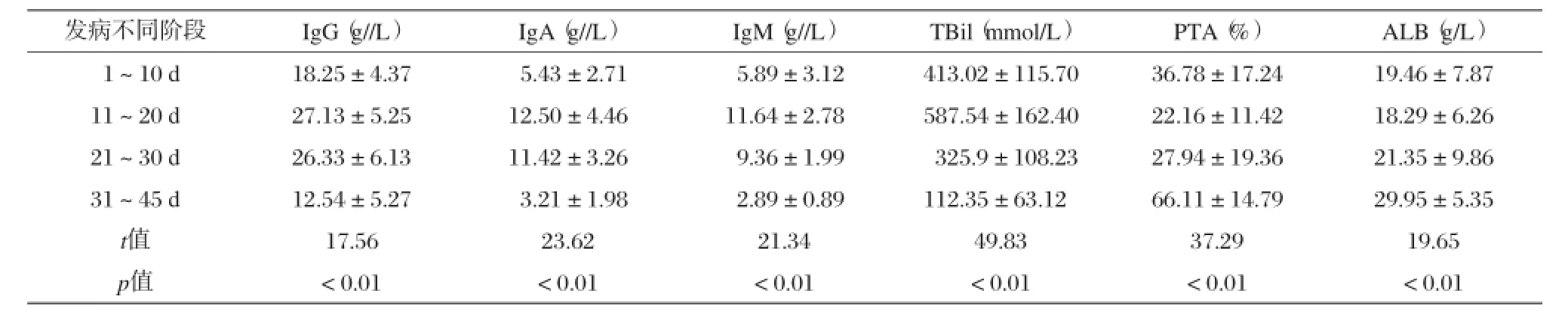
表2 肝衰竭组不同时期免疫球蛋白及TBiL、PTA、ALB比较(x±s)
讨论
肝衰竭诊断标准临床上实验室指标主要以TBil、PTA、ALB变化为依据,一般来说TBil>正常10倍、PTA<40%、ALB<32 g/L为实验室敏感指标,尤其是PTA<40%为临床诊断肝衰竭金指标[1]。免疫球蛋白(Ig)在体液中合成,与补体同存在于血清中,人类Ig根据重链组成不同分为IgG、IgM、IgA、IgD、IgE五类。对于免疫球蛋白检查临床医生重视不够,或对其临床意义认识不足,一般只作为辅助参考指标。实际上慢性肝炎患者免疫球蛋白水平随病情变化而波动,即病情愈重,球蛋白水平愈高,与病情程度成正相关系,其值的变化与TBil、PTA、ALB变化具有同等的临床意义[2]。本研究也证实,肝衰竭组自起病开始到疾病高峰期(1~30 d),PTA、ALB逐渐降低,TBil逐渐升高,免疫球蛋白(IgG、IgM、IgA)水平随疾病进展逐渐升高达到峰值;到起病后的第45天,病情好转,PTA、ALB逐渐升高,TBil逐渐降低,免疫球蛋白水平亦逐渐下降。
HBV在肝细胞内复制并不引起肝细胞损伤,HBV诱导的细胞免疫反应是导致肝细胞损伤的决定因素,也是病毒清除的主要途径[3]。当HBV抗原多肽被组织相容抗原(MHC-1、HLA-A,-B,-C)类抗原限制的CD8T细胞识别后,CD8T即获得了通过非致细胞病变性、细胞因子介导的抑制病毒复制,使HBV受感染细胞恢复正常功能,又通过穿孔素-Fas配体和IFN-α、NK细胞等介导的免疫反应,直接杀伤作用及抗体依赖性细胞毒性作用(ADCC)造成肝细胞损伤[4]。在慢性持续HBV感染中,HBV特异性免疫反应较弱,不足以清除所有受感染细胞的病毒,但可持续破坏受感染肝细胞,引起肝脏慢性炎症。B淋巴细胞致敏后转化为浆细胞,同时产生能够结合其相应抗原的血浆球蛋白,按其理化性质及免疫特性可分为IgD、IgG、IgM、IgA、IgE五类,以IgG、IgM、IgA为主要。慢性乙型肝炎在向肝硬化、肝衰竭进展中,肝脏Kupffer细胞功能发生障碍,不能及时清除从肠道吸收的抗原及自身抗原,使抗原、抗体产生过多,引起免疫球蛋白水平升高。病情愈重,抗原抗体清除更少,产生愈多,血清免疫球蛋白升高愈明显。IgM在疾病早期或急性期升高明显,在慢性期升高不明显。随着肝炎病情加重,肝衰竭时肝细胞大量坏死,Kupffer细胞功能失调,不能有效地发挥吞噬作用,失去对抗原的处理能力,抗体形成明显增多,使IgG、IgM、IgA同时升高,以IgG升高为主,肝细胞受损愈重,IgG水平愈高[5]。对照组肝细胞轻度炎症,抗原、抗体产生较少,Kupffer细胞功能基本正常,能有效发挥吞噬作用清除外来异物,抗体明显减少。因此二组比较有明显差异,从另一方面说明了肝脏损伤的程度。
肝脏不是免疫球蛋白合成的场所,但对血清中免疫球蛋白含量调节起主要作用,肝脏功能减弱,调节免疫球蛋白作用减弱。本研究实验结果也说明,对照组肝炎程度较轻,血清中Ig含量变化不大,肝衰竭组免疫球蛋白水平变化,尤其是IgG、IgM、IgA水平变化较大,可以从另一个方面反映了肝脏受损程度及病情的预后,值得临床医师重视。
1中华医学会感染病学分会肝衰竭与人工肝学组.肝衰竭诊治指南(2012年版).中华临床感染病杂志,2012,5(6):321-322.
2刘锡光,祁自柏,熊诗松.病毒性肝炎实验诊断学.2版.北京:人民卫生出版社,1999:627-628.
3周臣敏.免疫球蛋白检测在乙型肝炎患者病情及预后判断的临床意义.国际检验医学杂志,2013,34(3):376-377.
4史鸣树,闵建荣.乙型病毒性肝炎.北京:人民军医出版社,2009: 74.
5覃小梅,谭晓明,秦玉兰.乙型肝炎患者免疫球蛋白检验的临床意义.临床和实验医学杂志,2011,10(9):702-703.
2013-12-11)
(本文编辑:朱薇)
10.3961/j.issn.1672-2159.2014.03.010
516001广东省惠州市惠阳区妇幼保健院检验科

