免疫传感器在癌胚抗原检测中的构建与应用研究*
马 霄 莫利明 虞 成 逯岭松 杨 攀
免疫传感器在癌胚抗原检测中的构建与应用研究*
马 霄①莫利明①虞 成①逯岭松②杨 攀①

目的:设计一种新型的基于丝网印刷技术的癌胚抗原(CEA)免疫传感器,用于癌胚抗原浓度的床边检测。方法:在丝网印刷电极(SPE)上层层修饰上多壁碳纳米管(MWNTs)N,N-二甲基甲酰胺(DMF)分散液与壳聚糖纳米二氧化铈(Chitosan-Nano CeO2)溶液两种纳米材料,利用纳米铈固载癌胚抗原抗体(anti-CEA),最后用牛血清白蛋白(BSA)封闭纳米铈上非特异位点,构建一种新型的癌胚抗原免疫传感器。采用透射电镜(TEM)及循环伏安法(CV)对修饰过程进行表征。结果:探讨不同pH、孵育温度及孵育时间对该免疫传感器性能的影响,该传感器在最适条件下对CEA响应良好,其线性范围为0~80 ng/ml,线性相关系数r=0.99825,检出限为0.08 ng/ ml。结论:CEA免疫传感器具有稳定性好、灵敏度高、特异性好、结果准确可靠和可再生等优点,可应用于临床检测。
癌胚抗原;丝网印刷电极;多壁碳纳米管;纳米铈
[First-author’s address] Department of Medical Engineering, Hangzhou First People’s Hospital, Hangzhou 310006, China.
癌胚抗原(carcinoembryonic antigen,CEA)是一种具有人类胚胎抗原特性决定簇的酸性糖蛋白,作为一种常见的肿瘤标志物,被广泛用作卵巢癌、乳腺癌等各种肿瘤的诊断及监测指标[1-2]。准确测定血清中CEA的含量对临床诊断具有重要的意义。多壁碳纳米管(modifying multi-wall carbon nanotubes,MWNTs)比表面积大、机械强度高,具有优异的电子传导特性和化学稳定性,用其修饰电极可以显著增加响应电流,但MWNTs不易溶解分散[3-6]。N,N-二甲基甲酰胺(dimethyl-formamide,DMF)是一种用途广泛的优良溶剂,本研究选择DMF分散MWNTs的分散剂,克服了MWNTs不易溶解分散的问题。纳米铈具有比表面积大、生物兼容性好等优点,近年来常被用来吸附酶或抗体[7-8]。纳米二氧化铈(CeO2)具有较高等电点,由于抗体本身等电点低,故其对抗体具有很强的静电吸附作用[9]。壳聚糖纳米(Chitosan-Nano)生物相容性好、成膜能力强,可以有效地分散纳米铈[10-13]。
目前,血清CEA测定可用酶联免疫吸附测定法(enzyme-linked immunosorbent assay,ELISA)和放射免疫检测法(radioimmunoassay,RIA),这两种方法需要实验室大型仪器检测并需配备专业人员,且检测时间相对较长[14]。丝网印刷电极(screen-printed electrodes,SPE)因其操作简单,携带方便,近年来在环境监测、DNA检测等领域广泛关注,且血糖纸片已经成功用于临床检测[15]。本研究利用多壁碳纳米管及纳米铈将CEA抗体固载到SPE表面,构建了一种新型的一次性CEA免疫传感器。
1 材料与方法
1.1 仪器与试剂
(1)CHI604D电化学工作站(上海辰华仪器有限公司);AUW220D电子天平(日本岛津公司);pHS-3C酸度计(上海精密科学仪器有限公司雷磁仪器厂);DL-60A超声波清洗器(上海之信仪器有限公司);85-2数显恒温磁力搅拌器(上海梅香仪器有限公司);Hitachi T-7500透射电子显微镜(日本日立公司)。
(2)CEA单克隆抗体与CEA标准品(美国Sigma公司);牛血清白蛋白BSA(96%~99%,美国Sigma公司);纳米铈(北京钠辰科技有限公司);壳聚糖(上海生物工程有限公司);CEA试剂盒(武汉中美科技有限公司);葡萄糖,尿酸,抗坏血酸标准品(上海生工生物工程公司);多壁碳纳米管(MWNTs,中科院成都有机化学研究所);N,N-二甲基甲酰胺(DMF,分析纯,上海生物工程有限公司);实验所用缓冲液均为含5 mmol/L[Fe(CN)6]3-/4-和0.1 mol/L KCl的0.1 mol/ L PBS溶液(pH=7.0),其他所有辅助试剂均为分析纯浓度,实验所用水为双蒸水。
1.2 免疫传感器的制备方法
(1)丝网印刷电极的制备。在0.5 mm厚的塑料基板上依次印刷银层、碳层和绝缘层,放入90 ℃真空干燥箱中干燥15 min,制得SPE电极,将10 mg羧基化的MWNTs分散在10 ml的DMF溶液中,超声处理10 min,制成1.0 mg/ml的MWNTs分散液。处理过的MWNTs带有丰富的负电荷,取2 μl该溶液均匀滴涂于SPE中间4 mm2工作电极上,室温下干燥2 h,制成MWNTs-DMF/SPE电极(如图1所示)。

图1 丝网印刷电极图
(2)CeO2用透射电子显微镜表征,溶胶颗粒平均直径为12 nm。将壳聚糖溶于1%(V/V)的冰醋酸溶液中,制成5%(W/W)壳聚糖溶液。将CeO2与壳聚糖混合溶液2 μl(体积比为1∶1)滴涂于工作电极表面,室温37 ℃浸泡4 h,用双蒸水洗涤工作电极,除去未附着混合溶液,制成Chitosan-Nano CeO2/MWNTs-DMF/SPE电极。
(3)抗体包被。将2 μl anti-CEA均匀滴涂在工作电极表面4 ℃下静置12 h,最后将2 μl BSA溶液(2.5%, m/V)均匀滴涂在工作电极表面上,4 ℃下浸泡1 h,以封闭电极上的非特异吸附位点,用双蒸水洗涤电极表面,除去未附着物质,制成CEA丝网印刷电极。该电极的制备流程如图2所示。

图2 工作电极修饰流程图
(4)表征方法。利用循环伏安法(cyclic voltammetry,CV)对传感器响应电流进行表征,测试采用经典三电极体系,即CEA抗体修饰的SPE为工作电极,以Ag电极为参比电极,碳电极为对电极,在含5 mmol/L [Fe(CN)6]3-/4-和0.1 mol/L KCl的0.1 mol/ LPBS(pH=7.0)缓冲液中进行循环伏安扫描,电压为:-0.2~0.8 V;扫描速度:50 mV/s;所有测试均在35 ℃下进行。
(5)检测方法。SPE工作电极在被检标本中孵育,37 ℃,10 min;然后在含5 mmol/L[Fe(CN)6]3-/4-和0.1 mol/L KCl的0.1 mol/LPBS(pH=7.0)缓冲液进行CV检测,观察响应电流随标本中CEA浓度变化关系。
2 结果
2.1 MWNTs-DMF和Chitosan-Nano CeO2的TEM表征
如图3所示,图3(A)显示出MWNTs在DMF溶液中分散的情况,MWNTs直径为10~15 nm;图3(B)显示出Nano CeO2在Chitosan分散的情况,Nano CeO2分散比较均匀,颗粒直径约为12 nm。

图3 MWNTs-DMF和Chitosan-NanoCeO2透射电镜图(×105)
2.2 传感器的电化学性质
(1)温度为30 ℃的检测条件。SPE为5 mmol/ L[Fe(CN)6]3-/4-和0.1 mol/L KCl的0.1 mol/ LPBS(pH=7.0)缓冲液,扫描电压为-0.2~0.8 V,扫描速度为50 mV/s,温度为30 ℃,其不同条件下的循环伏安曲线如图4所示。

图4 不同修饰的SPE缓冲液中的循环伏安曲线
图中曲线a为裸SPE碳电极条件,有氧化还原峰,表明SPE在5 mmol/L[Fe(CN)6]3-/4-和0.1 mol/L KCl的 0.1 mol/LPBS(pH=7.0)缓冲液中可产生标准的氧化还原电流;曲线b为在电极表面滴涂了MWNTs-DMF分散液,图形较之曲线a中氧化还原电流均变大,表明MWNTs-DMF放大了电流信号;曲线c为在SPE上修饰了Chitosan-NanoCeO2,其氧化还原峰较曲线b有明显的增高,表明Chitosan-Nano CeO2极大增加了电极电子传递的有效面积,起到了明显放大响应电流的作用;曲线d为在SPE上固载了anti-CEA,其氧化还原峰较曲线c变小,因为抗体蛋白质有阻碍电流的作用;曲线e为在SPE上包被了BSA,氧化还原电流均进一步减小,因为蛋白质分子修饰到电极上会阻碍电子传递,表明BSA封闭了电极上非特异吸附位点。
(2)温度为35 ℃的检测条件。SPE为5 mmol/ L[Fe(CN)6]3-/4-和0.1 mol/L KCl的0.1 mol/ LPBS(pH=7.0)缓冲液,扫描电压为-0.2~0.8 V,温度为35 ℃。SPE在不同扫描速度下的循环伏安曲线以及响应电流的拟合曲线如图5所示。

图5 SPE在不同扫速下的循环伏安曲线
图5 中显示,[Fe(CN)6]3-/4-的氧化还原可逆性好,在20~150 mV/s范围内,SPE的响应电流与扫速的平方根成线性关系,氧化峰线性方程为Ipi=-5.57539e-6v1/2-1.48002e-5,r=-0.99565,还原峰线性方程为Ipc=7.21998e-6v1/2+1.67433e-5,r=0.99603,说明SPE表面氧化还原反应受扩散控制。
2.3 pH对CEA免疫传感器的影响
缓冲液的pH对抗原、抗体的活性有很大的影响。在缓冲液pH值为5.0~8.0范围内考察了其与CEA免疫传感器孵育CEA孵育前后电流变化值Δi的关系,可观察到当缓冲液的pH值为7.0时电流响应变化值最大,表明此时抗原、抗体的活性最高,抗原、抗体结合度最大,形成的复合物影响电流传递,因此将缓冲液的pH调为7.0(如图6所示)。
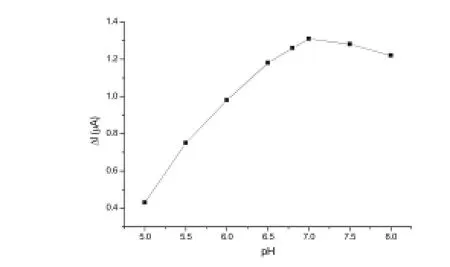
图6 pH对CEA免疫传感器电流的影响
2.4 温度对CEA免疫传感器的影响
温度对抗原、抗体的活性有很大的影响。当温度升高时,抗原、抗体反应速率增加,但高温会使其失活。实验在20~45 ℃范围内考察了其与CEA免疫传感器孵育CEA孵育前后电流变化值Δi的关系,当温度达到40 ℃时,响应电流值达到最大。但是为了保持抗原、抗体的活性,实验温度选为35 ℃(如图7所示)。
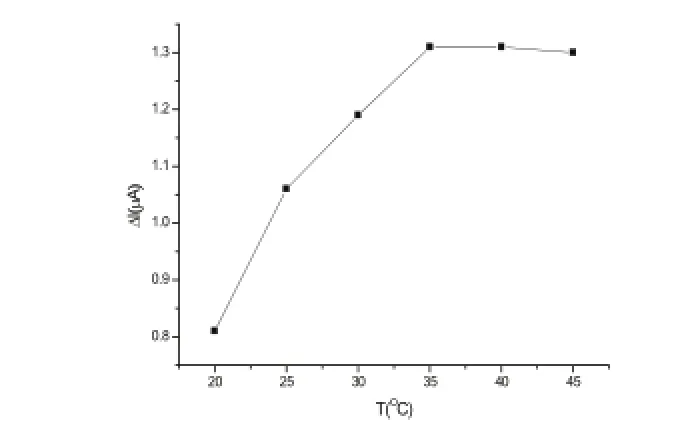
图7 温度变化对CEA免疫传感器电流的影响
2.5 孵育时间对CEA免疫传感器的影响
如图8所示,图中反映了孵育时间对CEA免疫传感器响应电流的影响,将传感器与20 U/L的CEA孵育,孵育时间在3~20 min考察其与电流变化值Δi的关系,3~8 min内电流变化值Δi逐渐增大,8~20 min电流趋于平稳,即15 min时抗原、抗体结合达到饱和,因此,孵育时间控制在8 min。

图8 孵育时间对CEA免疫传感器电流的影响
3 CEA免疫传感器的响应特性
3.1 CEA标准品的检测
CEA免疫传感器检测原理如图9(A)所示,CEA抗原、抗体结合前其氧化峰电流值为ia,当传感器上抗原、抗体发生反应后,形成的免疫复合物阻碍电子传导,免疫传感器的氧化峰电流减小,此时氧化峰电流值为ib,电流变化值Δi=ib-ic,即CEA孵育前后CEA免疫传感器电流变化值。
在最优实验条件下,将制备好的CEA免疫传感器在不同浓度的CEA标准品中进行孵育,CV法记录Δi,绘制标准曲线,如图9(B)所示,CCEA在0~80 ng/ml与Δi线性相关,线性方程为ΔIpa=0.01994CCEA+0.15225,r=0.99825,检测下限为0.08 ng/ml。

图9 CEA浓度与峰电流的线性关系
3.2 CEA免疫传感器的特异性
将8.8 mmol/L葡萄糖,0.24 mmoL/L尿酸,0.5 mmol/L抗坏血酸加入到50 ng/ml的CEA标准品中,模拟人体环境可能出现的干扰物质,观察传感器在干扰物加入前后响应电流的变化,结果相差<8%,说明传感器特异性较好。
3.3 免疫传感器的重现性和稳定性
将同批次制备的5支免疫传感器在相同条件下测定,相对标准偏差(RSD)为4.3%,说明该传感器有良好的重现性。将免疫传感器在4 ℃下保存1个月,响应电流能保持初始电流的80%。说明传感器的稳定性较好。
3.4 回收试验
用CEA标准品配制5个质量浓度依次为5 ng/ml、20 ng/ml、40 ng/ml、60 ng/ml及80 ng/ml的标准溶液,将CEA免疫传感器分别在5个样本溶液中孵育8 min,计算其回收率为98.3%~101.8%。结果表明,通过该方法制得的免疫传感器可用于临床对CEA的检测。
4 临床比对
为了验证此方法的可行性和应用到临床医学的可能性,对实际样品进行了检测,在正常人血清中加入CEA标准品进行模拟,采用本法进行测定并和标准的EILSA方法进行对照,结果见表1。

表1 免疫传感器和标准ELISA法检测血清标本结果对照
表1显示,两种方法检测结果的相对偏差在-4.0%~2.1%之间,表明该传感器适合用于血清CEA含量的测定。
5 结论
采用层层自助装法将MWNTs-DMF和Chitosan-Nano CeO2修饰到SPE上,逐层明显增大响应电流,最后用Chitosan-Nano CeO2固载抗体,研制了一种新型的一次性CEA电流型免疫传感器。该传感器具有较好的敏感性和特异性,可用于床边快速检测。
[1]Liu Y,Jiang H.Electroanalytical determination of carcinoembryonic antigen at a silica nanoparticles/ titania sol-gel coCEAsite membrane-modified gold electrode[J].Electroanalysis,2006,18(10):1007-1013.
[2]Lechne P,Lind P,Goldenberg DM.Can Postoperative surveillance with serial CEA immunoscintigrapHy detect resectable rectal cancer recurrence and potentially improve tumor-free survival[J].J Am Coll Surg,2000,191(5):511-518.
[3]柳海萍,汪振辉,赵小玲.碳纳米管复合物电极的构筑及其对嘌呤衍生物的同时测定[J].分析化学,2011(4):471-475.
[4]Wan Y,Deng WP,Su Y,et a1.Carbon nanotubebased ultrasensitive multiplexing electrochemical for cancer bio-markers[J].Biosens Bioelectron,2011,30(1):93-99.
[5]Yu X,Munge B,Patel V,et a1.Carbon nanotube amplification strategies for highly sensitive immunodetection of cancer bio-markers[J].J Am Chem Soc,2006,128(34):11199-11205.
[6]Dalmasso PR,Pedano ML,Rivas GA.Supramolecular architecture based on the self-assembling of multiwall carbon nanotubes dispersed in polyhistidine and glucose oxidase:Characterization and analytical applications for glucose biosensing[J]. Biosens Bioelectron,2013,39(1):76-81.
[7]Primo EN,Gutierrez FA,Luque GL,et a1.Comparative study of the electrochemical behavior and analytical applications of(bio)sensing platformsbased on the use of multi-walled carbon nanotubes dispersed in different polymers[J]. Anal Chim Acta,2013,805:19-35.
[8]Ansari AA,Solanki PR,Malhotra BD.Hydrogen peroxide sensor based on horseradish peroxidase immobilized nanostructured cerium oxide film[J].Nanotechnol,2009,142(2):179-184.
[9]Kaushik A,Solanki PR,Ansari AA,et a1.A nanostructured cerium oxide film-based immunosensor for mycotoxin detection[J].Nanotechn ology,2009,20(5):055105.
[10]Boren EJ,Cheema GS,Naguwa SM,et a1.The emergence of progressive multifocal leukoencepHalopathy(PML)in rheumatic diseases[J]. J Autoimmun,2008,30(1-2):90-98.
[11]Yagati AK,Lee T,Min J,et al.An enzymatic biosensor for hydrogen peroxide based on CeO2nanostructure electrodeposited on ITO surface[J].Biosens Bioelectron,2013,47:385-390.
[12]He,JC Liu,Q Zhang,et al.A novel stable amperometric glucose biosensor based on the adsorption of glucose oxidase on poly(methyl methacrylate)-bovine serum albumin core–shell nanoparticles[J].Sensors and Actuators B:Chemical,2013,(166-167):802-808.
[13]Xi,TS Shi,D Liu,et al.Integration of carbon nanotubes to three-dimensional C-MEMS for glucose sensors[J].Sensors and Actuators A:Physical,2013,198(15):15-20.
[14]Janata J.Twenty years ion-selective field effect transistors[J].Analyst,1994,119(12):2275-2278.
[15]Wang J.Electrochemical Glucose Biosensors[J]. Chem Rev,2008,108(2):814-825.
Research on immunosensor for the determination of carcinoembryonic antigen and its application/
MA Xiao, MO Li-ming, YU Cheng, et al// China Medical Equipment,2014,11(10):1-5.
Objective: To design immunosensor for the determination of Carcinoembryonic Antigen(CEA) and be used in the piont-of-care test of the concentration of CEA. Methods: The immunosensor was developed by modifying multi-wall carbon nanotubes(MWNTs)which dispersed in N, N-dimethyl-formamide(DMF)on the Screen-Printed Electrodes (SPE), then Chitosan-NanoCeO2were immobilized self-assembly. And then the antibody of CEA (anti-CEA) was absorbed on the surface of NanoCeO2monolayer. Finally, Albumin from bovine serum (BSA) blocked the non-specific adsorption site.The modification process was characterized by transmisCeOn electronmicroscope(TEM)and cyclic voltammetry(CV). The factors possibly influenced the performance of the proposed immunosensor were studied in detail. Results: Under optimal conditions,the obtained immunosensor exhibited good electrochemical behavior to CEA in a linear range of 0 to 80 ng/ml (r=0.99825), with a detection limit of 0.08 ng/ml. Conclusion: The immunosensor prepared using this method has advantages of good stability, regeneration, high sensitivity and specificity. Thus, the method can be used for clinical application.
Carcinoembryonic antigen; Screen-printed electrodes; Multi-wall carbon nanotubes; NanoCeO2
1672-8270(2014)10-0001-05
R730.45
A
10.3969/J.ISSN.1672-8270.2014.10.001
2014-06-13
国家自然科学基金(81301514)“基于DNA甲基化多指标联合检测卵巢癌的新方法研究”;浙江省科研项目基金(2011C37027)“基于双纳米生物传感技术的MPO即时检测系统”
①杭州市第一人民医院设备科 浙江 杭州 310006
②杭州市第一人民医院中心实验室 浙江 杭州 310006
马霄,男,(1982- ),硕士,助理工程师。杭州市第一人民医院设备科,从事电化学生物传感器的技术研究、床边快速诊疗设备的开发以及临床医学检验设备及生物医学工程的项目研发工作。

