生姜块茎的诱导培养
梁小敏
(江西农业工程职业学院,江西樟树 331200)
生姜块茎的诱导培养
梁小敏
(江西农业工程职业学院,江西樟树 331200)
以生姜块茎为培养材料,通过对生姜催芽、表面灭菌、外植体切割和启动培养等试验研究得出,生姜适宜的培养方案为生姜块茎先埋入含水量10%左右的细沙中催芽,清洗后用稀释800倍的多菌灵浸泡30 min,再用0.12%的升汞浸泡12 min表面灭菌,切割外植体时保留少部分姜块,诱导培养基为MS+BA 0.5 mg· L-1+NAA 0.25 mg·L-1+0.1%生姜提取液。
生姜块茎;灭菌;芽诱导培养
生姜以地下块茎无性繁殖为主,其繁殖系数较低,用种量大,并且易通过带病种姜传播病害。用组织培养的方法进行繁殖可以解决这一生产难题,但生姜在进行组织培养时会遇到一系列的问题,本试验主要从生姜茎块的灭菌、切割与启动培养等组织培养技术方面加以研究。
1 材料与方法
1.1 材料
生姜购买于江西省樟树市农贸市场。
1.2 方法
把生姜埋在催芽盒细沙中,置25℃恒温培养箱中催芽。当芽长2~3 cm时,放在清水托盘里用毛刷清洗干净,切下带姜块的芽点,用洗衣粉或多菌灵浸泡,自来水冲洗30~40 min,沥干水分。在超净工作台上,先用75%的酒精浸润30 s,再用0.10%~0.15%升汞滴加1~2滴吐温80浸泡10~12 min,同时不停摇荡使表面灭菌充分,然后无菌水冲洗,切割成0.5~1.0 cm的不定芽或带0.5~1.0 cm见方姜块的不定芽接种到培养基上,置于2 000 lx,(25±2)℃的温控培养室中培养。
2 结果与分析
2.1 生姜的表面灭菌
饱和洗衣粉浸泡1 min是实验室常用的清洗材料的方法,但对生姜则达不到理想去污效果(污染率高达100%);改用稀释800倍的多菌灵清洗30 min后,污染率明显下降(污染率为35%)。对不同浓度升汞和灭菌时间进行效果对比(表1)显示,0.10%的升汞浸泡12 min是本实验室常用的灭菌方法,但生姜污染率明显太高。0.15%的升汞浸泡10 min,污染率虽降低,但同时伴随着存活率的下降。0.12%的升汞浸泡12 min,灭菌效果在这3个浓度中比较好。
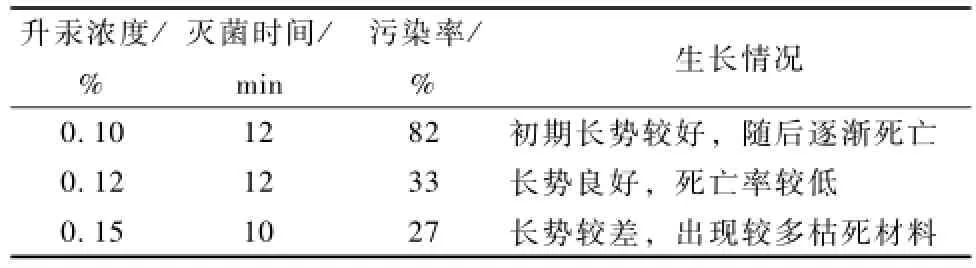
表1 不同浓度升汞及灭菌时间效果对比
2.2 生姜外植体的切割
经过灭菌后,切割生姜芽点作为接种的外植体,针对所切割的外植体是否含有生姜芽基部以及基部的大小进行了对比试验,结果(表2)显示,切割外植体时,若外植体带有小部分姜块母体,则诱导出来的芽褐化程度较轻,生长较好。但所带姜块母体较多则会出现严重污染。而不带任何姜块母体的生姜芽点褐化较严重,生长也比较慢。

表2 生姜芽基部姜块对离体培养的影响
2.3 芽诱导培养基
切割好的生姜外植体接种在5种不同的培养基上,添加不同种类或浓度的生长调节剂,4周后进行观察记录(表3)。各处理均以MS为基本培养基,并加入0.7%琼脂和0.3%的蔗糖,生姜茎块培养过程中极易生根,有时会影响到芽的增殖倍数,相对而言,诱导发芽有一定的难度。陈娟等[1]认为,6-BA的效果优于KT和GA3,且GA3具有明显的抑制作用。杭玲等[2]用BA 3.0 mg· L-1+NAA 0.1 mg·L-1的培养基诱导芽分化效果最好,且没有幼根长出,而使用KT取代BA,其效果不如BA。
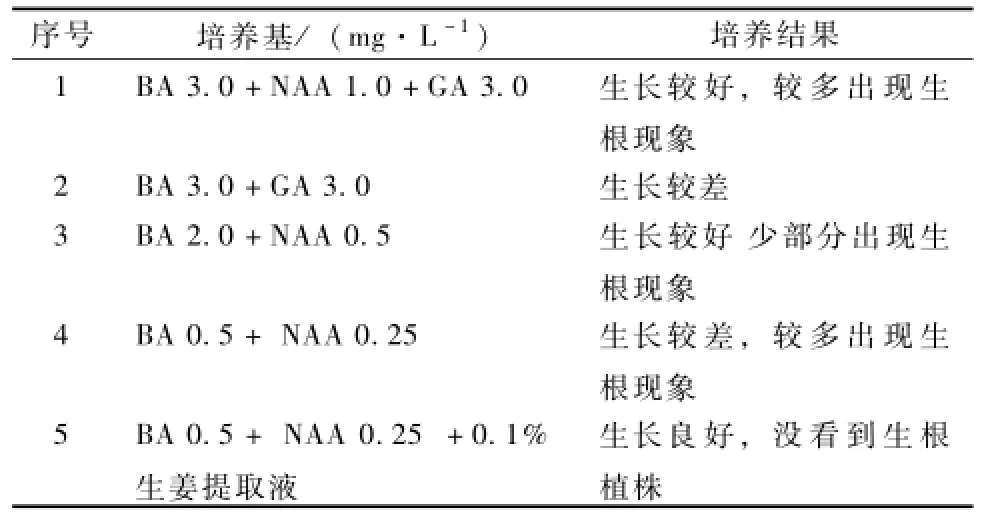
表3 5种培养基对启动培养的影响
通过对5种培养基中生姜的芽诱导试验认为,仅有BA和GA,而无NAA培养基的长势较差,但有BA与NAA的培养基的植株也出现不同程度的生根或生长不良现象。附加有生姜提取液的这组培养基材料生长状况要好于其他培养基。
3 小结与讨论
通过对生姜块茎表面灭菌、外植体切割和选用不同的启动培养基培养等试验结果显示,生姜茎块应埋入含水量10%左右的细沙中催芽,清洗后用稀释800倍的多菌灵浸泡30 min,沥干水,再用0.12%的升汞浸泡12 min进行表面灭菌,然后用无菌水清洗干净。在切割外植体时保留少部分芽点以下的姜块基部母体更容易成活。启动培养基中增加1%的生姜汁液会让培养结果更理想。
生姜进行块茎无菌培养时,催芽有一定困难,细沙太干或恒温箱相对湿度太低,则无法催芽;细沙太湿或恒温箱相对湿度较高又易腐烂。同时,生姜为地下块茎,芽上有鳞片,污染较严重,灭菌难度较大,是生姜块茎离体培养的一大瓶颈。薛寒青等[3]用1 g·L-1次氯酸钠处理20 m in,最后再用0.1 g·L-1升汞处理10 min。用表面消毒与脱菌素相结合的方式可有效降低染菌率。在切割外植体或转接材料时,最好带上部分姜块。陈泽雄等[4]也认为,采用保留基部0.5 cm的微型团块作为生姜继代方式效果较好。
在诱导芽的过程中,还常伴随生根现象。对此,雷开荣[5]认为,生姜快速繁殖要求较高的BA浓度,但在同时附加BA 2~3 mg·L-1+ NAA 0.5~1.0 mg·L-1的培养基中,可以实现生姜丛生芽和根同步诱导。孙霞等[6]采用附加KT 2.0 mg·L-1+NAA 1.0 mg·L-1的培养基,通过器官发生途径可获得大量的带根苗。如果诱导出的芽数量足够多,生根与增殖同步进行可节省培养时间。
培养中还发现,生姜较易出现叶片黄化现象。陈泽雄等[4]是以改良MS(1/3 NH4NO3)为基本培养基,BA 1.5 mg·L-1与BA 1.5 mg·L-1+NAA 0.2 mg·L-1隔代交替使用,置于散射光条件下培养效果最好,且能降低玻璃化苗和黄化苗比例。
[1] 陈娟,潘开文,毕世荣,等.生姜茎尖组织培养和污染率控制的研究[J].长江蔬菜,2007(1):38-40.
[2] 杭玲,黄卓忠,江文,等.生姜组织培养快繁技术研究与应用[J].江苏农业科学,2006(5):125-127.
[3] 薛寒青,周淑兰.不同抗生素对生姜组织培养中姜芽脱菌效果的研究[J].北方园艺,2009(6):45-47.
[4] 陈泽雄,刘奕清,黄登艳,等.培养因子及切割工艺对生姜试管苗生长效应的研究[J].中药材,2010(5):668-671.
[5] 雷开荣.生姜组织培养中增殖与生根同步培养技术研究[J].中国种业,2006(5):33-34.
[6] 孙霞,亓翠英,秦燕.生姜通过器官发生途径体外再生的研究[J].北方园艺,2012(19):121-123.
(责任编辑:张瑞麟)
S 632.5
B
0528-9017(2014)06-0848-02
文献著录格式:梁小敏.生姜块茎的诱导培养[J].浙江农业科学,2014(6):848-849.
2013-12-16
梁小敏(1973-),女,副教授,硕士,主要从事农业生物技术应用教学与科研工作。E-mai1.1iangxm@sina.com。

