应用肋间后动脉穿支皮瓣修复微囊型淋巴管畸形切除后的大面积缺损
王海珍 崔春晓 蒋朝华 李圣利 曹卫刚
应用肋间后动脉穿支皮瓣修复微囊型淋巴管畸形切除后的大面积缺损
王海珍 崔春晓 蒋朝华 李圣利 曹卫刚
目的探讨微囊型淋巴管畸形(LMs)手术切除的可行性,并对肋间后动脉穿支(LICAP)皮瓣修复微囊型LMs切除后的大面积缺损的有效性进行评价。方法2009年1月至2012年12月,对8例13~22岁腋胸侧壁微囊型LMs患者,应用MRI和B超确定病变切除的范围和层次,对彻底切除后均遗留的腋窝、胸侧壁皮肤组织缺损,应用LICAP皮瓣进行修复,7位患者皮瓣供区直接缝合,1位患者供区植皮覆盖。结果应用LICAP皮瓣可成功修复所有微囊型LMs切除术造成的组织缺损。术后随访1~3年,皮瓣形态良好,B超和MRI证实无复发微囊腔出现,皮瓣供区无功能受损。结论超声和MRI可为手术彻底切除病灶作精确定位并进行手术后评估。微囊型LMs手术切除术后遗留组织缺损可应用LICAP皮瓣获得良好的组织覆盖和修复,术后受区外形良好,供区无功能损伤。
淋巴管畸形肋间后动脉穿支皮瓣腋胸侧壁重建
微囊型淋巴管畸形(Lymphatic Malformations, LMs)是一种累及皮肤及皮下组织的先天性淋巴系统畸形[1],腋窝胸侧壁是其最常见的发病部位。对于累及皮肤的患者,通过病史和体格检查即可明确诊断;对于累及深部组织及弥散性病变的患者,则需通过MRI或超声协助诊断,探查病灶累及层次和范围,以选择合适的治疗手段[2]。微囊型LMs的治疗方法包括手术切除、放射治疗、冷冻疗法、电灼烧疗法、注射硬化剂治疗、类固醇治疗、栓塞治疗、缝扎治疗、激光疗法、射频消融以及多种方法的联合治疗等[3-4]。目前,硬化剂疗法仅对大囊型LMs有效,对于微囊型LMs效果欠佳,手术切除仍然是目前治疗微囊型LMs的主要方法之一[5]。手术治疗的关键在于完全彻底地清除病灶,以降低复发率。术前需借助超声和MRI探测病灶范围和毗邻,以确定切除范围[6-7]。然而,病灶完全切除后常遗留大面积皮肤组织缺损,多采用皮片、任意皮瓣和游离皮瓣等进行修复。
近10年来,应用穿支皮瓣修复组织缺损受到了广泛关注。由于供区皮瓣皮下肌肉的保留,穿支皮瓣对于供区形态功能的影响很小。报道显示,来自躯干的穿支皮瓣和基于穿支的带蒂皮瓣可用于修复多种组织缺损[8-9]。对于腋窝附近的组织缺损,肋间动脉穿支皮瓣是最佳选择[10]。来自于侧胸壁和后胸壁的肋间后动脉穿支(Lateral intercostal artery perforator,LICAP)皮瓣已被用于胸壁或上肢缺损的修复[11]。我们在保证手术彻底切除微囊型LMs病变的基础上,应用LICAP皮瓣修复术后缺损,效果良好。
1 资料和方法
1.1 病例资料
2009年1月至2012年12月,共8例腋窝胸侧壁微囊型LMS患者(均来自上海交通大学医学院附属第九人民医院整复外科),男女各4例,年龄13~22岁(平均16.8岁),这些患者均接受过1~2次手术切除治疗,复发后就诊。
1.2 术前准备
应用MRI结合超声对病损进行诊断,明确病灶累及范围,并进行标记,以彻底切除病灶。应用超声定位LICAP,并在皮肤上标记位置。
1.3 手术方法
本组患者病灶均位于腋窝胸侧壁区和上肢的内上区域。术中患者侧卧位,患侧上肢上抬外展。为预防复发,手术中根据超声和MRI诊断标记的病灶范围外1 cm及深筋膜下正常组织内进行病灶切除。根据术前超声标记的LICAP皮肤穿支位置和缺损部位设计皮瓣,皮瓣略大于缺损范围。切取皮瓣最大面积为21 cm×26 cm,最小为7 cm×15 cm。手术时间3~5 h。从皮瓣远端沿皮瓣深筋膜下层分离切取,分离至皮瓣背侧血管蒂部时,小心分离,勿损伤皮下穿支动脉。为获得更好的皮瓣移动度,充分游离皮瓣穿支,使皮瓣转为岛状,移动至缺损部位,并进行多层无张力缝合。皮瓣供区除1位患者进行了皮片植皮外,其余患者均可直接缝合。
2 结果
术后随访1~3年,通过超声和MRI评估皮瓣形态和病变复发情况。手术切除微囊型LMs后,所有缺损均用LICAP皮瓣成功修复。术后无伤口感染、皮瓣边缘坏死、伤口延迟愈合等并发症发生。皮瓣供区伤口一期愈合,无功能障碍发生。所有患者恢复良好,MRI和超声检察均未发现复发病灶。所有皮瓣完全成活,形态良好,未发生供区功能障碍。
3 典型病例
患者一,男性,16岁,自出生即发现微囊型LMs,初次切除后复发。外院病理诊断为“淋巴管畸形”。体检发现,患者胸壁上多个微小的突出囊泡。病灶中心有第一次手术后遗留的痂皮覆盖。MRI显示微型囊泡局限于皮下组织,未穿入深筋膜层,脂肪抑制序列上显示,微小囊泡为高信号。术前确认两支肋间穿支动脉位于胸侧壁第7肋间隙。手术中根据超声和MRI提示的范围,将微囊型LMs组织整块切除。术中于深筋膜下掀起16 cm×8 cm大小岛状皮瓣,在第七肋间分离LICAP及伴行静脉并充分游离,在无张力下将皮瓣转移至组织缺损区域。供区一期闭合。术后3年,无淋巴管畸形复发。MRI显示皮瓣良好,周围组织无复发微囊型LMs(图1)。
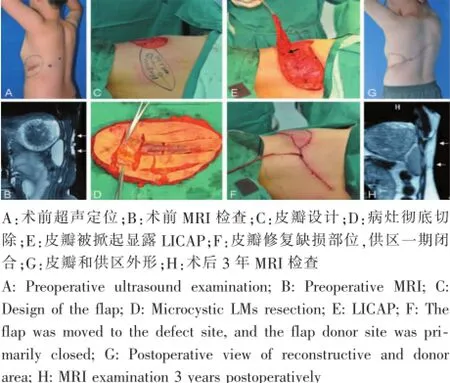
图1 典型病例1Fig.1 Typical case 1
患者二,女性,13岁,患病11年,自2岁始右胸壁和腋窝处持续出现聚集的微小囊泡,接受过手术部分切除和平阳霉素硬化剂注射治疗,5岁时再次复发。术前超声和MRI清楚提示了病灶的范围和层次,术中彻底切除病灶。皮瓣设计为7 cm×15 cm大小,比组织缺损稍大。依照术前超声提示,分离腋后线附近第六肋间穿支动脉。将皮瓣前移至缺损部位,并闭合供区。术后随访18个月,皮瓣形态良好,周围组织无微囊型LMs病灶复发(图2)。

图2 典型病例2Fig.2 Typical case 2
4 讨论
微囊型LMs是种侵犯皮肤的疾病,聚集成簇且界限不清的畸形微小淋巴管囊腔是其典型特征[1]。微囊型LMs常表现为弥散状,病灶可浸润体表组织并出现囊泡漏液。若皮下组织弥散性浸润,而未得到积极有效的治疗,可出现局限性淋巴水肿、感染、囊内出血等并发症[12-13]。
淋巴管畸形的治疗方法多种多样[3-4]。目前认为,硬化剂治疗对于大囊泡型LMs较为有效[5]。对于弥散的微囊型LMs,由于硬化剂难以有效进入所有囊泡,只对注入的囊泡产生作用,从而缩小病灶面积,无法根除病灶。手术治疗的困难在于病灶多且广泛,难以彻底清除,导致术后复发率高[14]。所以,为彻底切除淋巴管畸形病灶,术前需要周密计划和分期治疗。复杂病例的治疗常需联合多种手段,如注射治疗后手术切除,但操作难度较大[15-16]。尽管有许多辅助非手术治疗手段可预防复发,但最有效的是在手术中彻底清除病灶。因此,病灶周围的正常组织常需一并切除。术前,多数微囊型LMs病灶须经放射科帮助评估定位[6-7],而目前MRI和超声等影像检查能够为微囊型LMs的精确切除提供帮助。
目前的研究中,超声在确定微囊泡型淋巴管畸形的边界、层次和囊内容物方面优势明显,将图像三维重建后,可确定切除病灶的准确范围。累及肌肉的微囊型LMs的诊断主要依靠MRI,T1加权相有利于病灶定位,T2加权相可区别病灶和肌肉组织。因此,术前应用MRI和超声可有效完成疾病的诊断和病灶的精确定位,帮助彻底切除病灶。
微囊型LMs病灶完全切除后,遗留大面积组织缺损。理想的组织缺损覆盖物应仍为带血运的皮瓣。近10年来,穿支皮瓣在组织缺损修复重建中得到了广泛应用。由躯干取得的穿支皮瓣和基于穿支血管的带蒂皮瓣可用来修复各种组织缺损[9-11]。穿支皮瓣保留供区皮下肌肉,对供区损伤极小。本组患者中,微囊泡型淋巴管畸形位于上肢、腋窝和侧胸壁,LICAP皮瓣是修复该区域的理想选择[11]。肋间动脉有四个解剖学节段[17]。第一部分是源动脉到背部脊柱旁的穿支动脉(DICAP);第二部分是比较大的肋间后穿支动脉侧支(LICAP);第三部分是肌间节段,止于腹直肌侧缘的腹斜肌侧缘内;第四部分位于腹直肌下,并与上腹部血管系统相联系。较大的穿支血管稳定存在于胸背部的这些穿支动脉中。它们足以供应岛状皮瓣,被称肋间动脉侧支或背支(DICAP或LICAP)[9]。这些皮瓣延展性良好,获取时损伤较小且不伤及深层肌肉。因此,穿支皮瓣是躯干修复手术的新选择。
Hamdi等[18]应用来自肋间动脉背面、侧面,以及前面的穿支动脉皮瓣修复了各种躯干缺损。取自胸侧面LICAP皮瓣已被用于胸部以及上肢缺损的修复重建[19]。然而,应用胸部LICAP皮瓣修复微囊型LMs术后腋窝胸部缺损尚未见报道。已报道的最大胸部LICAP皮瓣大小为20 cm×10 cm,供区一期闭合[20]。我们的研究中,最大的LICAP皮瓣为26 cm× 21 cm,供区一期闭合,部分植皮修补,在1~3年的随访期间活力和形态良好。
取自胸背侧部的LICAP皮瓣具有如下优势:①皮瓣无折叠,皮瓣蒂部不扭曲;②较之胸部和腋窝部位,皮瓣较薄;③瘢痕位于胸部和背部,对美观影响较小;④供区损伤小;⑤肌肉的保留使肩部功能未受影响。通过MRI和超声诊断随访,LICAP皮瓣内以及周围无病灶复发。
总之,通过影像辅助能达到彻底切除微囊型LMs病灶的目的。对于因病灶彻底切除而遗留的大面积组织缺损,LICAP皮瓣可实现良好的组织覆盖和满足较高的美观需求,而不给供区造成功能缺损。
对于微囊型LMs,超声和MRI可提供安全、准确的术前和术后评估[6-7]。
[1]Rapini RP,Bolognia JL,Jorizzo JL,et al.Dermatology,2nd[M]. St.Louis:Mosby,2007.
[2]Derhy S,El Mouhadi S,Ruiz A,et al.Non-contrast 3D MR lymphography of retroperitoneal lymphatic aneurysmal dilatation: a continuousspectrum of change from normal variants to cystic lymphangioma[J].Insights Imaging,2013,4(6):753-758.
[3]Shiels WE 2nd,Kenney BD,Caniano DA,et al.Definitive percutaneous treatment of lymphatic malformations of the trunk and extremities[J].J Pediatr Surg,2008,43(1):136-139.
[4]Gilony D,Schwartz M,Shpitzer T,et al.Treatment of lymphatic malformations:a more conservative approach[J].J Pediatr Surg, 2012,47(10):1837-1842.
[5]Peters DA,Courtemanche DJ,Heran MK,et al.Treatment of cystic lymphatic vascular malformations with OK-432 sclerotherapy[J]. Plast Reconstr Surg,2006,118(6):1441-1446.
[6]Breugem CC,Courtemanche DJ.Portable ultrasound-assisted injection of OK-432 in lymphatic malformations by the plastic surgeon[J].J Plast Reconstr Aesthet Surg,2008,61(10):1269-1270.
[7]Furukawa H,Sasaki S,Oyama A,et al.Ethanol sclerotherapy with injection and aspiration technique'for giant lymphatic malformation in adult cases[J].J Plast Reconstr Aesthet Surg, 2011,64(6):809-811.
[8]Atik B,Tan O,Mutaf M,et al.Skin perforators of back region: anatomical study and clinical applications[J].Ann Plast Surg, 2008,60(1):70-75.
[9]Minabe T,Harii K.Dorsal intercostal artery perforator flap: anatomical study and clinical applications[J].Plast Reconstr Surg,2007,120(3):681-689.
[10]Hamdi M,Van Landuyt K,de Frene B,et al.The versatility of the inter-costal artery perforator(ICAP)flaps[J].J Plast Reconstr Aesthet Surg,2006,59(6):644-652.
[11]Acartürk TO.Lateral intercostal artery perforator-based reverse thoracic flap for antecubital reconstruction[J].J Plast Reconstr Aesthet Surg,2008,61(11):e5-e8.
[12]Mulliken JB.Vascular anomalies//Aston SJ,Beasley RW,Thorne CHM,eds.Grabb and Smith Plastic Surgery,5th[M].NY: Lippincott Raven Publishers,1997.
[13]Alomari AI,Karian VE,Lord DJ,et al.Percutaneous sclerotherapy for lymphatic malformations:a retrospective analysis of patientevaluated improvement[J].J Vasc Interv Radiol,2006,17(10): 1639-1648.
[14]Niti K,Manish P.Microcystic lymphatic malformation(lymphangioma circumscriptum)treated using a minimally invasive technique of radiofrequency ablation and sclerotherapy[J].Dermatol Surg, 2010,36(11):1711-1717.
[15]Okazaki T,Iwatani S,Yanai T,et al.Treatment of lymphangioma in children:our experience of 128 cases[J].J Pediatr Surg,2007, 42(2):386-389.
[16]Balakrishnan K,Menezes MD,Chen BS,et al.Primary surgery vs primary sclerotherapy for head and neck lymphatic malformations [J].JAMA Otolaryngol Head Neck Surg,2014,140(1):41-45.
[17]Daniel RK,Kerrigan CL,Gard DA.The great potential of the intercostal flap for torso reconstruction[J].Plast Reconstr Surg, 1978,61(5):653-665.
[18]Hamdi M,van Landuyt K,Monstrey S,et al.Pedicled perforator flaps in breast reconstruction:a new concept[J].Br J Plast Surg, 2004,57(6):531-539.
[19]Narushima M,Yamamoto T,Yamamoto Y,et al.Lateral intercostal artery perforator-based reversed thoracodorsal artery flap for reconstruction of a chronic radiation ulcer of the lower back wall [J].Ann Plast Surg,2011,67(4):352-356.
[20]Hamdi M,van Landuyt K,de Frene B,et al.The versatility of the inter-costal artery perforator(ICAP)flaps[J].J Plast Reconstr Aesthet Surg,2006,59(6):644-652.
Closure of Large Defects after Microcystic Lymphatic Malformations Using Lateral Intercostal Artery Perforator Flap
WANG Haizhen1,CUI Chunxiao2,JIANG Zhaohua2,LI Shengli2,CAO Weigang2.
1 Department of Dermatology, Shangqiu Central Hospital,Shangqiu 476000,China;2 Department of Plastic and Reconstructive Surgery,Shanghai Ninth People's Hospital,Shanghai Jiaotong University School of Medicine,Shanghai 200011,China.Corresponding author:LI Shengli(E-mail:drlishengli@163.com),JIANG Zhaohua(E-mail:zhhjiang@163.com).
ObjectiveTo evaluate the feasibility of complete removal of the multifocal and extensive lesions by accurate imaging diagnosis and to repair large skin defects due to complete resection of microcystic LMs using lateral intercostal artery perforator(LICAP)flap.MethodsFrom January 2009 to June 2012,tissue defects in the axillary chest wall region of 8 patients aged from 13 to 22 years after microcystic LMs resections were closed using LICAP flap.Flap donor sites in all patients were closed primarily except one patient who underwent skin grafting.Before surgery,ultrasound and MRI examination were used to confirm the diagnosis and determine the scope and level of the abnormality for complete resection. ResultsAll defects after microcystic LMs excision were successfully closed using LICAP flaps.The follow-up period ranged from 1 to 3 years(mean 2.1 years).All flaps survived postoperatively.No recurrence occurred.Ultrasound and MRI also demonstrated flap survival without recurrence of microcystic LMs.No functional loss attributable to the LICAP flap harvest was identified.ConclusionUltrasound and MRI are safe and accurate diagnostic imaging methods for the pre-and postoperative evaluation of the microcystic LMs in patients undergoing surgery.LICAP flap provides good coverage for the large defects and achieves acceptable morphology without functional deficits in donor sites.
Lymphatic malformation;Lateral intercostal artery perforator flap;Axillary chest wall;Reconstruction
R622
A
1673-0364(2014)06-0329-04
2014年9月23日;
2014年11月10日)
10.3969/j.issn.1673-0364.2014.06.007
476000河南省商丘市商丘市中心医院皮肤科(王海珍);200011上海市上海交通大学医学院附属第九人民医院整复外科(崔春晓,蒋朝华,李圣利,曹卫刚)。
李圣利(E-mail:drlishengli@163.com),蒋朝华(E-mail:zhhjiang@163.com)。
注:王海珍,崔春晓为共同第一作者。

