表达hTERT基因大鼠骨髓间充质干细胞的类肝样细胞分化能力研究
马 迪 施敏敏 严佶祺 陈雪华 计 骏 张佳年 彭承宏
·论著·
表达hTERT基因大鼠骨髓间充质干细胞的类肝样细胞分化能力研究
马 迪 施敏敏 严佶祺 陈雪华 计 骏 张佳年 彭承宏
目的对表达hTERT基因的大鼠骨髓间充质干细胞(Bone mesenchymal stem cells,BMSCs)进行成瘤风险评估及类肝样细胞分化能力的鉴定。方法将表达hTERT基因的大鼠BMSCs进行裸鼠致瘤试验评估成瘤风险,通过序贯法诱导成肝分化,于诱导后观察细胞形态变化、检测ALB和AFP的表达、糖原染色鉴定糖原储备能力。结果裸鼠致瘤实验提示表达hTERT基因的大鼠BMSCs无成瘤风险。成肝诱导后,细胞形态逐渐变为圆形;ALB仅在诱导第21天部分阳性表达,AFP在诱导第14天起阳性表达;糖原染色阳性。结论表达hTERT基因的大鼠BMSCs无致瘤风险,且具有类肝样细胞的分化能力。
人端粒酶逆转录酶骨髓间充质干细胞类肝样细胞
骨髓间充质干细胞(BMSCs)由于具备多向分化潜能,在特定诱导下可向多种细胞分化并行使相应功能,使其在组织工程和移植治疗中的具有极强的潜在价值[1-2]。另外,BMSCs具有很强的自我增殖能力,且能分泌多种细胞因子,在细胞移植技术的支持下,BMSCs对于治疗终末期肝病具有诱人的前景[3]。但由于缺乏端粒酶的活性,BMSCs的生存时间以及分化能力会随着细胞的增殖分裂而受到影响,外源性的hTERT导入可以提高BMSCs端粒酶活性,增殖分裂能力得到增强,且仍能保持其定向分化能力。有报道认为,转染hTERT的大鼠BMSCs向神经元分化的能力未受影响[4],且经hTERT基因改造的人脐带间充质干细胞同样具备成肝分化能力[5]。我们在前期研究中已获得稳定表达hTERT基因的大鼠BMSCs,其生物学特性已得到鉴定分析[6],本研究则通过相应的实验鉴定,对其成肝分化能力以及致瘤风险予以评估。
1 材料与方法
1.1 主要试剂与仪器
稳定表达hTERT基因的大鼠BMSCs(上海消化外科研究所保存并提供);HepG2细胞(上海消化外科研究所细胞库);4周龄裸鼠(BK实验动物有限公司);10%FBS、L-DMEM细胞培养基(Gibco,美国);ALB一抗、AFP一抗(SantaCruz,美国);HGF、FGF-4(PeproTech,美国);ITS(赛业生物科技有限公司);HRP标记鼠兔通用二抗、DAB显色试剂盒(DAKO,丹麦);糖原染色试剂盒(上海榕柏生物技术有限公司);恒温CO2细胞培养箱(Heraeus,德国);显微成像系统DS-U1(Nikon,日本)。
1.2 实验方法
1.2.1 表达hTERT基因的BMSCs成瘤风险的评估
裸鼠20只,随机分为4组。裸鼠体内分别注射以下细胞悬液:HepG2细胞(HepG2组)、稳定表达hTERT的BMSCs(MSC-hTERT组)、空载GFP的BMSCs(MSC-GFP组)和原代培养的MSC(MSC组)。
致瘤实验前一天,取数个1.5 mL EP管,锡纸密封包裹后,高压消毒备用;致瘤实验当天,胰酶消化收集MSC-hTERT、MSC-GFP、MSC、HepG2细胞,计数并制备成单细胞悬液,细胞密度1×107cells/mL。
无菌条件下细胞悬液加入EP管内,锡纸密封后,4℃条件转运入动物实验室,紫外线照射20 min后转入屏障环境。
各组裸鼠右前肢近腋窝皮下处注射相应组别细胞悬液0.2 mL,继续屏障环境内饲养2~3周,观察其局部注射点肿瘤生成情况,并评估致瘤风险。实验过程中对实验动物的处置符合实验动物伦理学。
1.2.2 表达hTERT的BMSCs定向分化为类肝样细胞能力的鉴定
依据文献[7]所述采用序贯成肝诱导方案,整个诱导过程共分为3个阶段。
第一阶段:基础培养液+FGF-4+HGF,诱导起第1~3天FGF-4和HGF的终浓度分别为10 ng/m L和20 ng/m L。
第二阶段:基础培养液+HGF,HGF浓度同前。诱导起第4~6天。
第三阶段:基础培养液+1×ITS+地塞米松+HGF,诱导起第7天起至诱导结束HGF浓度同前,地塞米松终浓度为20μg/L。
基础培养液:L-DMEM培养基+10%FBS,加入青霉素及链霉素双抗。
取状态良好的MSC-hTERT,接种于6孔板内,密度为2×104cells/cm2,待细胞融合达50%时,开始诱导分化,设对照组。诱导组于不同阶段添加相应诱导液,对照组以基础培养液代替诱导液,每3天换液。
诱导开始后,倒置显微镜观察两组细胞形态变化情况,记录形态变化时间。于诱导开始第7天、第14天、第21天、第28天收集诱导组及对照组细胞,进行细胞爬片、固定、封闭、添加相应一抗及二抗,完成免疫组化染色并测定诱导组及对照组各时间节点AFP和ALB蛋白表达情况。
收集第35天的诱导组及对照组细胞,制成细胞爬片。按糖原过碘酸雪夫染色液使用说明书进行糖原染色实验,显微镜下观察两组细胞糖原染色结果,鉴定两组细胞的糖原合成能力。
2 结果
2.1 表达hTERT基因的BMSCs成瘤风险评估
于各组裸鼠皮下注射相应细胞,饲养2~3周后观察发现,HepG2组裸鼠全部于注射部位形成皮下新生物,大小约在0.5 cm左右,而MSC-hTERT、MSC-GFP、MSC三组裸鼠注射部位皮下均未见肿瘤新生物形成,实验过程中未发生实验裸鼠死亡。
2.2 表达hTERT基因的BMSCs分化为类肝样细胞的鉴定结果
2.2.1 细胞形态的变化
成肝诱导初期,两组细胞形态没有明显差别,但在第三阶段诱导开始后,诱导组部分细胞长度逐渐缩短,形状变为椭圆形或不规则形,诱导3周后大部分细胞形态变为类圆形或者圆形,细胞体积也较对照组细胞更大(图1A)。而对照组细胞在实验过程中形态基本保持长梭形,未有明显改变(图1B)。
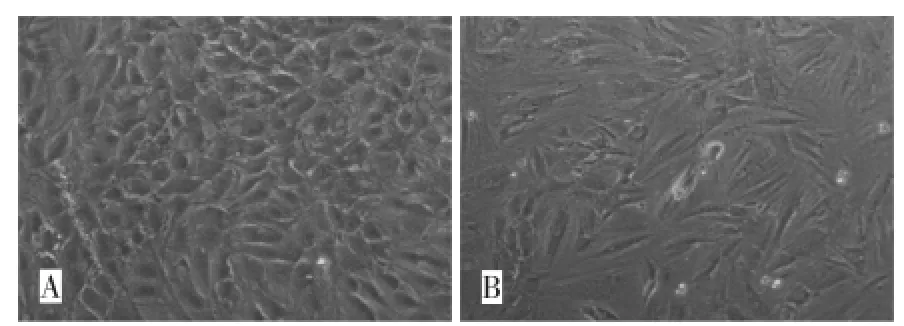
图1 细胞形态观察(200×)Fig.1 Cell morphology of MSC-hTERT(200×)
2.2.2 AFP及ALB的免疫组化染色结果
诱导组在分化诱导过程中除第21天AFP染色呈部分阳性外(图2A),其余各时间点均呈现阴性结果,而ALB在诱导第14天起开始出现弱阳性染色,第21天起呈现阳性染色(图2B),并随诱导时间的延长而阳性染色进一步明显。对照组无论AFP还是ALB在实验中各时间点染色均呈阴性结果。
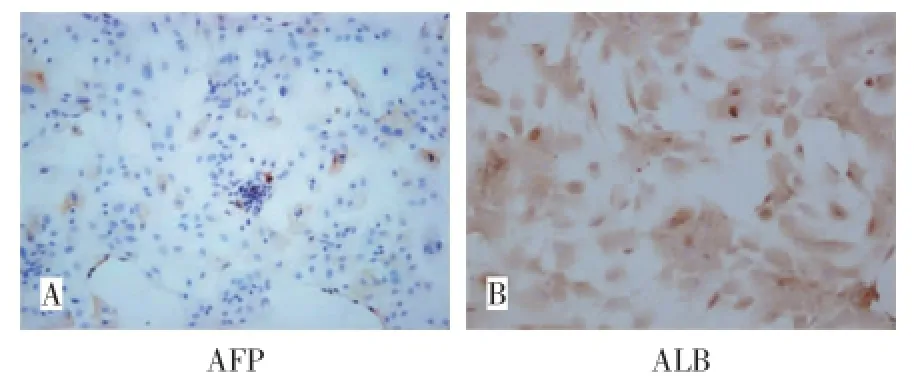
图2 成肝诱导第21天免疫组化染色结果(100×)Fig.2 Results of IHC staining at D21 after induction(100×)
2.2.3 糖原染色结果
诱导第35天行糖原染色,诱导组细胞糖原染色呈阳性,表现为胞浆中弥漫的红色或者紫红色致密颗粒物质(图3A)。对照组细胞呈现阴性,胞浆内未见红色阳性颗粒物或仅有少量浅红色物质(图3B)。
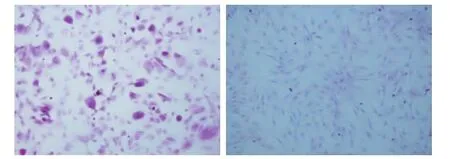
图3 糖原染色结果(100×)Fig.3 Results of PAS staining(100×)
3 讨论
由于BMSCs具备自我更新能力,经定向诱导后具有分化为肝细胞和类肝样细胞的潜能[8],为终末期肝病的治疗带来了希望。多项动物研究发现,移植BMSCs可显著改善受体肝功能,降低死亡率[9-10]。但是BMSCs无法长期增殖分裂的问题,促使对构建端粒酶永生化BMSCs细胞系开展研究。前期研究发现,通过基因工程技术,构建稳定表达hTERT基因的BMSCs细胞系,能保持原有的生物学特性,且增殖分裂能力加强,但是该类经基因工程改造的细胞是否安全无瘤,是否仍具备了定向分化为肝样细胞的能力,仍值得研究及讨论。
细胞的永生化与成瘤风险总是一对矛盾体,虽然hTERT介导的永生化细胞系其安全性更高,成瘤风险降低[11],但是基因改造后细胞可能的潜在致瘤性仍不容忽视。已有研究将端粒酶活性作为肿瘤检测的一个新标志,同时有研究显示异常表达的hTERT与多项肿瘤成正相关[12-13]。为此本实验中选用了HepG2细胞作为阳性对照,进行裸鼠皮下致瘤实验。经3周观察,HepG2细胞种植于裸鼠皮下后均形成肿瘤,而MSC-hTERT组、MSC-GFP组和MSC组细胞经皮下接种后均无成瘤倾向,显示了该类转hTERT基因的BMSCs细胞系安全稳定的无瘤特性。
多向分化潜能是BMSCs的一个重要特性,其向肝细胞的定向分化以及在细胞移植治疗方面的研究已逐渐成为热点[14]。由于BMSCs向肝样细胞的定向分化需要突破胚层限制,因此这一跨胚层分化的实现依赖于复杂的诱导微环境。以往的研究主要关注于各类不同诱导因子的单独或联合作用,而对于BMSCs的接种密度和细胞因子的诱导配方、诱导顺序等,存在不同看法。通过比对不同研究报道[15],我们确定了以HGF+FGF-4作为主要成肝诱导因子,并辅以地塞米松和ITS,通过序贯诱导方法,完成对BMSCs向类肝样细胞的诱导分化实验。
细胞因子和生长因子在定向分化中具有重要作用,也是分化研究中的热点和难点。HGF是肝细胞生长因子,在肝脏的发育成熟和再生过程中扮演重要角色,同时其在诱导干细胞向类肝样细胞分化过程中也具有明确而显著的作用[16]。而FGF-4作为体内一种重要的信号分子,协同HGF对促进肝细胞的发育及再生发挥了无法比拟的作用。另外,我们在实验过程中添加的胰岛素铁硒传递蛋白(Insulin-Transferrin-Selenium,ITS)和地塞米松两类辅助诱导因子,可在分化过程中诱导细胞表达重要转录因子HNF,以便更好地控制肝细胞的发育和行使相关功能。
在诱导过程中我们发现,细胞形态逐渐变为类圆形或不规则形,而这种变化也在诱导开始2~3周后更为明显。为了证明这种形态变化的细胞是否具备了类肝样细胞的功能,我们选择了AFP和ALB这两个肝系细胞标志物,在诱导的不同阶段通过免疫组织化学染色观察其表达的变化。免疫组化染色提示AFP仅在诱导第3周出现弱阳性结果,而ALB的阳性表达随着诱导的进行得到进一步加强。作为肝细胞分化早期表面标志的AFP,由肝前体细胞分泌,随着肝细胞的分化成熟其表达逐渐减少,而ALB则是成熟肝细胞的典型标志,结合以上两项结果,我们推断在诱导初期,表达hTERT基因的BMSCs可能定向分化为不成熟肝前体细胞并表达了一定量的AFP,随着进一步的诱导,此类细胞逐渐发育为更成熟的类肝样细胞,进而表达ALB这一反应肝细胞代谢活性的标志物。糖原合成能力是成熟肝细胞特有的功能,在糖原染色实验中我们进一步验证了表达hTERT基因的BMSCs诱导后具备糖原合成能力,间接提示其已具有部分成熟肝细胞的功能。
本实验提示,表达hTERT的BMSCs安全无致瘤性,同时经定向诱导后具备分化为类肝样细胞的能力,并显示出成熟肝细胞的部分特性,结合hTERT赋予细胞的“永生化”可能性,其将为组织工程以及肝细胞移植治疗的研究提供新的思路和补充。
[1]Otto WR,Wright NA.Mesenchymal stem cells:from experiment to clinic[J].Fibrogenesis Tissue Repair,2011,4(1):20.
[2]李佳滨,张文杰,崔福斋,等.P17-BMP2多肽促进大鼠骨髓间充质干细胞成骨分化的实验研究[J].组织工程与重建外科杂志, 2012,8(2):65-68.
[3]Yagi K,Kojima M,Oyagi S,et al.Application of mesenchymal stem cells to liver regenerative medicine[J].Yakugaku Zasshi, 2008,128(1):3-9.
[4]张晓辉,张建宁,康春生,等.hTERT正、反义表达载体转染大鼠骨髓间充质干细胞的实验研究[J].中华神经医学杂志,2006,5 (3):217-221.
[5]Liang XJ,Chen XJ,Yang DH,et al.Differentiation of human umbilical cord mesenchymal stem cells into hepatocyte-like cells by hTERT gene transfection in vitro[J].Cell Biol Int,2012,36(2): 215-221.
[6]马迪,严佶祺,彭承宏,等.表达hTERT的大鼠骨髓间充质干细胞生物学特性研究[J].组织工程与重建外科,2013,9(5):256-259.
[7]Snykers S,Vanhaecke T,Papeleu P,et al.Sequential exposure to cytokines reflecting embryogenesis:the key for in vitro differentiation of adult bone marrow stem cells into functional hepatocyte-like cells[J].Toxicol Sci,2006,94(2):330-341.
[8]Schwartz RE,Reyes M,Koodie L,et al.Multipotent adult progenitor cells from bone marrow differentiate into functional hepatocyte-like cells[J].J Clin Invest,2002,109(10):1291-1302.
[9]Van Poll D,Parekkadan B,Cho CH,et al.Mesenchymal stem cell-derived molecules directly modulate hepatocellular death and regeneration in vitro and in vivo[J].Hepatology,2008,47(5): 1634-1643.
[10]Kuo TK,Hung SP,Chuang CH,et al.Stem cell therapy in liver disease:parameters governing the success of using bone marrow mesenchymalstem cells[J].Gastrenterology,2008,134(7):2111-2121.
[11]Toouli CD,Huschtseha LI,Neumann AA,et a1.Comparison of human mammary epithelial cell immortalized by simian virus 40 T Antigen or by the telomerase catalytic subunit[J].Oncogene, 2002,21(1):128-139.
[12]Bzarov AV,Hines WC,Mukhopadhyay R,et al.Telomerase activation by c-Myc in human mammary epithelial cells requires additional genomic changes[J].Cell Cycle,2009,8(20):3373-3378.
[13]张业伟,牛坚,赵何伟,等.干细胞表面标志物CD90及端粒酶逆转录酶在原发性肝癌中的表达及临床意义[J].中华肝胆外科杂志,2012,18(1):37-39.
[14]Piryaei A,Valojerdi MR,Shahsavani M,et al.Differentiation of bone marrow-derived mesenchymal stem cells into hepatocytelike cells on nanofiber and their transplantation into a carbon tetrachloride-induced liver fibrosis model[J].Stem Cell Rev, 2011,7(1):103-118.
[15]Pournasr B,Mohamadnejad M,Bagheri M,et al.In vitro differentiation of human bone marrow mesenchymal Stem Cells into hepatocyte-like Cells[J].Arch Iran Med,2011,14(4):244-249.
[16]Oh SH,Miyazaki M,Kouchi H,et al.Hepatocyte growth factor induces differentiation of adult rat bone marrow cells into a hepatocyte lineage in vitro[J].Biochem Biophys Res Commun, 2000,279(2):500-504.
Hepatic Differentiation Potential of hTERT Gene Transfected Bone Marrow Mesenchymal Stem Cells in Rats
MA Di,SHI Minmin,YAN Jiqi,CHEN Xuehua,JI Jun,ZHANG Jianian,PENG Chenghong.Department of General Surgery, Ruijin Hospital,Shanghai Jiaotong University School of Medicine,200025 Shanghai,China.Corresponding author:YAN Jiqi (E-mail:yanjiqi@aliyun.com).
ObjectiveTo estimate the oncogenicity of hTERT gene transfected rat BMSCs and to identify its hepatic differentiation potential.MethodsThe oncogenicity of hTERT gene transfected rat BMSCs was estimated by tumorigenesis test in nude mouse.Then the hTERT gene transfected rat BMSCs were induced for hepatic differentiation by sequential method.The change of cell morphology was observed,the expression of ALB and AFP were detected,and the ability of glycogen storage was tested by PAS stain.ResultsTumorigenesis test of nude mouse suggested no oncogenic risk of hTERT gene transfected rat BMSCs.After hepatic induction,the induced cells became round in shape.A few ALB(+)cells were observed only at D21 after induction while more and more AFP(+)cells were observed started from D14 after induction.The result of PAS stain was positive.ConclusionThe hTERT gene transfected rat BMSCs have the potential of hepatic differentiation with no oncogenicity.
Human telomerase reverse transcriptase;Bone marrow mesenchymal stem cells;Hepatocyte-like cells
Q813.1+1
A
1673-0364(2014)05-0247-04
2014年5月7日;修复日期:2014年6月20日)
10.3969/j.issn.1673-0364.2014.05.003
国家自然科学基金(81070358)。
200025上海市上海交通大学医学院附属瑞金医院普外科。
严佶祺(E-mail:yanjiqi@aliyun.com)。

