大豆异黄酮对负载于脱细胞羊膜上软骨细胞增殖及其IGF-1 mRNA基因表达的影响
郭小明, 赵文君, 白人骁, 邢国胜*
(1.天津中医药大学,天津300073;2.天津市中西医结合骨科研究所,天津300211)
软骨缺损后,由于其缺乏神经血管营养的供应,难以自身修复。组织工程软骨的构建为软骨缺损的修复开辟了一条新的途径。羊膜是一种重要的细胞支架[1-2],可以为细胞生长输送营养及排泄代谢产物的三维多孔结构的细胞载体,其有很好的生物相容性,不表达白细胞抗原,排斥反应低,含有胶原、糖蛋白并且可以表达多种生长因子及其mRNA的相关蛋白。目前限制组织工程软骨进展的是种子细胞问题,最理想的种子细胞是自体软骨细胞。研究报道要形成组织工程软骨起始接种的软骨细胞密度要达到107个/mL,然而软骨细胞传代3次后会出现去分化现象,失去表型,要达到起始接种浓度将要消化大块的软骨组织块,这将会对身体造成新的损害,过高的起始接种浓度限制了组织工程软骨临床的应用。前期实验研究10-9、10-8、10-7mol/L浓度的大豆异黄酮对体外软骨细胞的增殖与分化有促进作用[3],大豆异黄酮对负载于脱细胞羊膜上软骨细胞的增殖与分化是否有促进作用,本实验研究这三种浓度的大豆异黄酮对负载于脱细胞羊膜上的软骨细胞增殖与分化的影响,为解决起始接种浓度奠定基础,为将其应用于临床奠定基础。
1 材料与方法
1.1 材料 4周龄兔子由天津医院动物室提供,无菌胎盘由天津中心妇产医院惠赠;Ⅱ型胶原酶(美国Sigma公司,批号C6885);胰蛋白酶 (天津市灏洋生物制品有限责任公司,批号9AC10360);DMEM/F-12培养基 (美国 Gibco公司,批号15200096);MTT(美 国 Sigma公 司,批 号9BT10330);大豆异黄酮 (华北制药股份有限公司,批号20110104);二甲基亚砜 (分析纯,上海生工生物工程有限公司,批号081228);亚甲蓝注射液 (江苏济川制药有限公司);甲苯胺蓝 (中国医药集团上海化学试剂公司);Trizol(美国invitrogen公司,批号1373343);三氯甲烷 (天津市恒昊科工贸有限公司,批号200000816);异丙醇 (天津市化学试剂二厂);无水乙醇 (天津市方得科技有限公司,批号20080722);SYBR Premix Ex Taq(TaKaRa,BKA805);PrimScript RT reagent Kit(TaKaRa,DRR037A);DEPC(BD Science,批 号D-5758);酶标仪 (美国Dynex);倒置显微镜 (日本Olympus公司);96孔、24孔、6孔细胞培养板(美国 Costar公司);细胞培养瓶 (美国 Costar公司);二氧化碳培养箱 (英国RS Bitech公司)。
1.2 方法
1.2.1 软骨细胞的分离及传代培养 参考文献[4]方法加以改进。取健康4周龄幼兔,处死后在无菌条件下取双上、下肢关节的软骨,Hank’s液冲洗。剪碎至1 mm3大小,依次用0.25%胰蛋白酶、0.2%Ⅱ型胶原酶消化,终止消化后,取消化液于1 500 r/min离心8 min,弃上清,加入含10%胎牛血清的DMEM/F-12培养液中重悬细胞,接种到75 cm2培养瓶中,置于37℃、5%CO2、饱和湿度的培养箱中培养,隔日换液。待培养瓶底单层软骨细胞达80%时进行传代。
1.2.2 软骨细胞的组织化学染色鉴定 参考Terry等[5]、Green[6]方法加以改进。吸出培养板中的培养液,PBS冲洗3遍,10%中性福尔马林中固定过夜,70%乙醇固定20 min。用0.04%甲苯胺蓝染色20 min,迅速用无水乙醇漂洗1次,倒置显微镜下观察、拍照。
1.2.3 脱细胞羊膜的制备 参考文献 [7]方法加以改进。取无菌胎盘钝性分离羊膜后,用PBS液反复冲洗,去除表面的杂质。将羊膜放于同体积0.25%胰蛋白酶和0.12%EDTA的消化液中消化4 h,用PBS液冲洗3遍,无菌棉签擦去羊膜表面残留的细胞。任取一小块羊膜平铺于载玻片上,滴加亚甲蓝染液,5 min后倒置显微镜下观察。
1.2.4 脱细胞羊膜负载软骨细胞 将羊膜分割为(1×1)cm2大小,将其置于无菌载玻片上,将边缘折于载玻片背侧,分别置于24孔、6孔细胞培养板中。取体外培养的第三代软骨细胞接种其上。
1.2.5 大豆异黄酮对负载于脱细胞羊膜上软骨细胞增殖的影响 取脱细胞羊膜负载第三代软骨细胞的24孔板,实验组分别加入含有10-7、10-8、10-9mol/L浓度的大豆异黄酮DMEM/F-12培养液,对照组给予 DMEM/F-12培养液。接种2、3、4、5、6 d分别于同一时间每孔加入5 g/L的MTT 60 μL,继续孵育 4 h,弃上清,加入 DMSO 600 μL/孔,震荡10 min,使结晶完全溶解,将每孔的上清液移至96孔板中,立即用酶标仪在570 nm波长处测定。
1.2.6 大豆异黄酮对负载于脱细胞羊膜上软骨细胞胰岛素样生子因子 (IGF-1)mRNA表达的影响 取脱细胞羊膜负载第三代软骨细胞的6孔板,实验组分别加入含有10-7、10-8、10-9mol/L浓度的大豆异黄酮DMEM/F-12培养液,对照组给予DMEM/F-12培养液。培养4 d后,分别加入1 mL Trizol,按试剂盒步骤进行RNA提取。应用软件OIigo 6,根据GenBank所发布的IGF-1、β-actin基因序列进行设计,IGF-1序列为上游5’-GGTGGATGCTCTTCAGTTCG-3’,下游 3’-CTCCAGCCTCCTCAGATCAC-5’产物大小为136 bp。逆转录:参照文献 [8],在0.5 mL无RNA酶的离心管中依次加入 5 ×RT Buffer 4 μL,逆转录酶混合物 1 μL,寡聚胸腺嘧啶引物 [Oligo(dT)]1 μL,随机引物(100 μmol/L)1 μL,总 RNA 2 μg,加焦碳酸二乙酯水,补足至20 μL。移液器吹打混匀,顺时离心3 s,37℃,15 min,85℃5 s后于-20℃保存。按照SYBR Green PCR Master Mix试剂盒说明书用Real-time PCR进行定量检测。
1.3 统计学处理 采用SPSS 11.5统计软件进行单因素方差分析 (LSD)。计量资料数据以±s表示,P<0.05差异有统计学意义,P>0.05差异无统计学意义。
2 结果
2.1 软骨细胞的生长情况 倒置显微镜下观察显示,原代分离的软骨细胞贴壁后,细胞呈三角形或梭形,培养5 d后,细胞已融和成片,呈典型的“铺路石”状 (图1)。
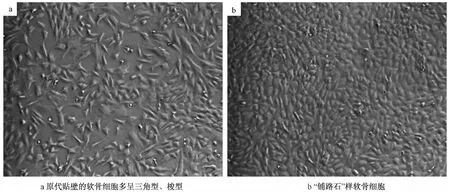
图1 原代软骨细胞的形态 (倒置显微镜,×200)Fig.1 Morphologry of primary culture chondrocytes(inverted microscope, ×200)
2.2 脱细胞羊膜的观察 倒置显微镜下观察,未做脱细胞处理的羊膜亚甲蓝染色见羊膜上大量深蓝色的异染颗粒 (图2),羊膜经脱细胞处理后无深蓝色异染颗粒 (图3)。
2.3 脱细胞羊膜与软骨细胞的复合 倒置显微镜下观察,未负载软骨细胞的羊膜,其表面高低不平(图4),与软骨细胞复合后1 d,可见软骨细胞生存状态良好,部分软骨细胞伸出伪足 (图5)。甲苯胺蓝染色结果显示:软骨细胞基质呈蓝染色,细胞核呈深蓝色,细胞呈三角形,圆形或梭形(图6)。
图2 未脱细胞的羊膜 (亚甲蓝染色,倒置显微镜,×100)Fig.2 Untreated amniotic(stained by methylene blue,inverted microscope, ×100)

图3 脱细胞羊膜亚甲蓝染色 (亚甲蓝染色,倒置显微镜,×100)Fig.3 Treated amniotic(stained by methylene blue,inverted microscope, ×100)
2.4 大豆异黄酮对负载于脱细胞羊膜上软骨细胞增殖的影响 培养第2天时,10-9、10-8、10-7mol/L组软骨细胞的增殖与对照组软骨细胞增殖基本一样 (P>0.05),第3天时,只有10-7mol/L组软骨细胞的增殖高于对照组 (P<0.05),从第4天开始,10-9、10-8、10-7mol/L组软骨细胞的增殖均高于对照组 (P<0.05)。10-7mol/L组对软骨细胞的增殖效果更加明显 (见表1)。
2.5 不同浓度大豆异黄酮对负载于脱细胞羊膜上软骨细胞IGF-1 mRNA表达的影响 以对照组为标准,10-9、10-8、10-7mol/L组 IGF-1 mRNA的相对表达量均高于对照组,并且具有剂量依赖性,10-7mol/L组最明显 (表2)。

图4 未复合软骨细胞的脱细胞羊膜 (倒置显微镜,×200)Fig.4 Cell-free amniotic membrance without chondrocytes(inverted microscope, ×200)
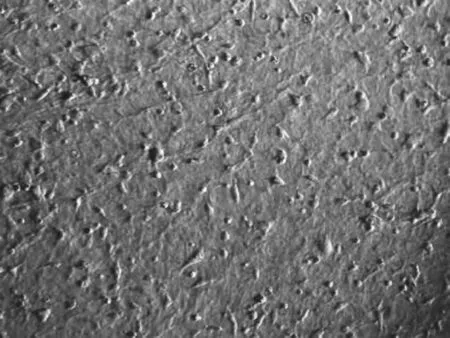
图5 软骨细胞与脱细胞羊膜复合,部分伸出伪足 (倒置显微镜,×200)Fig.5 Some chondrocytes adhere in the decellularized amniotic membrance streched out pseudopodium(inverted microscope, ×200)
表1 大豆异黄酮对负载于脱细胞羊膜上软骨细胞增殖的影响 (±s,n=5)Tab.1 Effect of soy isoflavones with various concentrations on the chondrocyte proliferation detected(±s,n=5)
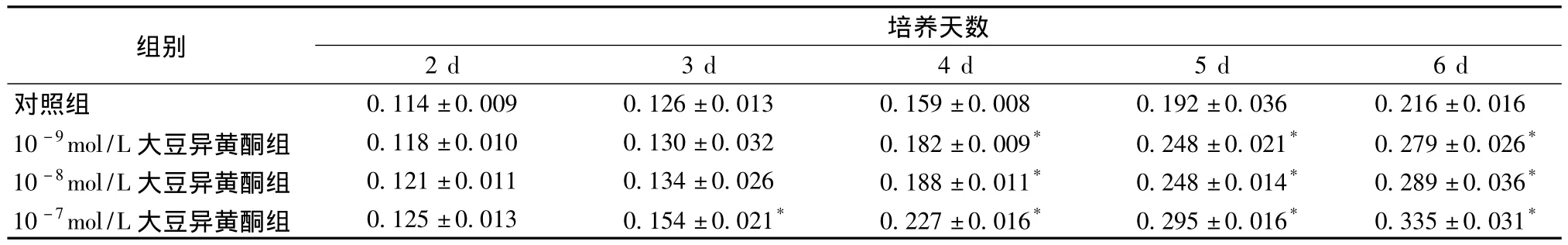
表1 大豆异黄酮对负载于脱细胞羊膜上软骨细胞增殖的影响 (±s,n=5)Tab.1 Effect of soy isoflavones with various concentrations on the chondrocyte proliferation detected(±s,n=5)
注:与对照组比较,*P<0.05
0.036 0.216±0.016 10-9mol/L大豆异黄酮组 0.118±0.010 0.130±0.032 0.182±0.009* 0.248±0.021* 0.279±0.026*10-8mol/L大豆异黄酮组 0.121±0.011 0.134±0.026 0.188±0.011* 0.248±0.014* 0.289±0.036*10-7mol/L大豆异黄酮组 0.125±0.013 0.154±0.021* 0.227±0.016* 0.295±0.016* 0.335±0.031 2 d 3 d 4 d 5 d 6 d对照组 0.114±0.009 0.126±0.013 0.159±0.008 0.192±组别 培养天数*
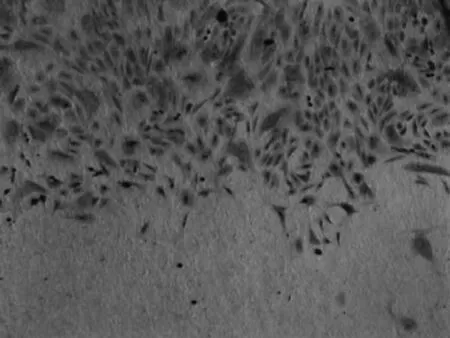
图6 负载于脱细胞羊膜上软骨细胞 (甲苯胺蓝染色,倒置显微镜,×200)Fig.6 Chondrocytes cultured on the decellularized amniotic membrance(stained by toluidine blue,inverted microscope, ×200)
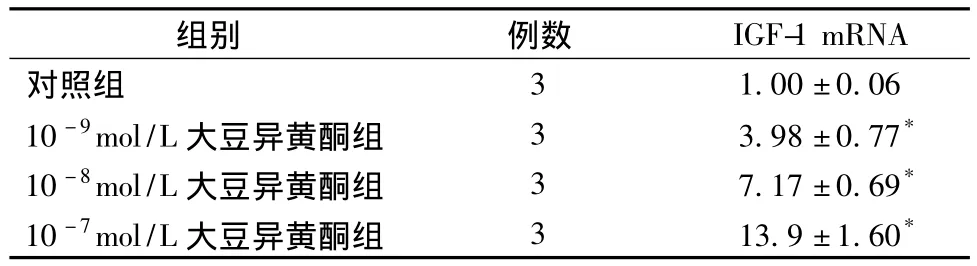
表2 不同浓度大豆异黄酮作用下IGF-1 mRNA的相对表达量Tab.2 Relative transcript level of IGF-1 under soy isoflavones with various concentrations
3 讨论
关节软骨缺乏直接的血液供应、淋巴细胞和神经支配,并且生理代谢有一定的特点,受损后很难自身修复。目前国内外对软骨损伤的修复研究主要集中在关节清创术、软骨细胞移植术、软骨钻孔术、组织化工程软骨,其中关节清创术对早期关节炎疗效显著,但是远期疗效有待进一步证实,软骨细胞移植对大面积的软骨缺损显得无能为力,软骨下钻孔术其形成的修复组织复杂,且耐磨性较差,组织工程化软骨被认为最有应用前景的关节软骨修复材料。目前组织化工程软骨修复软骨缺损的实验研究已取得了一定的成果,但是临床应用却是很少,限制其临床应用的主要问题是种子细胞问题,种子细胞的来源主要有软骨细胞,骨髓间充质细胞,其中最理想的种子细胞是自体软骨细胞。Puelacher等[9]将软骨细胞接种到支架上再将其植入裸鼠的皮下组织,发现当密度低于1×107个/mL时在皮下很少有软骨组织形成。张瑛等[10]将不同浓度的软骨细胞接种到PLGA支架上发现,体外形成兔软骨组织的适宜细胞接种密度为4×107个/mL,这两个实验的研究结果都说明,要形成组织工程软骨将需要大量的软骨细胞,然而软骨细胞在体外传到第四代时就会发生去分化现象,因此获得大量的软骨细胞,必然需要大块的软骨组织,大量的软骨块将会对身体产生新的损伤。本实验研究显示,10-7mol/L浓度的大豆异黄酮仍可明显促进负载于羊膜上软骨细胞的增殖,这预示着,接种软骨细胞时,可以降低起始接种的浓度,这样可以减少软骨组织的消耗,使得组织工程软骨的临床应用更近一步。但是减少起始接种浓度后促进负载于脱细胞羊膜上软骨细胞的增殖,是否与高浓度接种形成的软骨组织一样,还需进一步的研究。
IGF-1是人体内一种重要的细胞因子,可以通过自分泌、旁分泌、内分泌方式与细胞膜上的特异性受体结合,对软骨细胞的生长发育有重要的作用[11]。研究证实,IGF-1在10 g/L时,可明显促进软骨细胞的增殖,达到50 g/L时,增殖活跃性达到最高[12],还可以促进软骨细胞合成Ⅱ型胶原和蛋白多糖,维持软骨细胞的表型[13-14]。并且还可通过组织软骨基质中金属蛋白酶的表达,起到抑制蛋白多糖退变的作用[15-16]。本实验研究显示,不同浓度的大豆异黄酮均可促进负载于脱细胞羊膜上软骨细胞分泌IGF-1,分泌的IGF-1不仅可以促进软骨细胞的增殖,并且还可维持软骨细胞表型,这样使得形成的组织工程软骨的质量更好,为临床应用奠定了一定的基础。
[1]Niknejad H,Peirovi H,Jorjani M,et al.Properties of the amniotic membrane for potential use in tissue engineering[J].J Eur Cell Mater,2008,15:88-99.
[2]Díaz-Prado S,Rendal-Vázquez M E,Hermida-Gómez T,et al.Potential use of the human anmiotic membrane as a scaffold in human articular cartilage repair[J].Cell Tissue Bank,2010,11(2):183-195.
[3]黄武君.大豆异黄酮对体外关节软骨细胞的影响[D].天津:天津医科大学,2007.
[4]马 勇,张允申,陈金飞,等.威灵仙干预体外培养兔膝关节软骨细胞增殖及转化生长因子βmRNA基因的表达[J].中国组织工程研究与临床康复,2010,14(11):1901-1906.
[5]Terry D E,Chopra R K,Ovenden J,et al.Differential use of alcian blue and toluidine blue dyes for quantification and isolation of anionic glycoconjugates from cell culture:application to proteoglycans and a high-molecular-weight glycoprotein synthesized by articular chondrocytes[J].Anal Biochem,2000,285(2):211-219.
[6]Green W T.Behavior of articular chondrocyte in cell culture[J].Clin Orho,1971,75(A):248-260.
[7]肖光礼,聂 卫,高 萍,等.脱细胞羊膜制备及生物学评价[J].生物医学工程,2009,16(1):1-4.
[8]赵文君,崔爽爽,邢国胜,等.类风湿关节炎滑膜成纤维细胞对T淋巴细胞生物学行为的干预作用[J].天津医药,2012,40(11):1092-1094.
[9]Puelacher W C,Kim S W,Vacanti J P,et al.Tissue-engineered growth of cartilage:The effect of varying the concentration of chondrocytes seeded onto synthetic polymer matrices[J].Int J Oral Maxillofac Surg,1994,23(1):49-53.
[10]张 瑛,范卫民,陈哲峰.组织工程化软骨形成的细胞浓度选择[J].江苏医药,2005,31(10):762-764.
[11]Duan C,Ren H,Gao S.Insulin-like growth factors(IGFs),IGF receptors,and IGF-binding proteins:Roles in skeletal muscle growth and differentiation[J].Gen Comp Endocrinol,2010,167(3):344-351.
[12]黄建荣,李卫平,沈慧勇.胰岛素样生长因子Ⅰ与透明质酸对人关节软骨细胞的作用[J].中华生物医学工程杂志,2008,3(14):180-184.
[13]Macrae V E,Horvat S,Pells S C,et al.Increased bone mass,altered trabecular architecture and modified growth plate organization in the growing skeleton of SOCS2 deficient mice[J].J Cell Physiol,2009,218(2):276-284.
[14]Segev Y,Berdugo-Boura N,Porati O,et al.Upper airway loading induces growth retardation and change in local chondrocyte IGF-1 expression is reversed by stimulation of GH release in juvenile rats[J].J Appl Physiol,2008,105(5):1602-1609.
[15]Zhang M,Zhou Q,Liang Q Q,et al.IGF-1 regulation of typeⅡcollagen and MMP-13 expression in rat endplate chondrocytes via distinct signaling pathways[J].Osteoarthritis Cartilage,2009,17(1):100-106.
[16]柏 涛,舒 钧,王建龙,等.兔自体细胞-载体复合物修复关节软骨缺损的实验研究[J].中国修复显微外科杂志,2008,22(4):487-491.

