黄秋葵果实粉对衰老模型小鼠抗氧化能力的影响
陈艳珍,宋新华
(山东理工大学生命科学学院,山东淄博255049)
黄秋葵(OKra)属锦葵科(Malvaceae)秋葵属(A belmoschus Medic)的一个种,一年生草本植物,又名秋葵、补肾草、咖啡葵等。黄秋葵是一种营养保健蔬菜,其果实富含氨基酸、维生素、矿物质元素、多糖和黄酮类化合物以及大量不饱和脂肪酸,具有多种营养和保健功能[1-3]。另有实验表明,新鲜阴干的黄秋葵果实水提液、乙醇提取物分别具有抗疲劳[4-5]和保护四氯化碳诱导的大鼠急性化学性肝脏氧化损伤的作用[6]。但有关黄秋葵果实粉(OFP)体内抗氧化作用的研究国内外尚鲜见报道。本研究探讨OFP 对衰老小鼠体内抗氧化能力的影响,为黄秋葵的进一步开发利用提供科学参考。
1 材料与方法
1.1 材料
1.1.1 材料与试剂
D-半乳糖:美国Sigma 公司生产;超氧化物歧化酶(SOD)、谷胱甘肽过氧化物酶(GSH-Px)、过氧化氢酶(CAT)、丙二醛(MDA)、考马斯亮兰蛋白测定试剂盒:南京建成生物工程研究所提供。
1.1.2 主要仪器
Biofuge Stratos 型台式低温高速离心机:德国贺利氏;F25 电动匀浆器:上海弗鲁克设备有限公司;HWS-26 型数显恒温水浴锅:上海一恒科技有限公司;UV755B 紫外-可见分光光度计:上海分析仪器总厂;FC204 电子天平:上海精密科学仪器公司;723 可见分光光度计:上海光谱仪器有限公司。
1.1.3 动物分组与处理
昆明种小白鼠50 只,体重(20±2)g,山东大学动物实验中心提供。用基础饲料(山东大学动物实验中心提供)喂养1 周以适应环境。之后将小鼠随机分为五组,每组10 只(雌雄各半):正常对照组、衰老模型对照组均饲喂基础饲料,低剂量组、中剂量组和高剂量组饲喂用黄秋葵果实粉(淄博济世保健食品科技有限公司提供)替代等量基础饲料的试验饲料(替代量依次为32.00、64.00、128.00 g/kg)。除正常组外,其余各组均每日颈背部皮下注射400 mg/kg·bw 的D-半乳糖0.2 mL(D-半乳糖以灭菌生理盐水配置),正常组注射等量生理盐水,每天定时注射,连续56 d。小鼠同室分笼饲养(每笼5 只),保持卫生清洁、光照充足,自由采食和饮水。每天进行常规观察,包括动物外观、体征、行为活动等,每周称体重一次,根据小鼠体重变化调整注射量。
1.2 方法
1.2.1 组织样品的制备
于实验末日禁食12 h 后,称重,眼底采血、血液冷冻离心分离血清;颈椎脱臼处死小鼠,快速分离肝脏组织置于4 ℃生理盐水中,洗净表面残留血液用滤纸吸干,立即称湿重,加入预冷的生理盐水,高速匀浆,制成10%的组织匀浆液。所有样品均在0 ℃左右保存,2 d 内完成测定。
1.2.2 检测指标
血清和肝脏匀浆中SOD、CAT、GSH-Px 和MDA的测定均按照试剂盒说明书方法测定,蛋白质含量测定采用考马斯亮兰法。
1.2.3 数据统计分析
2 结果
2.1 黄秋葵果实粉对小鼠血清抗氧化功能的影响
黄秋葵果实粉对小鼠血清抗氧化功能的影响见表1。对小鼠血清中MDA、SOD、GSH-Px 及CAT 指标进行测定,由表1可以看出,模型组与正常组各指标均存在显著性差异(P<0.05)。与模型组相比,各剂量组MDA 含量均有不同程度下降;SOD、GSH-Px、CAT 活性均有一定程度升高。结果表明,低剂量组可降低小鼠血清中MDA 含量及提高SOD、GSH-Px、CAT 活性,但无统计学意义;中、高剂量组SOD、GSH-Px 和CAT活性明显高于模型组(P<0.05),MDA 含量显著低于模型组(P<0.05)。
表1 黄秋葵果实粉对小鼠血清抗氧化功能的影响Table1 Effect of Okra fruit powder on the serum antioxidant activity of aged mice(±s,n=10)
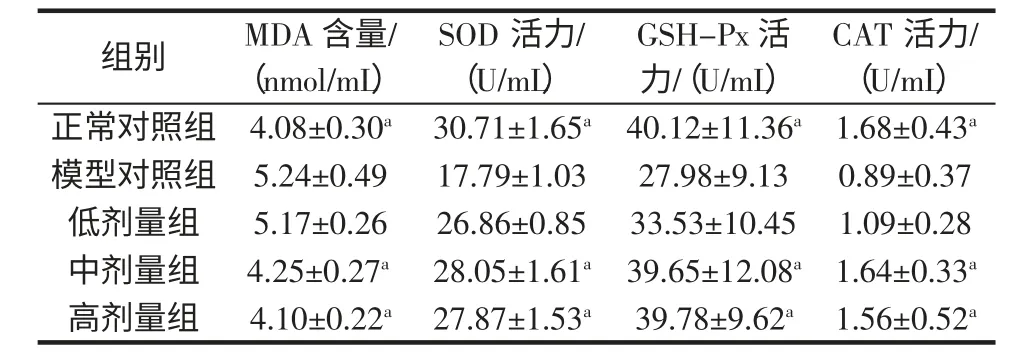
表1 黄秋葵果实粉对小鼠血清抗氧化功能的影响Table1 Effect of Okra fruit powder on the serum antioxidant activity of aged mice(±s,n=10)
注:与模型组相比较,a 为P<0.05;b 为P<0.01。
CAT 活力/(U/mL)正常对照组 4.08±0.30a 30.71±1.65a 40.12±11.36a 1.68±0.43a模型对照组 5.24±0.49 17.79±1.03 27.98±9.13 0.89±0.37低剂量组 5.17±0.26 26.86±0.85 33.53±10.45 1.09±0.28中剂量组 4.25±0.27a 28.05±1.61a 39.65±12.08a 1.64±0.33a高剂量组 4.10±0.22a 27.87±1.53a 39.78±9.62a 1.56±0.52a组别 MDA 含量/(nmol/mL)SOD 活力/(U/mL)GSH-Px 活力/(U/mL)
2.2 黄秋葵果实粉对小鼠肝脏组织抗氧化功能的影响
黄秋葵果实粉对小鼠肝脏组织抗氧化功能的影响见表2。
表2 黄秋葵果实粉对小鼠肝脏组织抗氧化功能的影响Table2 Effect of Okra fruit powder on the liver antioxidant activity of aged mice(±s,n=10)
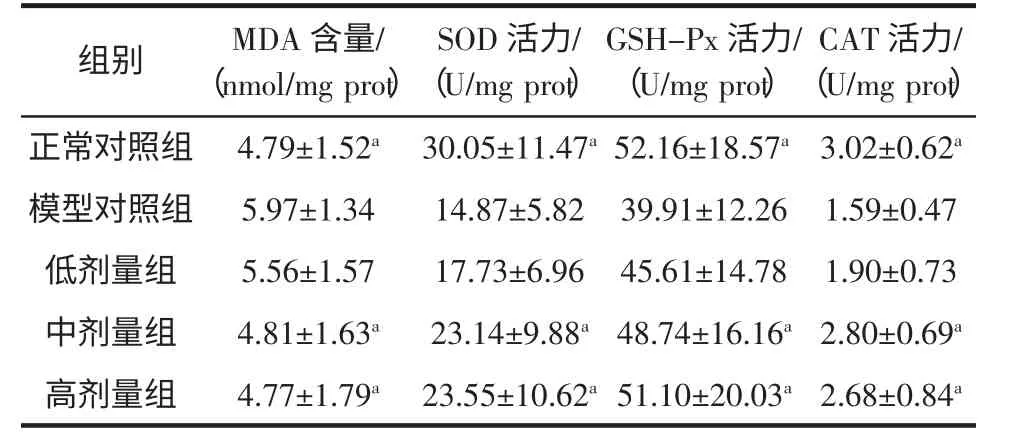
表2 黄秋葵果实粉对小鼠肝脏组织抗氧化功能的影响Table2 Effect of Okra fruit powder on the liver antioxidant activity of aged mice(±s,n=10)
注:与模型组相比较,a 为P<0.05;b 为P<0.01。
CAT 活力/(U/mg prot)正常对照组 4.79±1.52a 30.05±11.47a 52.16±18.57a 3.02±0.62a模型对照组 5.97±1.34 14.87±5.82 39.91±12.26 1.59±0.47低剂量组 5.56±1.57 17.73±6.96 45.61±14.78 1.90±0.73中剂量组 4.81±1.63a 23.14±9.88a 48.74±16.16a 2.80±0.69a高剂量组 4.77±1.79a 23.55±10.62a 51.10±20.03a 2.68±0.84a组别 MDA 含量/(nmol/mg prot)SOD 活力/(U/mg prot)GSH-Px 活力/(U/mg prot)
从表2小鼠肝脏组织匀浆液中MDA、SOD、GSHPx 及CAT 的测定数据可以看出,模型组与正常组肝脏组织匀浆中各指标均差异显著(P<0.05);不同剂量黄秋葵果实粉能提高肝脏组织中SOD、GSH-Px 及CAT 活性,降低MDA 含量,中、高剂量组与模型组比较有显著差异(P<0.05)。
3 讨论
衰老是一种渐进而复杂的生物过程,是所有生物的共同特征。体内代谢过程中会产生自由基,正常情况下,体内自由基的产生与消除应处于平衡状态。人体内存在清除自由基的抗氧化酶,包括SOD、GSHPX、CAT 等抗氧化酶系。随着年龄的增长,抗氧化酶类活性下降,使体内消除自由基的能力下降,体内过量的自由基就会引起脂质过氧化,损伤生物膜,影响细胞功能,进而导致疾病和衰老[7]。
小鼠长期注射D-半乳糖可造成全身代谢紊乱,破坏并消耗机体抗氧化物质,并不断产生自由基导致细胞组织受损,从而造成实验性衰老模型。我们在前面的实验中观察到:饲养56 d 后,模型组与正常组比较,模型组增重、胸腺指数和脾脏指数显著降低,小鼠皮毛粗糙,精神状态较差[8]。本研究表明,相对正常组小鼠,D-半乳糖模型组小鼠的血清、肝组织中SOD、GSH-Px 和CAT 活性明显降低(P<0.05),MDA 含量明显升高(P<0.05)。这些结果与许多文献报道一致[9-10],说明本模型有可靠性。
SOD 作为体内重要氧自由基清除剂,在保护细胞不受毒性自由基的损伤方面发挥着重要的作用,它的活性高低间接反映了机体清除氧自由基能力。本研究发现,与模型组相比,不同剂量组小鼠血清和肝脏中的SOD 活性均有所提高,这说明在饲料中添加一定剂量OFP 可抑制D-半乳糖诱导衰老小鼠SOD 活性的降低。
GSH-Px 是动物机体内广泛存在的一种重要的催化过氧化氢分解的酶,有清除过氧化物和保护细胞免于氧化损伤的重要作用,因此其活性变化也可反映机体抗氧化能力的变化。CAT 是体内清除自由基的关键酶,可清除过氧化体系中的H2O2,以减少自由基和过氧化脂质的形成,对机体起着重要的保护作用,它的活性高低间接反映了机体清除氧自由基能力。本实验结果表明,中、高剂量组小鼠血清和肝脏中GSH-Px 和CAT 活性均显著高于模型组(P<0.05)。
MDA 是脂质过氧化反应的最终代谢产物,其含量高低可以反映机体脂质氧化水平,在一定程度上间接反映细胞损伤的程度。本研究发现,在饲料中添加一定剂量OFP 可不同程度的对抗D-半乳糖所致的血清和肝脏组织中MDA 的增加,中、高剂量组MDA 含量均显著低于模型组(P<0.05)。
综上所述,OFP 可不同程度的降低D-半乳糖致衰小鼠血清和肝脏中MDA 含量,提高机体内三种主要抗氧化酶SOD、GSH-Px 和CAT 的活性,中、高剂量效果均显著,从而能延缓由于注射D-半乳糖引起小鼠体内的衰老变化。结合我们在前面的实验中对OFP 主要成分的检测[8],可以初步推论黄秋葵果实粉可能是通过其中含有的丰富多糖、黄酮等活性物质,通过代谢途径提高机体内源性SOD、GSH-Px 和CAT 的活性,再通过这些酶降低机体氧化应激水平,防止脂质过氧化反应,减少MDA 的生成,降低和修复细胞受到的损害。但目前国内外对OFP 生物活性的研究报道较少,发挥这一作用的主要物质基础还不很清楚,有待深入研究。
4 结论
本研究结果表明,适量摄入黄秋葵果实粉能显著提高衰老小鼠的抗氧化能力,具有一定延缓衰老的作用,其机制可能与提高小鼠体内SOD、GSH-Px 和CAT活性,降低MDA 含量有关。
[1] 刘娜.黄秋葵的综合利用及前景[J].中国食物与营养,2007(6):27-30
[2] 董彩文,梁少华.黄秋葵的功能特性及综合开发利用[J].食品研究与开发,2007,28(5):180-182
[3] 黄阿根,陈学好,高云中,等.黄秋葵的成分测定与分析[J].食品科学,2007,28(10):451-455
[4] 李建华,陈珊.黄秋葵水提液抗疲劳的药效学观察[J].中国运动医学杂志,2004,23(2):196-197
[5] 王君耀,周峻,汤谷平.黄秋葵抗疲劳作用的研究[J].中国现代应用药学杂志,2003,20(4):316-317
[6] S.I.Alqasoumi.‘Okra’Hibiscus esculentus L.:A study of its hepatoprotective activity[J].Saudi Pharmaceutical Journal, 2012,20(2):135-141
[7] 郑建仙.功能性食品(第三卷)[M].北京:中国轻工业出版社,1999,164-165,181
[8] 陈艳珍,宋新华.黄秋葵粉对衰老小鼠抗疲劳和免疫功能的影响[J].食品研究与开发,2012,33(10):170-172
[9] 刘洋,程清洲,彭超华,等.D-半乳糖致小鼠衰老模型的制作及效果评价[J].武汉工业学院学报,2009,28(1):32-34
[10] 杨江涛,杨娟,杨江冰,等.刺梨多糖对衰老小鼠体内抗氧化能力的影响[J].营养学报,2008,30(4):407-409

