吡格列酮对高脂血症大鼠主动脉核因子-κB/单核细胞趋化因子1表达的影响
刘春丽 商玮 赵凌杰 姚茹冰 沈思钰 董晓蕾 赵智明 蔡辉
.基础研究.
吡格列酮对高脂血症大鼠主动脉核因子-κB/单核细胞趋化因子1表达的影响
刘春丽 商玮 赵凌杰 姚茹冰 沈思钰 董晓蕾 赵智明 蔡辉
目的 观察吡格列酮对高脂血症大鼠主动脉核因子-κB/单核细胞趋化因子1(NF-κB/ MCP-1)表达的影响,并探讨其作用机制。方法 将26只雄性SD大鼠按照随机数字表法分成普通饲料对照组(n=9)和高脂饲料组(n=17),高脂饲料组喂养12周后再按照随机数字表法分成模型组(n=8)和吡格列酮组(n=9)。分组干预4周后,平行检测各组血脂、血糖水平,HE染色观察主动脉组织形态学改变,免疫组化法检测主动脉NF-κB/MCP-1的表达。结果 高脂饲料组大鼠喂养12周后,与对照组比较,三酰甘油、总胆固醇和低密度脂蛋白胆固醇水平明显升高[(1.729±0.472)mmol/ L比(0.929±0.150)mmol/L,(2.981±0.318)mmol/L比(1.831±0.226)mmol/L,(0.499±0.337) mmol/L比(0.195±0.051)mmol/L,均为P<0.05];给药4周后,与模型组相比,吡格列酮组血清三酰甘油、总胆固醇水平明显降低[(0.731±0.319)mmol/L比(1.534±0.172)mmol/L,(1.720±0.249) mmol/L比(3.084±0.984)mmol/L,均为P<0.05],且主动脉内皮组织基本完好,偶有脱落,平滑肌增生不明显。与对照组相比,模型组NF-κB、MCP-1表达水平也明显升高(0.506±0.083比0.215± 0.021,0.378±0.100比0.167±0.012,均为P<0.01);与模型组相比,吡格列酮组NF-κB、MCP-1表达水平明显下降(0.250±0.033比0.506±0.083,0.171±0.012比0.378±0.100,均为P<0.01)。结论 吡格列酮能够减轻高脂血症对动脉内膜的损伤。
吡格列酮; 血脂异常; 动脉粥样硬化; NF-κB; 单核细胞化学吸引蛋白质类
近年来对动脉粥样硬化(atherosclerosis,AS)研究的一个重要进展就是确立了AS是一种慢性血管炎性疾病,当血液流变学发生改变以及血管内皮细胞受损时,血管壁黏附分子分泌剧增,黏附炎性细胞转变成巨噬细胞,吸收脂质后成为泡沫细胞。单核细胞趋化因子1(monocyte chemotactic factor-1,MCP-1)在其上游转录因子核因子-κB(nuclear factor,NF-κB)作用下,对单核/巨噬细胞有趋化和激活作用,并使其在粥样斑块中大量聚积,吞噬氧化性脂质后形成泡沫细胞,参与血管慢性炎性反应,促进血管内膜增厚,引发AS。吡格列酮(pioglitazone,TZDs)是一种过氧化酶增殖物激活受体γ (peroxisome proliferator-activated receptor-γ,PPAR-γ)激动剂,能改善胰岛素抵抗和糖代谢,常用于糖尿病患者。研究发现,它可以多靶点作用于心血管系统,但具体机制尚不明确。本研究通过高脂饮食建立高脂血症大鼠AS模型,并行吡格列酮干预,观察其对高脂血症大鼠主动脉NF-κB/MCP-1表达水平的影响,现将实验结果报道如下。
1 材料和方法
1.1 实验动物
出生21 d SD(Sprague Dawley)雄性健康大鼠,体质量55~68 g,由南京军区南京总医院动物实验中心提供[实验动物使用许可证号SYXK(苏)2003-0032]。
1.2 主要实验药品和试剂
三酰甘油(TG)、总胆固醇(TC)、高密度脂蛋白胆固醇(HDL-C)和低密度脂蛋白胆固醇(LDL-C)检测试剂盒均购自南京建成生物工程研究所。盐酸吡格列酮片(15 mg/片)由杭州中美华东制药生产,批号:081103。SP双染试剂盒由福州迈新生物科技有限公司生产,批号:kit-9999。苏木素染色液购自南京建成公司,批号:D005。兔抗人NF-κB-p65一抗购自Santa Cruz公司,批号:sc-114。兔抗大鼠多克隆抗体MCP-1购自武汉博士德生物技术有限公司,批号:BA1255。中性树胶购自福州迈新生物科技有限公司,批号:DAB-0033。多聚赖氨酸购自福州迈新生物科技有限公司,批号:GLU-0041,用蒸馏水配制成10%多聚赖氨酸。二甲苯、甲醇、枸橼酸三钠等其他试剂,均为国产分析纯。
1.3 主要实验仪器
组织切片机,美国Reichert HistoSTAT;孵箱,上海精宏实验设备有限公司,型号:THZ-312;显微镜,日本Nikon,型号:E200;天平,德国赛多利斯,型号: E200;耐高温塑料染色架,福州迈新,型号:RAK-2001。Image-Pro Plus 6.0图像分析系统。
1.4 实验方法
1.4.1 高脂血症大鼠模型的建立及分组 26只实验用大鼠按随机数字表法随机分为高脂饲料组(n =17)和普通饲料对照组(n=9),高脂饲料组给予高脂饲料(鱼粉3%、猪油12%、鸡蛋12%、胆固醇2%、胆酸盐0.5%、甲硫氧嘧啶0.2%和72.3%的基础饲料),对照组给予标准大鼠基础饲料。分别喂养12周后,通过眼眶静脉丛取血,平行检测血脂水平,确定高脂饲料组17只大鼠均符合高脂血症模型[1]。17只成模高脂血症大鼠再按照随机数字表法分成模型组(n=8)和吡格列酮组(n=9),自实验第13周起,吡格列酮组大鼠给予吡格列酮混悬液(将10 mg.kg-1.d-1量的吡格列酮溶于1.5 ml/100 g体质量的蒸馏水中制成混悬液),连续灌胃4周,对照组和模型组则给予1.5 ml/100 g体质量的蒸馏水灌胃,干预期间模型组和吡格列酮组继续喂饲高脂饲料。每天进食量控制在15 g/100 g体质量,早、中、晚三餐定时定量,对照组仍继续给予普通饲料。实验第16周末,禁食24 h后,用20%氯胺酮,以1 ml.100 g-1.d-1体型剂量麻醉后,剪开胸腔,暴露心脏,左心室穿刺取血5 ml,室温静置1 h后,3 000 r/min离心5 min,分离血清,置-20℃冰箱保存,待测相关指标;冰盘中分离大鼠主动脉,置液氮中保存,待行免疫组化检测及组织形态学观察。
1.4.2 血脂测定 TG用TPO-PAP法,TC用CHOD-PAP法,HDL-C和LDL-C用选择性沉淀法。
1.4.3 主动脉组织形态学改变 采用HE染色法,主动脉HE染色由南京凯基生物科技发展有限公司完成。于大鼠主动脉弓与胸主动脉交界处取材,10%中性甲醛固定,石蜡包埋,水平横切面制备石蜡切片(厚度4 μm),苏木素伊红(HE)染色、风干,中性树胶封片,×200光镜下观察。
1.4.4 主动脉NF-κB/MCP-1表达 采用SP法,胸主动脉根部取材至10%甲醛中固定,常规石蜡包埋,连续4 μm切片。二甲苯脱蜡,梯度酒精脱水后,不同浓度乙醇水化,PBS浸泡并清洗数次后。将放有切片的耐高温塑料染色架放入盛有抗原修复缓冲液中,20 min后取出,自然冷却。PBS浸泡、清洗,3%H2O2-甲醇溶液处理,再次PBS浸泡、清洗后加入一抗100 μl,放至37℃湿盒孵育2 h。相关处理后,加入HRP标记二抗50 μl。新鲜配制的二氨基联苯氨(DAB)液进行显色,镜下观察染色深浅,染好立即中止,用自来水轻柔冲洗15 min用蒸馏水终止显色反应。苏木素复染,中性树胶封片,光学显微镜下进行结果观察。
1.5 统计学方法
2 结果
2.1 实验第12周末各组大鼠血脂、血糖水平
经不同饲料喂养12周后,高脂饲料组大鼠的TC、TG、LDL-C水平显著高于对照组,差异均有统计学意义(均为P<0.05,表1),高脂饲料组17只大鼠均符合高脂血症模型[1]。
表1 第12周末两组大鼠血脂、血糖水平(±s,mmol/L)

表1 第12周末两组大鼠血脂、血糖水平(±s,mmol/L)
注:与对照组比较,aP<0.05
组别大鼠(只)血糖TG TC HDL-C LDL-C对照组 9 3.497±0.672 0.929±0.150 1.831±0.226 1.255±0.092 0.195±0.051高脂饲料组17 3.545±0.835 1.729±0.472a2.981±0.318a1.356±0.198 0.499±0.337at值-0.148-6.407-9.608-1.763-3.633 P值>0.05 0.000 0.000>0.05 0.035
2.2 实验第16周末各组大鼠血脂、血糖水平
经吡格列酮干预4周后,实验第16周末,各组大鼠的TG、TC水平差异均有统计学意义(均为P<0.05)。模型组TC和TG水平较对照组升高,吡格列酮组TC和TG水平较模型组降低,差异均有统计学意义(均为P<0.05),见表2。
表2 实验第16周末各组大鼠血脂、血糖改变(¯±s,mmol/L)

表2 实验第16周末各组大鼠血脂、血糖改变(¯±s,mmol/L)
注:与对照组比较,aP<0.05;与模型组比较,bP<0.05
组别大鼠(只)血糖TG TC HDL-C LDL-C对照组 9 3.423±1.402 0.798±0.195 1.690±0.318 1.187±0.148 0.153±0.050模型组 8 3.753±1.212 1.534±0.172a3.084±0.984a1.168±0.065 0.214±0.124吡格列酮组9 3.480±1.286 0.731±0.319b1.720±0.249b1.204±0.206 0.230±0.079 F值0.152 28.600 14.991 0.124 2.073 P值>0.05 0.000 0.000>0.05>0.05
2.3 各组大鼠主动脉组织形态学观察
对照组血管壁三层结构清晰,血管内膜光滑,内皮细胞完整,内膜下可见少量泡沫细胞,中膜厚度均一,中膜平滑肌细胞与弹力板近似平行相间排列(图1A);模型组血管内皮连续性受损,管壁局部向管腔突出,内膜有大量脂质和泡沫细胞堆积,部分内膜增厚,中层结构紊乱,平滑肌细胞明显增生,排列紊乱(图1B);吡格列酮组内膜未见明显改变,内皮细胞偶有脱落,内膜分布少量泡沫细胞,内皮细胞尚完整,中膜厚度适中,平滑肌细胞轻度增生,分布较均匀,形态基本正常(图1C)。
2.4 各组大鼠主动脉NF-κB/MCP-1阳性颗粒平均光密度的改变
NF-κB/MCP-1表达阳性指SP染色后细胞胞浆中呈现棕黄色颗粒。NF-κB免疫组化染色结果显示,在模型组大鼠主动脉细胞胞浆中有明显的棕黄色颗粒染色,而吡格列酮组和对照组未见明显棕色颗粒染色(图2)。MCP-1免疫组化染色结果显示,在模型组大鼠主动脉细胞胞浆中有明显的棕黄色颗粒染色,而吡格列酮组和对照组未见明显棕色颗染色(图3)。
经Image-Pro Plus 6.0图像分析系统对各组主动脉NF-κB/MCP-1阳性颗粒平均光密度值的定量分析,结果显示模型组的NF-κB/MCP-1阳性颗粒平均光密度明显高于对照组,差异有统计学意义(均为P<0.01),吡格列酮组则低于模型组,差异有统计学意义(均为P<0.001),而与对照组比较差异无统计学意义(P>0.05),见表3。
表3 各组大鼠主动脉NF-κB/MCP-1阳性颗粒平均光密度值改变(¯±s)

表3 各组大鼠主动脉NF-κB/MCP-1阳性颗粒平均光密度值改变(¯±s)
注:与对照组比较,aP<0.01;与模型组比较,bP<0.001
组别大鼠(只)NF-κB MCP-1对照组 6 0.215±0.021 0.167±0.012模型组 5 0.506±0.083a0.378±0.100a吡格列酮组6 0.250±0.033b0.171±0.012bF值52.923 25.920 P值0.000 0.000
3 讨论
Ross[2]“AS的炎性反应损伤”学说的建立,使人们认识到AS是由多因素共同参与的慢性炎性疾病,血脂水平升高和发生在血管内皮细胞下的炎症反应是动脉粥样斑块形成的两大诱因。NF-κB是调节AS血管炎症相关基因的重要转录因子,对AS形成过程中的多种促炎细胞因子、黏附分子和趋化因子具有关键性的调控作用。AS血管中NF-κB含量和活性的升高,增强炎性因子的转录和生成,血管炎症反应程度的加剧和斑块易损性的增高[3]。
外周血中的单核细胞向动脉壁内膜损伤部位的迁移、聚集、黏附,继而发生活化是AS形成早期的中心事件,单核细胞与血管内皮细胞黏附是AS的起始环节,MCP-1在这一过程中发挥重要作用。MCP-1属于C-C家族,是最具代表性的成员之一,主要参与单核细胞聚集和迁移,同时还作用于T细胞和嗜碱性粒细胞等。MCP-1在AS发生、发展中作用的发现来源于对MCP-1基因敲除小鼠的研究。研究发现MCP-1或其作用受体的基因缺失均能够减轻LDL受体或载脂蛋白E(apoE)基因缺失小鼠主动脉的脂质沉积及AS病变程度[4-5]。Ni等[6]通过N端缺失的MCP-1基因突变子转染apoE基因缺失小鼠后发现,AS形成明显增加,当抑制基因转染后,显著减少apoE基因缺失小鼠AS的发生。在有斑块形成的小鼠体内,抑制基因转染,增加AS斑块的稳定性,因此指导以MCP-1为靶点的抗AS治疗。
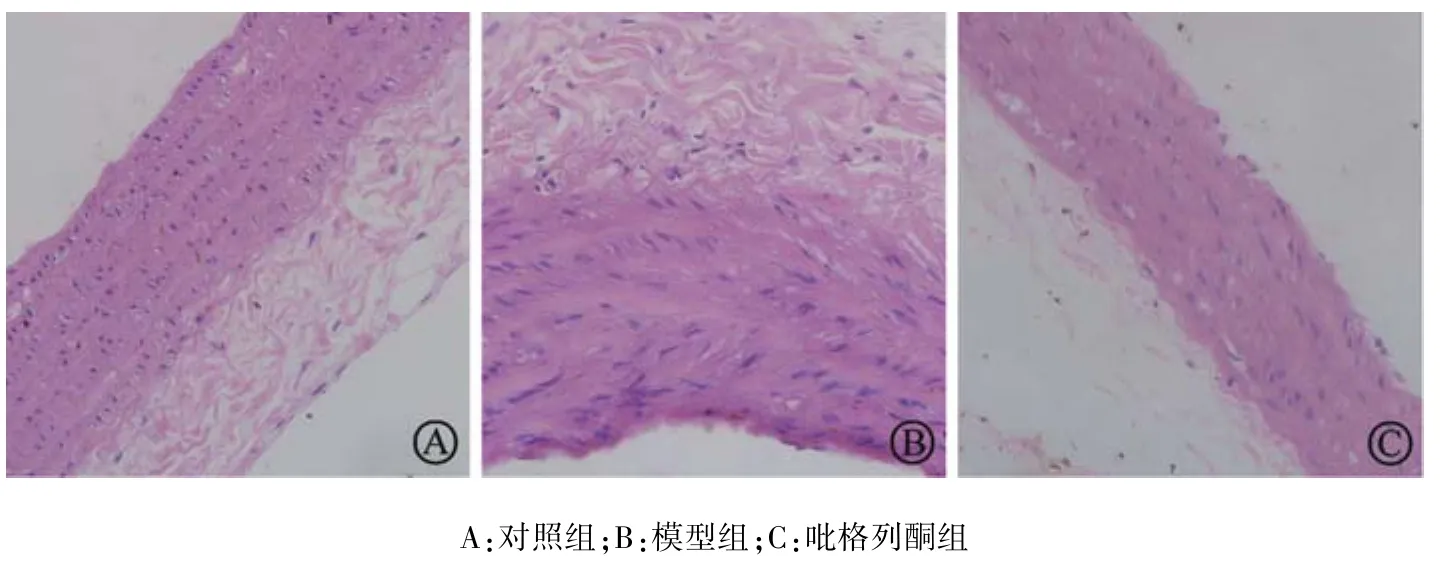
图1 各组大鼠主动脉组织形态学观察(HE染色,×200)

图2 各组大鼠主动脉NF-κB免疫组化染色(光镜,×400)

图3 各组大鼠主动脉MCP-1免疫组化染色(光镜,×400)
血脂紊乱以及氧化型脂质沉积,如高胆固醇血症、氧化性低密度脂蛋白(ox-LDL)水平升高均是AS发生、发展及泡沫细胞形成的重要因素[7]。高脂血症是AS的重要危险因素之一,血清中TC含量升高时,促使氧自由基生成,诱发内皮功能障碍。LDL是TC的主要携带者,当大量LDL沉积于血管壁时,可被氧化修饰成的ox-LDL,有很强的细胞毒性,能增强MCP-1表达,趋化单核细胞进入内皮下,促进泡沫细胞形成和内膜增生,进而促进AS发生[3]。
研究发现,包括MCP-1在内的多种因子基因启动子和增强子中存在一个或多个NF-κB序列,这些基因活化前提是NF-κB激活。在AS过程中,MCP-1表达受到NF-κB调控,活化的NF-κB能够促使MCP-1表达增强,从而导致单核/巨噬细胞浸润,当NF-κB激活后由细胞质转位至胞核,能调节MCP-1释放,促进血管炎症过程的发生、发展,导致血管壁损伤,最终引起AS损伤。研究显示,在正常冠状动脉中NF-κB表达很少或几乎不表达,而在AS斑块中,NF-κB高度表达于斑块的肩部及纤维帽处,尤其在巨噬细胞和泡沫细胞浸润处表达最明显,表明NF-κB可能在单核/巨噬细胞浸润及粥样硬化斑块形成过程中发挥重要作用。进一步研究发现,NF-κB/MCP-1不仅在单核/巨噬细胞浸润方面发挥重要作用,而且也是参与内膜增生的重要调节因子[5]。
PPAR-γ属于核内激素受体家族成员,也是一种转录因子。PPAR-γ基因定位于3p25,在内皮细胞、平滑肌细胞和巨噬细胞等许多血管壁细胞中均有表达。PPAR-γ不仅能够诱导脂肪细胞分化、凋亡,增加胰岛素敏感性[8],在糖脂代谢的调节中发挥重要作用[9],也对内皮组织有抗炎和血管保护作用[10]。大量的研究结果提示,PPAR-γ具有抗AS作用和稳定粥样硬化斑块作用。PPAR-γ激活后可以通过抑制NF-κB途径发挥抗炎、抗氧化应激以及抗AS作用,从而发挥保护血管作用[11-12]。吡格列酮作为PPAR-γ激动剂,通过其特殊配体,发挥改善胰岛素抵抗以及抑制血管炎症作用[13-14]。吡格列酮能改善多种代谢性和炎症相关性心血管疾病,包括血脂异常、内皮功能紊乱等。PPARs由于能够被氧化修饰的脂肪酸选择性地激活而被看作脉管系统的还原敏感转录因子[15],PPARs通过调节单核细胞的基因表达,在动脉粥样硬化和再狭窄有关的炎症过程中发挥作用[16]。Kasai等[17]发现,吡格列酮能通过NF-κB依赖MCP-1途径,明显抑制猪冠状动脉内膜增厚,表明吡格列酮可通过降低血糖以外的途径保护血管,防止血管内皮细胞过度增生。
本实验中,模型组大鼠主动脉内膜NF-κB/ MCP-1表达较之对照组明显增加,差异具有统计学意义,表明高脂喂养造成的高脂血症能够诱导主动脉内皮NF-κB/MCP-1的表达,可能与高脂血症引起机体严重的氧化应激状态、细胞内活性氧类增加和激活NF-κB[18],诱导MCP-1的表达增高有关。模型组大鼠内膜下及平滑肌层均可见到大量的巨噬细胞沉积,内膜、平滑肌层增生明显,平滑肌结构紊乱。当用吡格列酮干预后,高脂血症大鼠主动脉NF-κB/ MCP-1表达明显减少,内膜下泡沫样细胞明显减少,血管壁结构基本正常,表明吡格列酮能够通过抑制高脂血症大鼠主动脉NF-κB/MCP-1表达,有效抑制内膜下单核细胞聚集、迁移,减少泡沫细胞形成和血管壁细胞的异常增生,从而达到血管保护的作用。当然,本实验也存在不足之处,如在实验设计方面,样本量较小,且无阳性药物对照组,吡格列酮组未设多个剂量组,检测方法较单一,这些均可能对实验结果产生影响。
[1]Zhang XM,Wei XB,Wu BJ.Drug Screening Assays for treatment of dyslipidemia and atherosclerosis[M],Methodology of Pharmacological Experiment,3rd Ed.Beijing:people's medical publishing house,2001,1201-1206.(in Chinese)张岫美,魏欣冰,吴葆杰.调血脂药及抗AS药的筛选[M]//徐叔云,卞如濂,陈修主编.药理实验方法学,第3版.北京:人民卫生出版社,2001,1201-1206.
[2]Ross R.Atherosclerosis—an inflammatory disease[J].N Engl J Med,1999,340:115-126.
[3]Bai Y,Li J,Wang L,et al.Relationships between expression of Nuclear factor-kappa B and vascular cell adhesion molecule-1 in atherosclerotic plaques of coronary vessels and stability of coronary plaques[J],Journal of Xinxiang Medical University,2010,27:144-147.(in Chinese)白玉,李晋,王璐,等.核因子-κB与血管细胞间黏附分子-1在人冠状动脉粥样硬化斑块中的表达及其与斑块稳定性的关系[J].新乡医学院学报,2010,27:144-147.
[4]Gu L,Okada Y,Clinton SK,et al.Absence of monocyte chemoattractant protein-1 reduces atherosclerosis in low density lipoprotein receptor-deficient mice[J].Mol Cell,1998,2: 275-281.
[5]Dawson TC,Kuziel WA,Osahar TA,et al.Absence of CC chemokine receptor-2 reduces atherosclerosis in apolipoprotein E-deficient mice[J].Atherosclerosis,1999,143:205-211.
[6]Ni W,Egashira K,Kitamoto S,et al.New anti-monocyte chemoattractant protein-1 gene therapy attenuates atherosclerosis in apolipoprotein E-knockout mice[J].Circulation,2001,103: 2096-2101.
[7]Steinberg D.Conner Memorial Lecture.Oxidative modification of LDL and atherogenesis[J].Circulation,1997,95:1062-1071.
[8]Miller YI,Choi SH,Fang L,et al.Lipoprotein modification and macrophage uptake:role of pathologic cholesterol transport in atherogenesis[J].Subcell Biochem,2010,51:229-251.
[9]Nicholls SJ,Tuzcu EM,Wolski K,et al.Lowering the Triglyceride/High-Density Lipoprotein Cholesterol Ratio Is Associated With the Beneficial Impact of Pioglitazone on Progression of Coronary Atherosclerosis in Diabetic Patients[J]. J Am Coll Cardiol,2011,57:153-159.
[10]Magnone M,Bruzzone S,Guida L,et al.Abscisic acid released by human monocytes activates monocytes and vascular smooth muscle cell responses involved in atherogenesis[J].J Biol Chem,2009,284:7808-7818.
[11]Cuzzocrea S,Pisano B,Dugo L,et al.Rosiglitazone,a ligand of the peroxisome proliferator-activated receptor-gamma,reduces acute inflammation[J].Eur J Pharmacol,2004,483:79-93.
[12]Zoete V,Grosdidier A,Michielin O.Peroxisome proliferatoractivated receptor structures:ligand specificity,molecular switch and interactions with regulators.Biochimica et Biophysica Acta (BBA)[J].Biochim Biophys Acta,2007,1771:915-925.
[13]Hirano M,Nakamura T,Kitta Y,et al.Rapid improvement of carotid plaque echogenicity within 1 month of pioglitazone treatment in patients with acute coronary syndrome[J]. Atherosclerosis,2009,203:483-488.
[14]Leonhardt W,Pfützner A,Müller J,et al.Effects of pioglitazone and/or simvastatin on low density lipoprotein subfractions in nondiabetic patients with high cardiovascular risk:A sub-analysis from the PIOSTAT study[J].Atherosclerosis,2008,201:155-162.
[15]Berger JP,Akiyama TE,Meinke PT,et al.PPARs:therapeutic targets for metabolic disease[J].Trends Pharmacol Sci,2005, 26:244-251.
[16]Argmann CA,Cock TA,Auwerx J.Peroxisome proliferatoractivated receptor gamma:the more the merrier[J]?Eur J Clin Invest,2005,35:82-92.
[17]Kasai T,Miyauchi K,Yokoyama T,et al.Pioglitazone attenuates neointimal thickening via suppression of the early inflammatory response in a porcine coronary after stenting[J]. Atherosclerosis,2008,197:612-619.
[18]Emple RK,Chatterjee VK,O'Rahilly S.PPAR gamma and human metabolic disease[J].J Clin Invest,2006,116:581-589.
(本文编辑:谭潇)
.专家答疑.
问:扩张型心肌病伴心房颤动,导管消融术效果如何?
答:心房颤动(房颤)和充血性心力衰竭(心衰)是本世纪人类面临的心血管领域两大挑战。研究表明,房颤和心衰常同时存在,房颤首次诊断时,26%的患者曾伴有或并存心衰,16%的患者可能会发展为心衰;而心衰首次诊断时,24%的患者曾伴有或并存房颤,17%的患者以后发展为房颤,随着心功能NYHA分级增加,合并房颤的比例也显著增加。
扩张型心肌病心衰合并房颤是心血管疾病治疗中的一个难点,随着人口老龄化和其他心血管疾病的流行,心衰合并房颤的发生率会逐渐增加。尽管经导管消融已经从阵发性房颤进展到持续性房颤,三维标测技术也日臻成熟,但规范化的药物治疗仍是改善扩张型心肌病心衰合并房颤患者症状和预后的基础,包括ACEI/ARB、β受体阻滞剂以及抗凝治疗等。对于药物治疗效果不满意的患者,非药物治疗是重要的替代治疗方法。已有的研究结果提示,经导管射频消融转复并维持窦性心律可明显改善心衰合并房颤患者的症状和心功能状况。由于这类患者的房颤类型多数为持续性,并常有多种合并症,医疗中心和临床医师的房颤消融经验对手术的疗效和安全性至关重要。可能影响导管消融房颤成功率的因素包括患者心衰的原因及程度、心脏大小、房颤持续时间、患者年龄以及是否合并其他疾病等,应综合评估手术风险及患者可能的获益。
Haissaguerre等早在2004年就报告了房颤合并心衰导管消融的成功率与单纯房颤相比无显著降低,心衰患者房颤导管消融术后左心室功能、左心室内径、运动耐量、症状和生活质量均显著改善。Boris和Chen等也报道了导管消融能明显改善房颤伴左心功能不全患者的心功能。2008年的PABA-CHF研究表明,房颤导管消融组在左心室EF值﹑6 min步行距离和生活质量评分方面均明显优于房室结消融+双心室起搏组。但由于各临床试验的样本数较少,且随访的时间并不很长,故而有关导管消融对扩张型心肌病心衰患者预后的影响尚有待进一步证实。
扩张型心肌病的房颤患者,合并心衰、心脏扩大,是血栓栓塞并发症的高危人群,应加强和规范围术期的抗凝治疗,防止并发症的发生。术前应常规采用华法林抗凝3周以上,使国际标准化比率(INR)维持在2.0~3.0;术后继续应用华法林抗凝不少于3个月。
由于患者心功能状态明显减退,在房颤导管消融的围术期应加强药物治疗以控制心衰、防止在手术过程中突发心衰急性发作,影响手术的顺利进行。因此,患者在术前和术后均应接受充分的药物治疗,包括利尿剂、ACEI或ARB以及卡维地洛等,改善心功能。建议使用8 mm温控射频导管进行消融,而不是使用常规的冷盐水灌注导管,以防止大量盐水进入体内而诱发急性左心衰。由于房颤时间长、心功能差、左心房明显增大、心肌纤维化等改变常较明显,术中需要进行的消融范围大,在隔离肺静脉的基础上,有可能还需要增加消融线或进行CFAE电位消融。术中应密切观察患者的情况,包括生命体征和症状,尤其是患者心功能差,加之术中应用镇痛、镇静药物,术程中有可能出现血压偏低,并及时透视心影以排除心包填塞等可能。长时间高功率消融也可能造成皮肤低温烫伤,表现为背部电极板处皮肤破损渗液。
总之,对扩张型心肌病合并房颤的患者,实施导管消融手术的风险高于其他房颤患者,且手术成功率亦相对较低,因此,术前要与患者及其家属进行充分交流、沟通。
(北京大学人民医院心脏中心 张海澄)
Influence of Pioglitazone on NF-κB/MCP-1 expression in hyperlipidem ia rat
Liu Chunli,Shang Wei,Zhao Lingjie,Yao Rubing,Shen Siyu,Dong Xiaolei,Zhao Zhiming,Cai Hui.
Department of Integrated Traditional Chinese and Western Medicine,Nanjing General Hospital of Nanjing Military Command,PLA,Nanjing 210002,China
Objective To investigate the influence of pioglitazone on expressions of NF-κB/MCP-1 in aorta of rats with hyperlipidemia.M ethods The 26 male SD rats were divided into control group(n=9) and high-fat diet group(n=17)according to random number table.Rats in high-fat diet group fed with hypercholesterol diet for 12 weeks,then divided into model group(n=8)and pioglitazone treated group(n =9)according to random number table.4 weeks later,serum lipid level and blood glucose of all rats were measured and expressions of NF-κB/MCP-1 in aorta of all rats were analyzed by immunohistochemical method.Results After feeding for 12 weeks,serum lipid levels of high-fat diet group were significantly higher than control group[(1.729±0.472)mmol/L vs.(0.929±0.150)mmol/L for TG,(2.981± 0.318)mmol/L vs.(1.831±0.226)mmol/L for TC and(0.499±0.337)mmol/L vs.(0.195±0.051) mmol/L for LDL-C,all P<0.05],and aortic endothelial tissue was largely intact,occasionally dropping,proliferation of smooth muscle cells was not obvious.Intervention with pioglitazone for 4 weeks,compared with model group,serum levels of TC and TG in pioglitazone treated group were significantly decreased[(0.731±0.319)mmol/L vs.(1.534±0.172)mmol/L and(1.720±0.249)mmol/L vs.(3.084± 0.984)mmol/L,both P<0.05],and expressions of NF-κB/MCP-1 were also reduced significantly[(0.506±0.083)vs.(0.215±0.021)and(0.378±0.100)vs.(0.167±0.012),both P<0.01]. Compared with control group,expressions of NF-κB/MCP-1 in pioglitazone treated group were significantly decreased[(0.250±0.033)vs.(0.506±0.083)and(0.171±0.012)vs.(0.378±0.100),both P<0.01].Conclusions Pioglitazone can inhibit arterial intimal injury in rats with hyperlipidemia.
Pioglitazone; Dyslipidemias; Atherosclerosis; NF-kappa B; Monocyte chemoattractant proteins
Cai Hui,Email:caihuiphd@163.com
2013-08-12)
10.3969/j.issn.1007-5410.2014.02.013
210002中国人民解放军南京军区南京总医院中西医结合科
蔡辉,电子信箱:caihuiphd@163.com

