Amphotericin B在全细胞穿孔膜片钳技术中的应用研究*
张 亮,付崇罗
常规的膜片钳技术采用负压抽吸或电击破膜形成全细胞模式。在此过程中,电极内液和细胞内液之间的扩散交换常使一些受胞内物质调控的通道电流出现时间依赖性的衰减。1988年Horn等[1]对传统全细胞记录进行了改进,建立了穿孔膜片钳技术(perforated-patch clamp):即利用某些抗生素具有在生物膜上形成通透性孔道的性质,将这类抗生素充灌在电极液中,在高阻封接形成之后自发性形成的全细胞模式。
海德氏突触(calyx)位于哺乳动物听觉脑干斜方体中核区,是一个巨大的谷氨酸能化学突触,越来越多的被用于中枢神经系统(CNS)突触机制的研究[2]。本研究室在小鼠calyx细胞上研究突触囊泡释放机制,然而在常规全细胞膜片钳记录时,易引起细胞内物质流失,影响细胞内环境的稳定,从而可能导致记录的失真,尤其是在要求长时间记录的实验中。而穿孔膜片钳技术应用amphotericin B在细胞膜上形成特定的孔道,选择性地允许一些离子和大分子物质通过,保持了电学连续性,从而使细胞内环境保持相对稳定,在一定程度上弥补了上述缺陷,实验成功率也相应提高,为深入开展后续的工作提供技术平台。
1 材料与方法
1.1 脑片的制备
本实验使用7-9日龄的 C57BL6小鼠,发育正常,雌雄不限。制备含有听觉脑干斜方体中核区组织脑片,厚度200μm。脑片置于盛有Bath溶液并通有二元气(95%O2+5%CO2)的水浴槽中,37℃温浴30 min。
1.2 电极拉制和电极液灌注
微管电极是由电极拉制仪(MODEL P-2000,USA)拉制而成,充灌电极液后,电极尖端阻值为2~4 MΩ。拉制好的电极先在不含amphotericin B的电极液中浸10~30 s,然后从电极尾部反向充灌含amphotericin B的电极液,用手指轻弹电极中部排除尖端气泡。新配制的amphotericin B电极内液一般使用时间不要超过3~5 h,否则破膜效率将降低。
1.3 mEPSC记录方法
钳制电压-80 mV,采样频率为20 KHz,信号通过5 KHz过滤。记录使用的膜片钳放大镜(EPC10,HEKA,Germany),通过模数转换采集数据,存于计算机硬盘。
1.4 药物和配制液体
1.4.1 药物 amphotericin B购于 CALBIOCHEM公司(USA),其它药品均购自 Sigma公司(USA)。
1.4.2 配制液体(mmol/l) 低钙人工脑脊液(slicing solution)NaCl 125,NaHCO325,NaH2PO41.25,KCl 2.5,CaCl20.5,MgCl23,Glucose 25,Ascorbic acid 0.4,Na-Pyruvate 2,MyO-Inositol 3。标准人工脑脊液(mmol/l)NaCl 125,NaHCO325,NaH2PO41.25,KCl 2.5,CaCl22,MgCl21,Glucose 25,Ascorbic acid 0.4,Na-Pyruvate 2,MyO-Inositol 3。电极内液(mmol/l)KCl 150,HEPES-NaOH 10,P-creative 10,MgATP 4,EGTA 0.5,GTP 0.3。Amphotericin B穿孔液的配制:避光条件下称取3 mg amphotericin B加入50μl DMSO,应用超声震荡加速溶解至其呈现澄清透明的橙黄色液体,然后取适量加入到电极液中使Amphotericin B的最终浓度为 240~400μg/ml。Amphotericin B储存液(60 mg/ml)避光保存在-20℃备用,保存时间不超过1个星期。整个配制过程避光,用棕色瓶配制或用锡箔纸包裹。
1.5 数据处理
所有数据使用 IGOR Pro 6.22A(WaveMatrics)软件分析,实验数据以均数±标准差(¯x±s)表示,所获数据采用组间 t检验。
2 结果
2.1 穿孔过程的动态变化
在施加正压的情况下,利用三维操纵器移动电极贴近目标细胞,并轻压在细胞表面,稍加负压即可形成1 GΩ水平以上的高阻抗封接。一般情况下,当电极与细胞膜形成帖附式膜片后,约几分钟amphotericin B即可扩散到细胞膜上发挥作用。每隔10 min施加一个10 mV的超极化脉冲,同时观察电容电流幅值的变化。高阻封接5 min后,可观察到脉冲诱发的电容电流幅值逐渐增大,电极的串联电阻(Rs)逐渐减小,即amphotericin B形成的孔道越来越多。约在高阻封接后30 min左右电容电流和串联电阻(Rs)趋于稳定,表明孔道已完全形成(图1)。
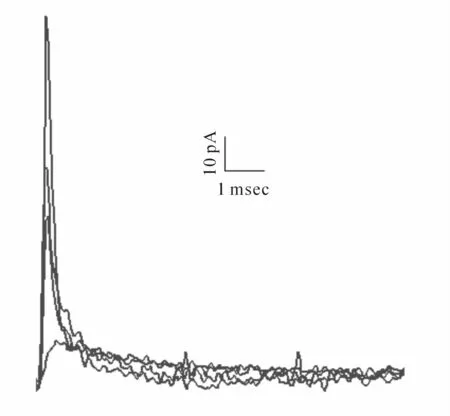
Fig.1 Dynamic changes in the capacitance currents of perforated membrane of calyx cells
2.2 Amphotericin B在穿孔膜片钳记录中的一般特性
成功的穿孔全细胞模式记录过程中,细胞稳定的钳制在-80 mV的静息电位上,电极的串联电阻(Rs)小于70 MΩ且相对稳定,可以记录30 min以上。在记录过程中,穿孔全细胞模式有时候会自发性变成传统全细胞模式,amphotericin B会扩散进入细胞质,这种情况将会引起串联电阻(Rs)迅速下降到20 MΩ以下(图2)。我们在监测整个记录过程中串联电阻(Rs)的变化,只有极少的细胞出现串联电阻(Rs)的变化,这些记录的细胞数据将被丢弃。
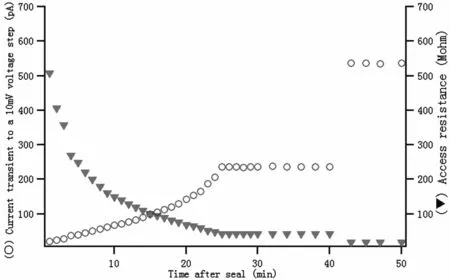
Fig.2 Membrane current(○)and series resistance(▾)dynamic property at perforated patch clamp mode
2.3 Amphotericin B的浓度对穿孔过程的影响
Amphotericin B的浓度是影响细胞穿孔过程的重要因素,为了获得最佳的穿孔条件,我们探索了Amphotericin B的不同浓度对细胞穿孔过程的影响。本组实验设定了不同的amphotericin B的浓度(200,300和400μg/ml)来优化最佳的穿孔浓度。Amphotericin B的浓度在400μg/ml时串联电阻(Rs)和穿孔时间最佳。如果继续增加amphotericin B的浓度将会出现絮状沉淀,影响封接的成功率和穿孔效果(图3)。
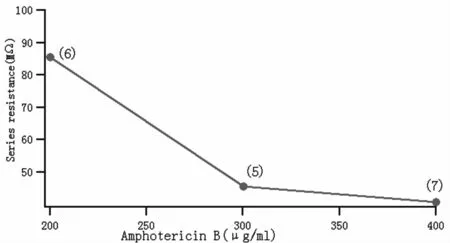
Fig.3A Effects of amphotericin Bconcentrations on the series resistance(Rs)

Fig.3B Effects of amphotericin B concentrations on the time of perforation
2.4 采用穿孔膜片钳和全细胞膜片钳方法全细胞模式记录神经元突触内自发的微小兴奋性突触后电流(mEPSC)
分别在传统全细胞模式和穿孔全细胞模式下记录mEPSC,分析发现常规的全细胞模式记录的mEPSC频率下降明显,而穿孔全细胞模式mEPSC下降相对缓慢。记录6 min的 mEPSC,对比前 3min和后3min平均频率的下降率分别为(17.2±2.73)%(n=3)和(52.8±9.59)% (n=3),两组数据经组间 t检验差异有显著性(P<0.05,图 4)。

Fig.4A The mEPSCresults of the records under perforated wholecell mode and conventional whole-cell mode in the calyx cells

Fig.4B Comparision of frequency of mEPSCdecay between perforated whole-cell mode and conventional whole-cell mode
3 讨论
穿孔膜片钳法[3]的特点是不打破电极腔下的细胞膜片,而利用在细胞膜上形成高离子通透的小孔来构成通电性回路。小孔的大小只允许一价离子通过,而不允许大分子通过,所以它具有不破坏细胞内环境的优点。
本实验研究了穿孔过程的动态变化,穿孔膜片钳记录的一般特性,amphotericin B的浓度对穿孔过程的影响,全细胞膜片钳和穿孔膜片钳方法记录mEPSC四个方面。研究表明,当电极与细胞膜形成高阻封接后,10 min左右amphotericin B可扩散到细胞膜上,30 min内形成稳定穿孔模式。在记录过程中,如果监测到串联电阻(Rs)迅速下降到20 MΩ以下,有可能是穿孔全细胞模式自发性变成传统全细胞模式。成功的穿孔全细胞模式记录过程中,串联电阻(Rs)小于70 MΩ且趋于稳定,细胞可以稳定记录1~2 h,而无常规全细胞膜片钳记录时破膜后电极尖端的细胞碎片重新堵住电极口引其记录电流畸变之虞。我们摸索了最佳的amphotericin B浓度,研究结果表明amphotericin B浓度在400μg/ml可以更快更有效的穿孔,如果继续增加浓度,会出现絮状沉淀,可能是amphotericin B过饱和导致,影响封接和穿孔的进程。在记录mEPSC的过程中,我们发现穿孔膜片钳方法可以更稳定的记录神经元的电生理特性。此方法与常规膜片钳相比的优点为:(1)大分子不能通过由amphotericin B形成的孔道,因而可避免常规膜片钳记录时细胞内重要物质渗析的影响。通道电流的衰减现象显著减慢,那些对离子通道有调控作用的胞内第二信使及信号转导物质仍能不受影响的发挥其作用;(2)Amphotericin B形成的孔道对多价离子不通透,故细胞内这些离子浓度不受电极内液的影响;(3)对细胞的损伤小,高阻封接不易破坏,记录可持续时间长[4,5]。
本研究摸索出了一种稳定的穿孔膜片钳全细胞记录技术,可以更有效,更真实的反应神经元通道电流的电生理特性。该技术适用于记录时程较长或电流有rundown现象的实验,特别是涉及胞内信号传导机制研究的实验。
[1] Horn R,Marty A.Muscarinic activation of ionic currents measured by a new whole-cell recording method[J].J Gen Physiol,1988,92(2):145-159.
[2] Schneggenburger R,Forsythe ID.The calyx of Held[J].Cell Tissue Res,2006,326(2):311-337.
[3] 陈 军.膜片钳实验技术系列讲座[J].神经解剖学杂志,1995,11(Pt 2):170-184.
[4] 王 华,李 涛,曾晓荣,等.两性霉素B与β-escin混合穿孔电极液在人心房肌细胞SK2电流记录中的应用[J].中国应用生理学杂志,2012,28(3):214-218.
[5] 崔文玉,张颖丽,殷晓峰,等.培养的大脑皮层海马及交感神经细胞钠 钾和钙离子通道的全细胞记录技术[J].中国应用生理学杂志,2005,21(1):105-109.

