鹅细小病毒PCR-DHPLC检测方法的建立
饶桂波,邵洪泽,胡桂学*,吴健敏
(1.广西兽医研究所,广西南宁530001;2.吉林省兽医科学研究所,吉林长春130062;3.吉林农业大学,吉林长春130118)
目前诊断鹅细小病毒(GPV)的主要方法有琼脂扩散试验、免疫荧光抗体试验、黄牛精子抑制试验、ELISA 和PCR 等[1-4]。近年来将变性高效液相色谱法(DHPLC)与PCR 方法结合用于微生物的检测,使PCR 方法的敏感度提高了100倍,大大提高了样品的检出率[5-6]。为了解决鹅群中因GPV 排毒量低而难以检出的问题,本研究拟建立一种敏感性更高的GPV PCR-DHPLC 检测方法,用于鹅群中GPV 的检测,为临床GPV 感染的检测,提供一种特异、敏感、快速、高通量的检测手段。
1 材料与方法
1.1 毒株
GPV JLDA 株,由吉林省畜牧兽医科学研究院赠送;GPV JLTP株,由本实验室分离保存。
1.2 试剂
Taq DNA Polymerase、dNTPs、100 bp DNA Ladder、T4DNA 连接试剂盒、pMD18-T 载体等,购自宝生物工程有限公司(大连)。
1.3 引物设计
根据GenBank中VP3 的基因序列,用Primer Premier 5.0软件设计引物,序列如下:P1:5'-ATA AGCGCC TTTCACAGC-3',P2:5'-AACGCAGGATCAGACGAA-3',由宝生物工程有限公司(大连)合成。
1.4 PCR 体系建立
采用50μL 反应体系,在0.5 mL 反应管中依次加Buffer 5μL、2.5mmol/L dNTPs 2μL、灭菌二馏水35μL、2U/μL Taq酶1μL、20pmol/μL上游引物、下游引物各1μL、模板5μL。混匀后稍离心,通过梯度PCR 确定反应条件。
1.5 DHPLC条件选择
根据变性高效液相色谱仪Aglient 1100 色谱柱:PS.DVB&C18DNASep色谱柱(4.6mm ×50 mm,粒度3mm)。利用仪器软件,根据目的基因序列的大小,碱基比率等预测柱温。在柱温确定后,摸索流动液体配比及流速,确定最佳条件。
1.6 PCR-DHPLC特异性分析
提取鹅副粘病毒、鸭瘟病毒及正常番鸭胚尿囊液的核酸进行PCR,按照1.4 的体系条件对PCR产物,进行PCR-DHPLC检测,鉴定其特异性。
1.7 PCR-DHPLC敏感性分析
将GPV JLTP株病毒接种番鸭胚,提取尿囊液中的病毒核酸作为模板,利用上述引物扩增目的片段,扩增产物连接到pMD18-T 载体上克隆。提取质粒后测浓度,然后进行10倍系列稀释,使每管含有106、105、104、103、102、101/μL 个拷贝数,并以此为模板进行PCR 扩增,检测PCR 扩增产物。
1.8 PCR-DHPLC初步应用
对吉林省畜牧兽医科学研究院保存的采自吉林省不同地区的100份病料,分别应用PCR 电泳法[7]和PCR-DHPLC方法进行检测,对比并分析其检测结果。
2 结果
2.1 GPV PCR 扩增退火温度的优化
按1.4PCR 的反应条件,选择不同的退火温度对GPV 阳性样品进行PCR 扩增,将PCR 产物在紫外灯下观察,结果在430bp处均出现预计的目的条带(图1),以退火温度为63 ℃非特异扩增带最少,故选择63 ℃为PCR 扩增的退火温度。
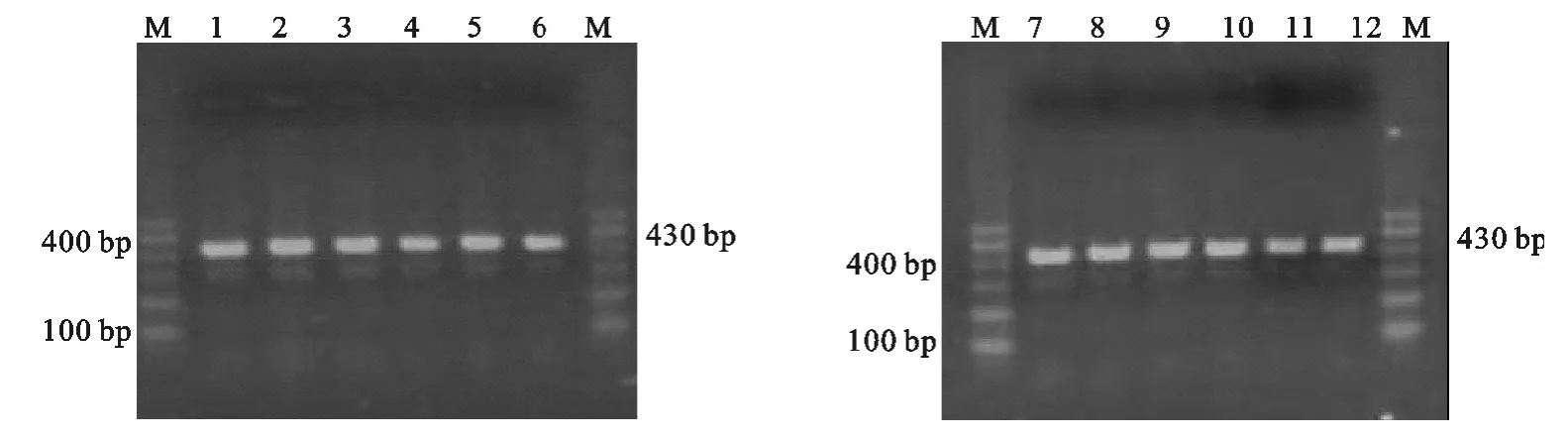
图1 不同退火温度下PCR 产物电泳结果Fig.1 The results of PCR products electrophoresis by different annealing temperatures
2.2 DHPLC法检测结果
摸索好的条件为:色谱柱:PS.DVB& C18 DNASep色谱柱(4.6 mm ×50 mm,粒度3 mm);柱温:50 ℃;流动相:体积分数为50%缓冲溶液A,体积分数为50%缓冲溶液B;流速:1mL/min。上样量:上述GPV PCR 产物5μL,检测结果如图2所示,出现预计目的峰值。
2.3 PCR-DHPLC 的特异性检测
取GPV、鹅副粘病毒、鸭瘟病毒、正常番鸭胚液用同样的方法制备核酸后,进行PCR-DHPLC 检测。试验结果如图3所示。由图3知,除GPV 出现特征性吸收峰外,而鹅副粘病毒、鸭瘟病毒、正常番鸭胚尿囊液在DHPLC分析图谱中未出现与上述一致的特征峰图,说明该方法具有较高的特异性。
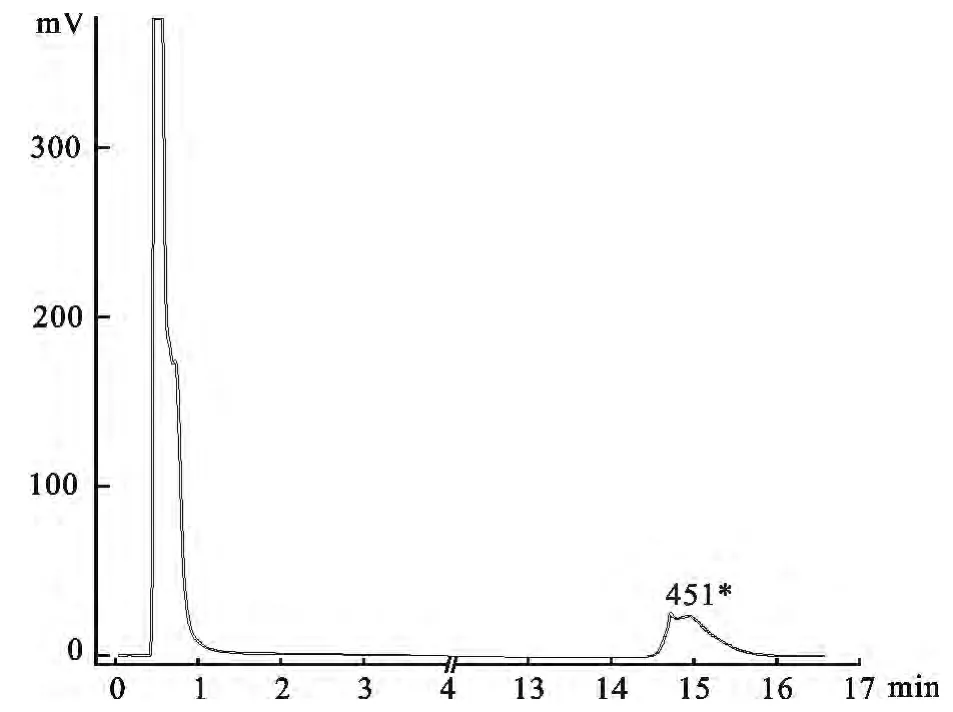
图2 DHPLC鉴定结果Fig.2 The result of DHPLC identification
2.4 PCR-DHPLC的敏感性检测
试验结果如图4、5所示,使用建立的PCR-DHPLC方法检测不同浓度的阳性标准品,检测到的最低浓度为102/μL 个拷贝数。而PCR 方法检测到的最低浓度为104/μL 个拷贝数。由此说明本研究建立的PCR-DHPLC方法敏感性比PCR电泳法高100倍。
2.5 PCR-DHPLC 临床样品检测结果
对保存的100份临床疑似样品进行检测,结果表明PCR-DHPLC检测方法与常规PCR 方法阳性符合率100%。
3 讨论
PCR-DHPLC检测方法灵敏度高,耗时短,可以进行批量操作,并且不会出现假阳性结果。本研究建立的GPV PCR-DHPLC检测方法,敏感性较高:最低能检测到102/μL 拷贝数,比常规PCR 电泳检测法高100倍、特异性强、仅对GPV 阳性样品有目的波峰、重复性和准确性较好,在100 份样品检测中,阳性样品检测结果与常规PCR 电泳法一致。本研究中该方法在初步应用中没显示出明显的敏感性优势,可能是以下原因:所检测样品容量较小;样品本身是阳性发病的或阴性未感染的;采用的病毒核酸提取方法敏感性不够等。
试验中根据GenBank 上VP3 设计的引物[8],在较大的温度跨度范围内,均能够扩增出目的片段,表明本试验设计的检测引物序列在病毒基因组上是很保守的序列,适合用于GPV 的检测。将GPV PCR 检测方法与DHPLC 进行有机结合,能够极大地提高GPV 检测的灵敏度,同时也为临床上检测大批量样品提供了可能。
相对其他的DNA 检测技术来说,变性高效液相色谱技术具有下列优点:灵敏度高,极少的核酸也能检测到[9];假阳性很少出现,结果的重复性较好;快捷方便,价格低廉,自动化程度高。一个样品的检测在10min内可以完成,花费不高,省去PCR 检测方法中制胶、跑电泳等过程,这样节省了大量的时间和花费。因此,利用变性高效液相色谱技术对突变株的筛选及核酸双链的排查,很容易实现高通量和大规模的分析;回收的DNA 片段可以直接进行PCR、测序以及克隆到载体中[10]。另外,变性高效液相色谱技术也具有安全可靠的优势,避免一些放射性元素及有害的化学药物对人体造成的伤害。
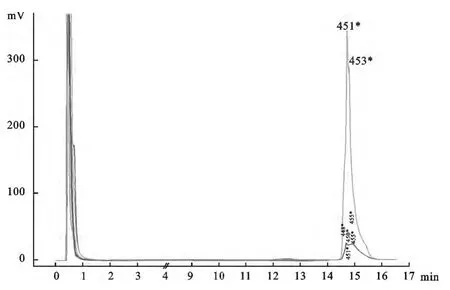
图5 PCR-DHPLC 敏感性检测结果Fig.5 The results of PCR-DHPLC sensitivity test 106、105、104、103、102(copies per milliliter)
[1]刘家森,姜 骞,司昌德,等.番鸭细小病毒与鹅细小病毒PCR鉴别诊断方法的建立[J].中国兽医科学,2007,37(6):469-472.
[2]刘 菲,唐卫杰,程安春,等.抗鹅细小病毒卵黄IgG 的制备及其间接ELISA 检测方法的建立[J].中国兽医科学,2011,41(6):601-606.
[3]Chen Z,Li C,Liu G,et al.Rapid diagnosis of goose viral infections by multiplex PCR[J].Journal of Virological Methods,2013,191(2):101-104.
[4]Fan J H,Zuo Y Z,Yang Z,et al.The development of an indirect ELISA for the detection of antibodies to goose parvovirus in blood serum[J].Letters in Applied Microbiology,2013,57(1):26-32.
[5]Aarthi P,Harini R,Sowmiya M,et al.Identification of bacteria in culture negative and polymerase chain reaction(PCR)Positive intraocular specimen from patients with infectious endopthalmitis[J].Journal of Microbiological Methods,2011,85(1):47-52.
[6]Wu J,Wang D,Song L,et al.A new familial gastric cancerrelated gene polymorphism:T1151Ain the mismatch repair gene hMLH1[J].Molecular Biology Reports,2011,38(5):3 181-3 187.
[7]胡桂学,逄 博,高凤山,等.小鹅瘟PCR 诊断方法的建立和初步应用[J].经济动物学报,2003,7(2):50-53.
[8]朱海侠,万春和,黄 瑜.鹅细小病毒基因组结构特征研究进展[J].中国动物传染病学报,2011,19(1):82-86.
[9]Telleria O,Ezpeleta G,Herrero O,et al.Validation of the PCR-DHPLC method for rapid identification of Candida glabrata phylogenetically related species in different biological matrices[J].Analytical Technologies in The Biomedical and Life Sciences,2012,893:150-156.
[10]Epp L S,Stoof-Leichsenring K R,Trauth M H,et al.Mo-lecular profiling of diatom assemblages in tropical lake sediments using taxon-specific PCR and Denaturing High-Performance Liquid Chromatography(PCR-DHPLC)[J].Molecular Ecology Resources,2011,11(5):842-853

