肉鸡屠宰加工过程中沙门氏菌的污染情况及其耐药性分析
朱冬梅,彭 珍,刘书亮,2,*,赖海梅,韩新锋,2,邹立扣
肉鸡屠宰加工过程中沙门氏菌的污染情况及其耐药性分析
朱冬梅1,彭 珍1,刘书亮1,2,*,赖海梅1,韩新锋1,2,邹立扣3
(1.四川农业大学食品学院,四川 雅安 625014;2.四川省农产品加工及贮藏工程重点实验室,四川 雅安 625014;3.四川农业大学都江堰校区微生物学实验室,四川 都江堰 611830)
目的:了解四川某肉鸡屠宰加工过程不同环节沙门氏菌的污染情况、耐药性和耐药谱,为食品安全和临床用药提供理论依据。方法:根据GB 4789.4—2010《食品安全国家标准 食品微生物学检验 沙门氏菌检验》、沙门氏菌科玛嘉显色培养基筛选疑似沙门氏菌,并针对沙门氏菌invA和hut基因的二重PCR方法对疑似沙门氏菌鉴定,再用纸片扩散法对其分离株进行10 种抗菌药物(组合)的药敏实验,参考临床和实验室标准化研究所(Clinical and Laboratory Standards Institute,CLSI)标准(2010)判定药敏结果。结果:从1 350 份样品中,分离鉴定出156 株沙门氏菌;肉鸡屠宰前沙门氏菌的污染率为13.53%;烫毛脱毛、开肛、净膛、冲淋4 个环节鸡胴体和分割鸡肉、冷冻鸡肉沙门氏菌的污染率分别为0、7.23%、9.80%、11.54%、14.50%、9.33%。沙门氏菌分离株对萘啶酸(100.00%)和氨苄西林(85.90%)的耐药率最高,对甲氧苄啶/磺胺甲噁唑(44.23%)、庆大霉素(39.10%)、四环素(35.26%)的耐药率较高,对头孢曲松敏感,多重耐药率为53.85%,共有39 种耐药谱,从肉鸡屠宰前到分割鸡肉沙门氏菌分离株的耐药谱型先下降再上升。结论:四川某肉鸡屠宰生产链中沙门氏菌的污染率及其耐药情况比较严重,且可能存在从上游向下游生产链传播的情况,需要加强卫生和抗菌药物使用监督。
沙门氏菌;肉鸡屠宰环节;污染;耐药性
沙门氏菌(Salmonella)是一种常见的人兽共患病原菌,该菌广泛分布于自然界,主要寄生于畜禽体内和蛋类中,已经发现2 500多个血清型[1]。目前,沙门氏菌中毒事件已呈全球分布,据资料统计,在我国细菌性食物中毒中,有70%~80%由沙门氏菌引起,而在引起沙门氏菌中毒的食品中,约90%是肉、蛋、奶等畜禽产品[2-3]。鸡肉是我国主要的动物性食品之一,肉鸡在养殖过程中容易受到沙门氏菌感染,且在其屠宰加工过程中,存在着交叉污染情况[4],不同环节都容易造成沙门氏菌的污染、传播,因此,实时检测肉鸡屠宰加工过程不同环节中沙门氏菌的污染分布情况,对确保鸡肉安全和食品安全有重要意义。抗生素的滥用造成大量耐药菌株的出现,相关数据表明,沙门氏菌对常用抗菌药物的耐药率随着时间的推移,呈上升趋势[5],且其耐药性能通过食物链传播到人群[6-8],对公共卫生安全构成严重的危害。
目前,对肉鸡屠宰加工过程中不同环节沙门氏菌的污染分布研究较少。采用GB 4789.4—2010《食品安全国家标准 食品微生物学检验 沙门氏菌检验》方法检验沙门氏菌操作繁琐、耗时耗力,灵敏度差,PCR方法因其快速、灵敏度高、特异性强等优点广泛应用于细菌鉴定中,尤其是多重聚合酶链式反应(polymerase chain reaction,PCR)技术在食源性致病菌的检验和鉴定上已得到较好应用[9]。目前,在沙门氏菌的PCR检测中最常用的靶基因为invA基因[10]和hut基因[9]。
本研究通 过对四川某重点肉鸡养殖场和肉鸡屠宰加工厂不同加工环节中沙门氏菌进行分离鉴定,了解沙门氏菌在不同加工环节中的污染分布及耐药情况,为兽医临床用药提供数据参考。
1 材料与方法
1.1 材料
1.1.1 样品
自四川省某重点肉鸡养殖、屠宰场采集屠宰前肉鸡粪样、屠宰加工不同环节的胴体表面样品(冲洗水)、分割鸡肉样以及冷冻鸡肉样,低温运回实验室。
1.1.2 菌株
肠炎沙门氏菌CICC21482、大肠杆菌ATCC25922四川农业大学食品微生物实验室保存。
1.1.3 引物
根据文献[9-10]针对沙门氏菌的invA基因和hut基因,设计两对特异性引物,细菌16S rDNA的PCR扩增采用通用引物(表1),由大连宝生物工程有限公司合成。

表1 靶基因名称及引物序列Table 1 Target gene and primer sequences
1.1.4 培养基
四硫磺酸钠煌绿增菌液(tetrathionate broth base,TTB)、亚硒酸盐胱氨酸(selenite cystine,SC)增菌液、胆硫乳(deoxycholate hydrogen sulfide lactose,DHL)琼脂、三铁糖琼脂、赖氨酸脱羧酶肉汤管、营养肉汤、缓冲蛋白胨水(buffered peptone water,BPW)、(Mueller-Hinton)MH琼脂 青岛高科园海博生物技术有限公司;沙门氏菌显色培养基 法国科玛嘉公司。
1.1.5 试剂
DL 2000 DNA Marker、PCR反应试剂、GoldviewTM核酸染料 宝生物工程(大连)有限公司;Bio West琼脂糖 美国Bio-Rad公司;其余试剂为分析纯或生化试剂。
1.1.6 药敏纸片
青霉素类:氨苄西林(ampicillin,AMP,10 μg/片)、阿莫西林/克拉维酸(amoxicillin/ clavulanic acid,AMC,20/10 μg/片);头孢类:头孢曲松(ceftriaxone,CRO,30 μg/片);氨基糖苷类:庆大霉素(gentamicin,GEN,10 μg/片)、大观霉素(spectinomycin,SPE,100 μg/片);四环 素类:四环素(tetracycline,TET,30 μg/片);氯霉素类:氟苯尼考(florfenicol,FLO,75 μg/片);磺胺类:甲氧苄啶/磺胺甲噁唑(trimethoprim/sulfamethoxazole,SXT,1.25/23.75 μg/片);喹诺酮类:萘啶酸(nalidixic acid,NAL,30 μg/片)、环丙沙星(ciprofloxacin,CIP,5 μg/片);以上试剂均购自赛默飞世尔生物化学(北京)有限公司。
1.1.7 仪器与设备
BSC-1300ⅡA2型生物安全柜 苏州安泰空气技术有限公司;DHP-9162恒温培养箱 上海一恒科技有限公司;SORVALL离心机 美国科俊仪器有限公司;Milli-Q超纯水系统 美国Millipore公司;C1000 Thermal Cycler PCR仪、PowerPac Basic电泳仪、水平电泳槽、凝胶成像系统 美国Bio-Rad公司。
1.2 方法
1.2.1 样品采集
沿肉鸡屠宰加工不同环节分别取样。肉鸡屠宰加工流程及采样点见图1。所有样品均低温保存运回实验室,待检。

图1 肉鸡屠宰加工流程及采样环节Fig.1 Flow chart of broiler slaughtering and sampling points
1.2.2 样品处理和增菌
无菌条件下,将蘸有粪样的棉签放置于3 mL无菌生理盐水中,浸提15 min,取浸提液0.2 mL加入3 mL无菌TTB和SC增菌液中混匀,分别在42 ℃(TTB)和37 ℃(SC)条件下增菌培养24 h;取鸡肉25 g加入225 mL无菌缓冲蛋白胨水,浸提15 min,4 ℃、10 000 r/min离心10 min,沉淀用1 mL无菌生理盐水溶解后,取0.2 mL用于增菌;污水样经4 ℃、10 000 r/min离心10 min,沉淀用1 mL无菌生理盐水溶解后,取0.2 mL用于增菌,方法同前。
1.2.3 沙门氏菌的分离
取增菌培养液5 μL划线接种于DHL琼脂平板,挑取典型菌落划线沙门氏菌显色平板,进行纯化,筛选出疑似沙门氏菌。
1.2.4 沙门氏菌的生化鉴定
按照GB 4789.4—2010方法,对分离出的疑似沙门氏菌进行三铁糖琼脂培养和赖氨酸脱羧酶实验,并按标准进行疑似沙门氏菌的判读。
1.2.5 疑似沙门氏菌分离株的二重PCR鉴定
1.2.5.1 细菌总DNA的提取
采用热裂解法[9,11]提取细菌DNA。
1.2.5.2 PCR扩增
疑似沙门氏菌二重PCR扩增反应体系:反应总体积为25.0 μL,两对引物浓度比例为c(invA)∶c(hut)= 1∶3,其中10×PCR Buffer 2.5 μL,MgCl2(25 mmol/L)1.5 μL,dNTP 2 μL,invA基因上下游引物各0.5 μL,h u t基因上下游引物各1.5 μ L,D N A 2.0 μ L,ddH2O 13.0 μL。PCR反应程序为:94 ℃预变性5 min,94 ℃变性40 s,60 ℃退火40 s,72 ℃延伸50 s,40 个循环,72 ℃延伸5 min。PCR产物于1.5%的琼脂糖(0.5×TBE)凝胶电泳后,观察并成像。
16S rDNA的PCR扩增:PCR反应体系(50 μL)为上、下游引物各2 μL(10 μmol/L),模板DNA 2 μL,10×PCR Buffer(Mg2+Free)5 μL,MgCl2(25 mmol/L)3 μL,dNTP 4 μL,TaqTM(2.5 U/μL)1 μL,ddH2O 31 μL。PCR扩增程序为94 ℃预变性5 min; 94 ℃,45 s,56 ℃,45 s,72 ℃,1.5 min,循环30 次;72 ℃延伸10 min。PCR产物电泳检测后送华大基因(上海)测序部进行序列测定。
1.2.5.3 二重PCR特异性实验
取肠炎沙门氏菌标准菌株CICC21482、大肠杆菌ATCC25922的DNA,同时设计不加模版、只加单侧引物两组对照,进行二重PCR引物特异性实验。
1.2.5.4 扩增产物测序鉴定
对肠炎沙门氏菌标准菌株CICC21482 invA和hut基因扩增片段进行胶回收后由华大基因公司克隆测序,并进行序列分析。同时,随机挑取二重PCR鉴定的沙门氏菌阳性菌株进行16S rDNA的PCR扩增,其扩增产物回收纯化后送华大基因公司克隆测序。
1.2.6 污染率的计算
经上述分离鉴定出沙门氏菌的样品为阳性样品,从每一份阳性样品中获得并保存一株沙门氏菌菌株。

1.2.7 沙门氏菌的药物敏感实验
采用临床和实验室标准化研究所(Clinical and Laboratory Standards Institute,CLSI)推荐的纸片扩散法,对沙门氏菌分离株进行10 种临床常用抗菌药物的抑菌直径测定,以大肠杆菌ATCC25922为质控菌株,按照CLSI标准[12]进行操作和结果判断。
2 结果与分析
2.1 疑似沙门氏菌分离情况
根据菌落形态从DHL平板和科玛嘉显色平板上挑取疑似沙门氏菌,通过三铁糖琼脂穿刺培养和赖氨酸脱羧酶实验结果,从1 350 份样品中分离筛选得到疑似沙门氏菌阳性样品160 份。
2.2 PCR引物特异性结果
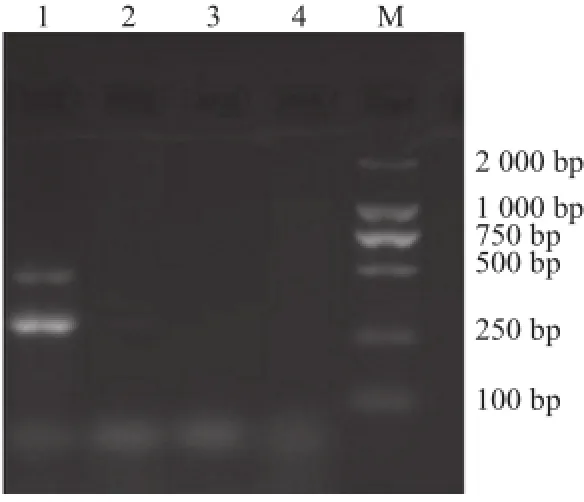
图2 沙门氏菌二重PCR特异性验证电泳图Fig.2 Electrophoresis showing the specifity of duplex PCR
对所设计的两对引物进行特异性验证,结果如图2所示,肠炎沙门氏菌CICC21482能扩增出2 条目的片段,其余对照均未扩增出片段,说明所设计的两对引物特异性可靠。
2.3 二重PCR扩增产物基因序列分析
以肠炎沙门氏菌标准菌株CICC21482的DNA为模板,扩增invA和hut基因单一基因产物序列分析表明,invA和hut基因PCR产物纯化后克隆测序分别得到长约为284、495 bp的片断,与设计大小相符,测得序列已在美国国立生物技术信息中心(National Center of Biotechnology Information,NCBI)注册,登录号分别为KF547932、KF547931;采用BLAST和DNASTAR MegAlign进行基因比对分析。
invA(KF547932)与沙门氏菌登录号EU348368.1、DQ644627.1等的invA基因序列有99.3%的同源性;hut(KF547931)与沙门氏菌登录号V01372.1、V013723.1等的invA基因序列有99.2%的同源性;进一步表明该方法正确和特异。
2.4 疑似沙门氏菌的二重PCR鉴定结果
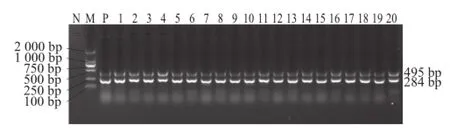
图3 部分疑似沙门氏菌二重PCR产物的电泳图Fig.3 Electrophoresis of duplex PCR-amplified products from suspected Salmonella
160 株疑似沙门氏菌的二重PCR产物的部分电泳结果如图3所示。156 株菌均同时扩增出284 bp和495 bp的特异性片段,判断为沙门氏菌阳性菌株。由此得出,所采集的样品有156 份为沙门氏菌阳性。
2.5 16S rDNA扩增产物基因序列分析
随机挑取两株二重PCR鉴定为沙门氏菌的阳性菌株,进行16S rDNA扩增,PCR扩增产物经测序后得到长约1 465 bp的片段,通过NCBI上的BLAST程序和DNASTAR的MegAlign软件进行比对分析,得出该两株菌的同源性达到100%,且其与登录号为FJ465088.1、EU118105.1的肠炎沙门氏菌同源性均达到99.0%~99.6%,由此可见,该两株菌均为肠炎沙门氏菌,进一步表明invA和hut基因的二重PCR方法鉴定沙门氏菌结果准确。
2.6 肉鸡屠宰加工不同环节中沙门氏菌的污染情况
由图4可知,屠宰前(即养殖场)肉鸡沙门氏菌污染率为13.53%(82/606)。肉鸡经烫毛脱毛处理后,肉鸡表面的沙门氏菌检出率为0;经开肛处理后,肉鸡表面沙门氏菌的污染率为7.23%(12/166),可能是在开肛过程中,部分肠道内容物的溢出,污染鸡肉表面所致;取出内脏后,鸡肉表面及其胴体冲洗水中,沙门氏菌的污染率分别为9.80%(10/102)和11.54%(69/78),其污染率较之前环节上升,其原因是在于取出内脏环节,肠道内容物可能溢出,污染鸡肉表面。鸡肉分割链条中,沙门氏菌的污染率为14.5%(29/200),经冷冻处理后,鸡肉中沙门氏菌的污染率为9.33%(14/150)。肉鸡屠宰加工过程中沙门氏菌的污染率呈现先下降后上升,再下降的趋势。
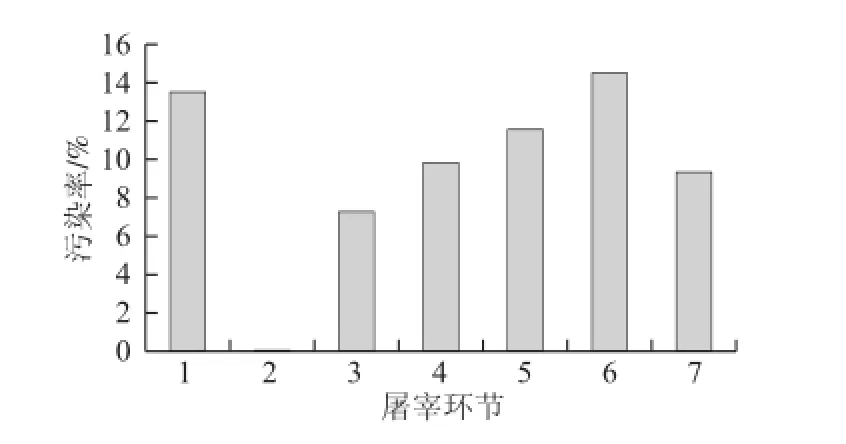
图4 鸡肉生产不同环节中沙门氏菌的污染率Fig.4 Contamination rates of Salmonella from broiler slaughter and processing chain
2.7 沙门氏菌分离菌株的耐药情况
根据CLSI(2010)标准,对药敏结果进行判读,统计出耐药和中介耐药沙门氏菌菌株数,并计算沙门氏菌分离株对各种抗菌药物的耐药率。本研究中156 株沙门氏菌分离株对10 种抗菌药物(组合)的耐药率统计见图5。
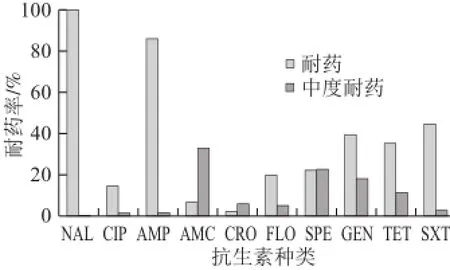
图5 鸡肉生产不同环节中沙门氏菌的耐药性(n=156)Fig.5 R esistance rates of Salmonella from broiler slaughter and processing chain (n = 156)
由图5可知,沙门氏菌分离株对萘啶酸和氨苄西林的耐药率最高,分别为100.00%、85.90%,对SXT(44.23%)、GEN(39.10%)、TET(35.26%)、SPE(21.79%)的耐药率较高;对FLO(19.23%)、CIP(14.10%)和AMC(6.41%)的耐药率较低,但对AMC的中介耐药较高,为32.69%,对CRO耐药率低,仅为1.92%。多重耐药率(耐3 种药物及以上)为51.28%。
2.8 沙门氏菌分离菌株的多重耐药性及耐药谱
肉鸡屠宰加工过程中分离的156 株沙门氏菌对10 种抗菌药物(组合)产生了39 种耐药谱耐药谱,NAL、AMP优势明显,为85.90%(134/156);屠宰前(养殖场)肉鸡沙门氏菌分离株对10 种抗菌药物(组合)产生了24 种耐药谱,肉鸡屠宰环节(脱毛、掏膛、冲洗)沙门氏菌分离株对10 种抗菌药物(组合)产生了12 种耐药谱,分割及冷冻鸡肉中沙门氏菌分离株对10 种抗菌药物(组合)产生了20 种耐药谱,在肉鸡屠宰加工过程中,从上游屠宰前(养殖场)肉鸡,到下游屠宰加工后的鸡肉成品,沙门氏菌分离株的耐药谱有先变窄后上升的趋势,其原因可能是由于在鸡肉的生产环节中,从养殖到屠宰环节,再到鸡肉成品,沙门氏菌的污染率先下降再上升有关。
本研究结果显示,所有受试沙门氏菌,共发现156 株对10 种抗菌药物(组合)产生不同程度的多重耐药性,耐3~5 种药物的46 株(29.49%),耐6~9 种药物的38株(24.36%),其中耐6、7种药物的均为15 株(9.62%),有3 株(1.92%)沙门氏菌对9 种抗菌药物具有耐药性,不同环节菌株对抗菌药物(组合)的多重耐药情况见图6。

图6 肉鸡屠宰加工过程中沙门氏菌的多重耐药情况(n=156)Fig.6 Distribution of multiple antibiotic resistance of Salmonella from broiler production chain (n = 156)
3 讨 论
invA和hut基因[9-10]常用于沙门氏菌的二重PCR鉴定中,克服了针对某单一基因设计的引物其灵敏度和特异性难以满足现阶段的检测要求[9],Cocolin[13]、陈晓玲[14]等利用invA和hut基因设计单一引物分别扩增出大小为284 bp和495 bp的片段,邵碧英等[9]建立了invA和hut基因的多重PCR检测方法,其检测结果与预期一致。本实验运用此方法,并进一步采用16S rDNA序列分析,结果说明invA和hut基因的两对引物准确可靠。
本研究将传统的平板分离和PCR技术相结合,分析了肉鸡屠宰加工不同环节中沙门氏菌的污染和耐药情况,获得了较为全面系统的数据。结果发现,肉鸡屠宰加工不同环节中沙门氏菌的污染率差异明显。在屠宰前(养殖场)肉鸡的粪样中沙门氏菌污染率较高,为13.53%,与张秀丽等[15]的报道较为相近,高于侯小刚[16]的报道;从养殖场到屠宰加工的各个环节,沙门氏菌污染率呈现先下降后上升、再下降的趋势,尤其在冷冻保存后,沙门氏菌的污染率下降,这可能是由于污染沙门氏菌菌量少的肉品在冷冻过程中,低温使其失活所致[17],但污染菌量较多的肉品可能导致部分沙门氏菌存活,当温度适宜其生长时,其有可能进行生长繁殖,存在潜在风险[18];在屠宰加工环节中,沙门氏菌的污染率在分割后的鸡肉中达到最高,为14.50%,其原因可能是由于在掏取内脏过程中,肠道内容物溢出,鸡肉表面易被粪便等污染,并且在分割的长链条环境和人员操作下存在严重的交叉污染所致。石颖等[19]的调查发现,市场鸡肉中沙门氏菌的污染率高达69.9%,高于本实验研究,说明环境卫生、从业人员的操作等都有可能造成肉品的污染,相关部门应加强卫生安全管理。
近年来,由于疾病治疗及抗生素类饲料添加剂的大量使用,使沙门氏菌耐药性迅速传播,且其耐药性逐渐增强。本研究中沙门氏菌分离株整体对萘啶酸、氨苄西林、四环素、甲氧苄啶/磺胺甲噁唑、庆大霉素耐药率较高,均在30%以上,对环丙沙星、氟苯尼考、大观霉素、阿莫西林/克拉维酸的耐药率较低,对头孢曲松敏感;所有的沙门氏菌分离株耐两种抗菌药物及以上,53.85%的沙门氏菌耐3 种以上抗菌药物。yan等[20]对中国北方市场上零售肉中的沙门氏菌药敏实验结果表明,其对萘啶酸、四环素和氨苄西林的耐药率较高,分别为30.9%、19.8%和16.0%,本研究中沙门氏菌分离株对该3 种抗菌药物的耐药性均高于上述研究,但沙门氏菌分离株耐受抗生素种类较为一致;与杨保伟等[21]的研究结果相比较,本实验中沙门氏菌分离株对萘啶酸、氨苄西林的耐药性呈上升趋势,对四环素的耐药率有所下降。同一地区沙门氏菌的耐药性随着时间的推移有着变化,有对原本敏感的抗菌药物存在耐药的趋势。侯小刚[16]从四川省鸡肉生产链中分离的沙门氏菌对氟苯尼考的耐药率仅为10.00%,本研究结果为19.23%。综上可以看出,食源性沙门氏菌的耐药性不断增强,且肉鸡屠宰加工过程中,沙门氏菌的耐药谱从上游养殖场到屠宰过程再到成品鸡肉,呈下降趋势,且与污染率呈正相关,说明沙门氏菌的耐药性有从上游环节向下游环节传播趋势,如果不从食品生产的源头控制细菌的耐药性将难以保证食品安全。
本研究分析了四川肉鸡屠宰加工过程不同环节中沙门氏菌的污染和耐药情况,其数据显示,肉鸡屠宰加工过程中沙门氏菌的污染率较为严重,且其耐药性较高,生产经营者应采取危害分析与关键控制点(hazard analysis and critical control points,HACCP)管理体系,控制肉鸡屠宰过程中沙门氏菌的污染及其耐药菌株的产生及危害。
参考文献:
[1] 刘书花, 张瑞凌, 丁尚志, 等. 3类食品中沙门氏菌PCR快速检测方法的建立[J]. 现代农业科技, 2010(23): 324-325.
[2] 王娟, 郑增忍, 王玉东, 等. 市售禽肉产品中沙门氏菌污染状况调查[J].中国动物检疫, 2010(7): 50.
[3] VO A T, DUIJKEREN E, FLUIT A C, et al. Distribution of Salmonella enterica serovars from humans, livestock and meat in Vietnam and the dominance of Salmonella typhimurium phage type 90[J]. Veterinary Microbiology, 2006, 113(1/2): 153-158.
[4] 朱恒文, 方艳红, 王元兰, 等. 肉鸡屠宰加工生产链中沙门氏菌的污染情况调查及ERIC-PCR溯源[J]. 食品科学, 2012, 33(17): 48-52.
[5] BREUIL J, BRISABOIS A, CASIN I, et al. Antibiotic resistance in Salmoella isolated from humans and animals in France: comparative data from 1994 to 1997[J]. Anitimicrobial Chemother, 2000, 46(6): 965-971.
[6] MUKHOPADHyAyA B B, HISHyA S K. Incidence of colibacillosis in chicks in some poultry pockets of west Bengal[J]. Indian Journal of Poultry Science, 1992, 27(2): 103-107.
[7] 袁正宏. 微生物感染与抗生素耐药[J]. 国外医学: 微生物学分册, 2000, 23(5): 39.
[8] 马红霞, 邓旭明, 欧阳红生. 细菌多重耐药分子机制的研究进展[J].国外医药: 抗生素分册, 2002, 23(3): 102-106.
[9] 邵碧英, 陈彬, 汤敏英, 等. 沙门氏菌多重PCR检测方法的建立[J].食品科学, 2007, 28(10): 489-492.
[10] GALAN J E, GINOCCCHIO C, COSTEAS P. Molecular and functional characterization of the Salmonella invasion gene invA: homology of invA to members of a new protein family[J]. Journal of Bacteriology, 1992, 174(13): 4338-4349.
[11] 许会会, 雷连成, 谢芳, 等. 沙门氏菌PCR检测方法的建立[J]. 中国畜牧兽医, 2010, 37(4): 94-97.
[12] Clinical and Laboratory Standars Institute. Performance Standards for Antimicrobial Susceptibility Testing; Twentith Informational Supplement. M100-S20[S]. Wayne, PA, USA 2010.
[13] COCOLIN L, MANZANO M, CANTONI C, et al. Use of polymerase chain reaction and restriction enzyme analysis to directly detect and identify Salmonella typhimurium in food[J]. Journal of Applied Microbiology, 1998, 85(4): 673-677.
[14] 陈晓玲, 周玲艳, 温仕杰, 等. 沙门氏菌PCR快速检测技术研究[J].湖北农业科学, 2009(3): 527-529.
[15] 张秀丽, 杨保伟, 廖兴广, 等. 河南省鹤壁市食源性和禽源性沙门氏菌耐药性研究[J]. 中国人兽共患病学报, 2010, 26(12): 1134-1136.
[16] 侯小刚. 四川主要肉品生产链中沙门氏菌的分离鉴定、耐药性分析及PFGE分型[D]. 雅安: 四川农业大学, 2012.
[17] Scientifi c Steering Committee. Risk assessment of food borne bacterial pathogens: quantiative methodology relevant for human exposure assessment[R]. Europe: European Commission Health and Consumer Protection Directorate-General, 2003.
[18] 朱玲, 许喜林, 周彦良, 等. 加工肉鸡中沙门氏菌风险评估[J]. 现代食品科技, 2009, 25(7): 825-829.
[19] 石颖, 杨保伟, 师俊玲, 等. 陕西关中畜禽肉及凉拌菜中沙门氏菌污染分析[J]. 西北农业科学, 2011, 20(7): 22-27.
[20] yAN H, LI L, JAHANGIR M A, et al. Prevalence and antimicrobial resistance of Salmonella in retail foods in northern China[J]. International Journal of Food Microbiology, 2010, 143(3): 230-234.
[21] 杨保伟, 盛敏, 席美丽, 等. 食源性沙门氏菌耐药性检测及相关质粒[J].微生物学报, 2008, 48(8): 1006-1012.
Contamination and Antimicrobial Resistance Patterns of Salmonella spp. from Broiler Slaughter and Processing Chain
ZHU Dong-mei1, PENG Zhen1, LIU Shu-liang1,2,*, LAI Hai-mei1, HAN Xin-feng1,2, ZOU Li-kou3
(1. College of Food Science, Sichuan Agricultural University, ya’an 625014, China; 2. Key Laboratory of Agricultural Products Processing and Preservation Engineering of Sichuan Province, ya’an 625014, China; 3. Laboratory of Microbiology, Dujiangyan Campus of Sichuan Agricultural University, Dujiangyan 611830, China)
According to the National Food Safety St andard, Food Microbiological Examination: Salmonella (GB 4789.4—2010), CHROMagar medium was used for the isolation of Salmonella from 1 350 samples collected from broiler slaughter and processing chain. The duplex PCR method for invA and hut gene was used to further identify the isolated strains. The isolated Salmonella strains were tested for their antimicrobial susceptibility against 10 kinds of antibiotics (combination) by using Kirby-Bauer method. The susceptibility was determined by the standard of Clinical and Laboratory Standards Institute (CLSI, 2010). The results showed that 156 strains of Salmonella were identifi ed from the samples. Approximately 13.53% of the broiler feces samples were Salmon ella positive. The occurrences of Salmonella contamination after defeathering, bowel, evisceration and cleaning were 0.00%, 7.23%, 9.80% and 11.54%, respectively. The occurrences of Salmonella contamination before and after chilling were 14.50% and 9.33%, respectively. For Salmonella isolated from broiler slaughter and processing chain, the highest drug-resistance of all strains was nalidixic acid (100%) and ampicillin (85.90%). Many isolates were resistant to trimethoprim/sulfamethoxazole (44.23%), gentamicin (39.10%) and tetracycline (35.26%). All of the isolates were susceptible to ceftriaxon, and 53.85% of them were multi-drug resistance. The Salmonella isolates from broiler slaughter and processing chain had 39 antimicrobial resistance profiles. Therefore, the contamination and drugresistance of Salmonella were severe in the broiler production chain.
Salmonella; broiler slaughter and processing chain; contamination; antimicrobial resistance
R155.5
A
1002-6630(2014)17-0214-06
10.7506/spkx1002-6630-201417041
2013-08-19
公益性行业(农业)科研专项(200903055)
朱冬梅(1989—),女,硕士研究生,研究方向为食品微生物。E-mail:zdm1228@126.com
*通信作者:刘书亮(1968—),男,教授,博士,研究方向为食品微生物与发酵工程。E-mail:lsliang999@163.com

