玉米籽粒低氧胁迫发芽期间主要生理生化和γ-氨基丁酸含量变化
尹永祺,吴进贤,刘春泉,李大婧,杨润强,顾振新,*
玉米籽粒低氧胁迫发芽期间主要生理生化和γ-氨基丁酸含量变化
尹永祺1,吴进贤1,刘春泉2,李大婧2,杨润强1,顾振新1,*
(1.南京农业大学 农业部农畜产品加工与质量控制重点开放实验室,江苏 南京 210095;2.江苏省农业科学院农产品加工研究所,江苏 南京 210014)
以玉米籽粒为材料研究低氧胁迫下籽粒发芽过程中主要生理生化和γ-氨基丁酸(γ-aminobutyric acid,GABA)含量变化,筛选出最适富集GABA的玉米品种。结果表明:5 个品种玉米籽粒在72 h低氧胁迫发芽期间,芽长增长15.5~26.3 mm,呼吸强度提高1.7~3.2 倍,干物质损失35.6%~40.6%,淀粉消耗15.5%~28.9%,还原糖和游离氨基酸含量分别增加1.7~4.7 倍和7.4~13.3 倍,GABA含量提高9.3~13.2 倍,不同品种玉米籽粒发芽能力和GABA富集量呈显著差异,以京甜紫花糯(ZHN)品种发芽率最高,达到85.5%,且GABA富集量达到0.65 mg/g(以干质量计),ZHN是富集GABA的最适玉米品种。低氧胁迫下发芽玉米中GABA含量与芽长、呼吸强度、游离氨基酸呈极显著正相关(P<0.01),玉米经低氧胁迫发芽能提升玉米营养品质。
玉米籽粒;发芽;低氧胁迫;γ-氨基丁酸
玉米(Zea mays L.),又名玉米黍、棒子和苞谷等,系玉米黍属一年生禾本科植物,是我国重要的粮食作物之一。玉米籽粒营养丰富,除含有蛋白质、脂肪和胡萝卜素外,还富含不饱和脂肪酸、谷胱甘肽、膳食纤维、维生素和微量元素等营养成分[1]。但是玉米蛋白结构不合理,且人体对其消化吸收和利用率低[2],因而玉米一直被视为“粗粮”,在食品工业中其利用率仅为6%[3]。发芽是改变谷物营养成分和抗营养因子的一种方法,其能提升玉米营养品质[4],降低抗营养因子水平,改善口感,优化食用加工性能[5]。据报道,粟谷[6]、糙米[7]、蚕豆[8]和大豆[9]等植物性食品原料在低氧[10]、盐胁迫[11]及其联合胁迫[12]等逆境条件下发芽后,其功能性保健成分γ-氨基丁酸(γ-aminobutyric acid,GABA)含量显著增加。GABA是哺乳动物中枢神经系统中主要的抑制性神经递质,已被国家卫生部批准为新资源食品,具有改善大脑血液循环、降低血压、治疗癫痫和痛风等多种功效。然而,人工调控玉米籽粒胁迫发芽的相关研究还未见报道。本实验以玉米籽粒为实验材料,研究低氧胁迫下玉米发芽过程中营养成分和GABA含量的变化,旨在通过逆境胁迫富集发芽玉米中GABA含量,以期为玉米保健功能性食品开发提供技术参考和理论依据,推动玉米深加工产业的科学化发展。
1 材料与方法
1.1 材料与试剂
选用的5 个玉米品种特性及选育单位见表1。所有原料均购于2012年,收获后封装于密闭容器中,4 ℃保存备用。
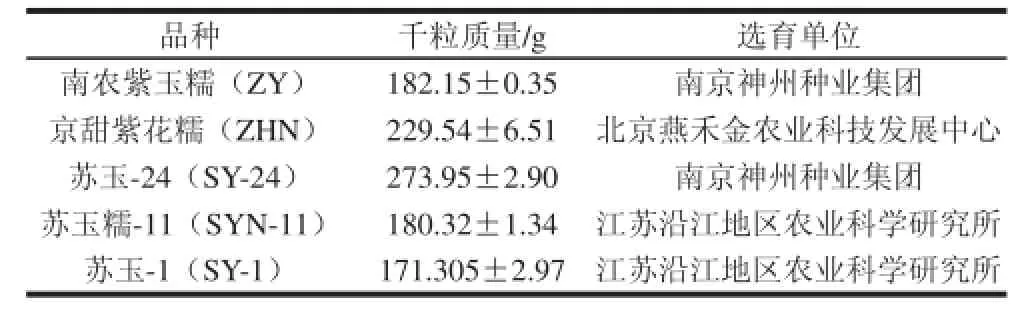
表1 玉米品种Table 1 Description of maize cultivars
G ABA标准品和对二甲氨基苯磺酰氯 美国Sigma公司;其他试剂均为国产分析纯。
1.2 实验设计
称取成熟饱满未破损的玉米籽粒,用1%的次氯酸钠溶液浸泡消毒30 min,去离子水冲洗至pH值中性后置于培养箱中30 ℃黑暗条件下浸泡12 h,浸泡结束以去离子水为培养液,通入空气(通气量1.0 L/min),于30 ℃浸泡发芽3 d,每隔12 h取样。玉米发芽期间,每隔12 h更换培养液,直至培养结束。发芽玉米取出用去离子水清洗并吸干表面水分。鲜样用于测定发芽率、芽长和呼吸强度,干燥后的样品经磨粉机粉碎后,过60 目筛用于测定可溶性蛋白质、游离氨基酸、淀粉、还原糖和GABA含量。
1.3 测定指标与方法
芽长:随机选取20 粒发芽玉米籽粒,用游标卡尺测定其芽长;发芽率:按照GB/T5520—2011《粮油检验籽粒发芽试验》[13]测定;呼吸强度:参照郑永华等[14]的方法测定,结果以干质量计;干物质含量:采用烘干恒重法[15]测定;还原糖含量:采用3,5-二硝基水杨酸法[15]测定,结果以干质量计;可溶性蛋白质含量:采用考马斯亮蓝G-250法[15]测定,结果以干质量计;游离氨基酸含量:采用茚三酮溶液显色法[15]测定,结果以干质量计;GABA含量:参照Bai Qingyun等[11]的方法测定,结果以干质量计。
2 结果与分析
2.1 不同品种玉米低氧胁迫下主要理化指标和GABA的含量
2.1.1 发芽率
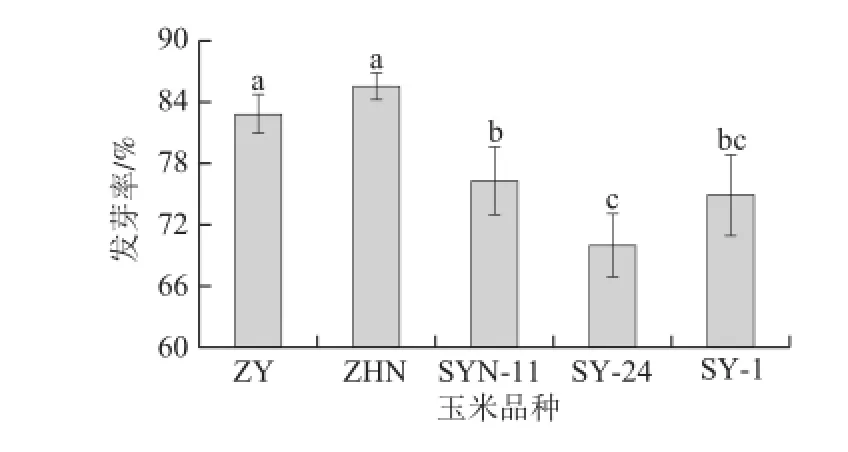
图1 不同品种玉米低氧胁迫下发芽率变化Fig.1 Germination rate of maize cultivars after germination under hypoxia
由图1可知,低氧胁迫发芽72 h时,各品种玉米的发芽率具有显著性差异。ZHN玉米的发芽率最高,达85.5%;其次为ZY,发芽率为82.7%;而玉米SYN-11、SY-1和SY-24的发芽率较ZHN玉米均显著降低,其中玉米SY-24的发芽率仅为69%。
2.1.2 芽长

图2 不同品种玉米低氧胁迫下发芽后的芽长Fig.2 Sprout length of maize cultivars after germination under hypoxia
由图2可知,经低氧胁迫发芽72 h后,各品种玉米的芽长具有显著性差异。ZY品种芽长最长,达26.3 mm,分别是SYN-11、SY-1和SY-24品种芽长的1.3、1.6 倍和1.7 倍。
2.1.3 呼吸强度

图3 玉米低氧胁迫发芽期间呼吸强度的变化Fig.3 Change in respiratory rate of maize cultivars during germination under hypoxia
由图3可知,低氧胁迫发芽0~72 h范围内,各品种玉米的呼吸强度变化趋势一致,其均随发芽时间的延长呈先下降后持续增强的趋势。发芽期间SY-24品种呼吸强度增幅最大,其次是ZY,而SYN-11、SY-1和ZHN发芽期间呼吸强度较低。发芽72 h时,5 种品种玉米呼吸强度比发芽前升高1.7~3.2 倍。玉米呼吸强度变化与其芽长变化趋势一致,其呈极显著正相关(r=0.921,P<0.05)。
2.1.4 干物质含量
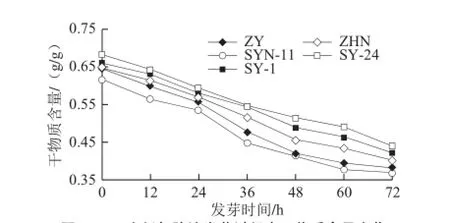
图4 玉米低氧胁迫发芽过程中干物质含量变化Fig.4 Change in dry matter of five maize cultivars during germination under hypoxia
由图4可知,低氧胁迫发芽0~72 h范围内,各品种玉米的干物质含量变化趋势一致,其均随发芽时间的延长持续下降。发芽72 h时,5 个品种玉米干物质含量仅为发芽前的59.4%~64.4%。
2.1.5 可溶性蛋白质含量
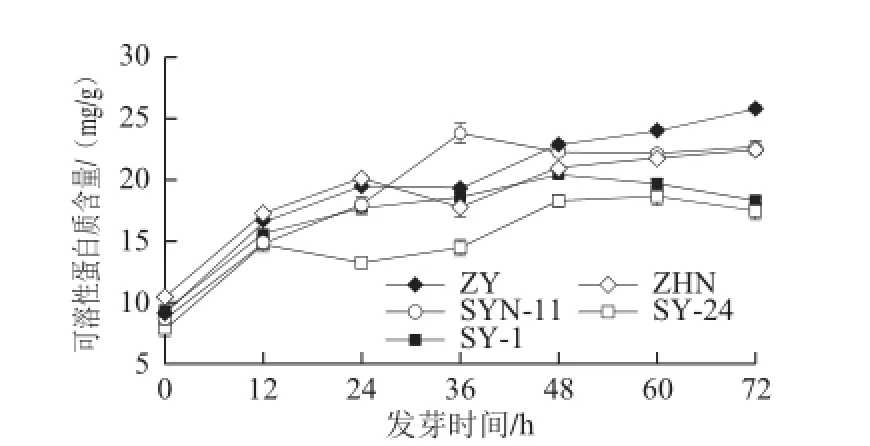
图5 玉米低氧胁迫发芽期间可溶性蛋白质含量的变化Fig.5 Change in soluble protein content of maize cultivars during germination under hypoxia
由图5可知,在72 h的发芽期内,5 个品种玉米中可溶性蛋白质含量变化均呈先增加后趋于稳定的趋势,但各品种可溶性蛋白质含量达到峰值的时间存在差异。ZHN和ZY品种发芽24 h内含量增加,随后含量有所下降,48 h后均缓慢增加,发芽72 h时分别达到22.45、25.87 mg/g干质量。而SYN-11品种在36 h 时含量即达到最高,之后趋于稳定,SY-1发芽期间其48 h时可溶性蛋白质含量最高。
2.1.6 游离氨基酸含量
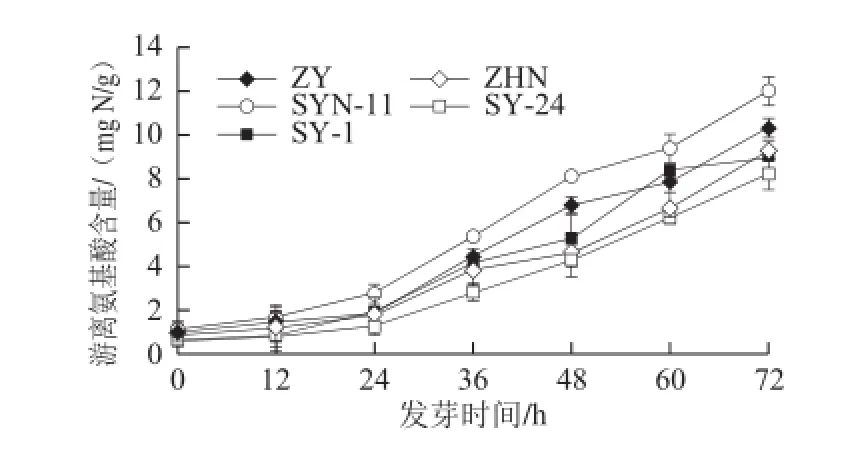
图6 玉米低氧胁迫发芽期间游离氨基酸含量的变化Fig.6 Change in free amino acid content of maize cultivars during germination under hypoxia
由图6可知,玉米发芽期间游离氨基酸含量均呈持续增加趋势。发芽72 h时,SYN-11品种的游离氨基酸含量最高达11.98 mg N/g,其次依次为品种ZY、ZHN、SY-1和SY-24,其氨基酸含量分别为发芽初始的11.5、11.6、9.2、7.4 倍和13.3 倍,表明玉米经发芽可改善玉米蛋白品质并增加游离氨基酸含量。
2.1.7 淀粉含量
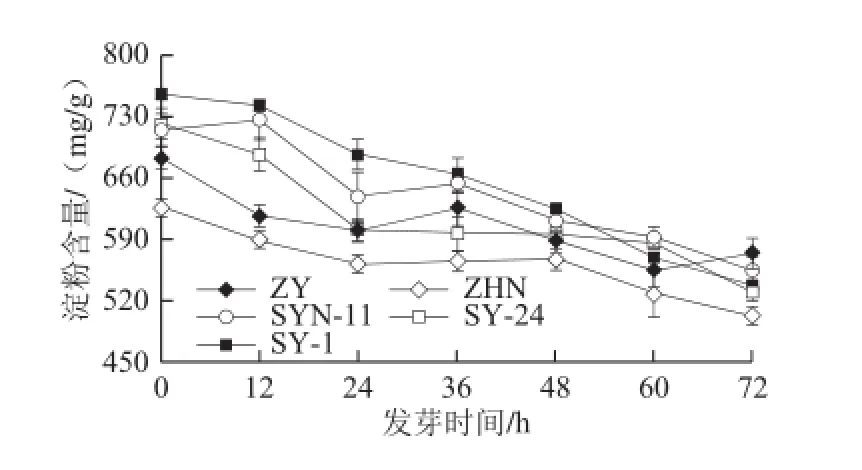
图7 玉米低氧胁迫发芽过程中淀粉含量的变化Fig.7 Change in starch content of maize cultivars during germination under hypoxia
由图7可知,发芽初始各品种玉米中淀粉含量存在差异,其后随发芽时间的延长均成持续下降趋势。低氧胁迫发芽72 h后,品种ZY淀粉含量最高,5 种玉米淀粉消耗率达15.5%~28.9%。
2.1.8 还原糖含量
由图8可知,同一发芽时间点不同品种玉米中还原糖含量存在差异,发芽期间各品种玉米还原糖含量较发芽初始时均增加。发芽72 h后5 种玉米中还原糖含量增加1.7~4.7 倍,其中SY-24在发芽36 h后还原糖含量即开始缓慢下降,其他品种则在60 h才开始有含量下降的现象发生,另外品种ZY和SYN-11的还原糖含量在发芽60 h时含量最高,分别是发芽0 h的4.4 倍和4.1 倍。
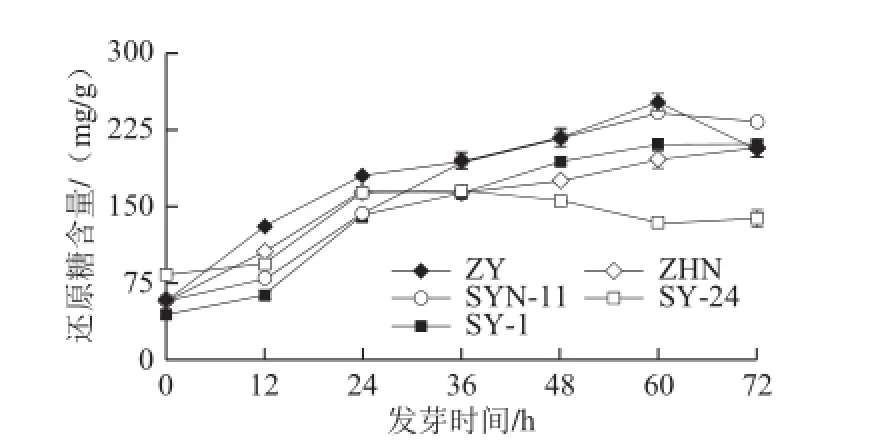
图8 玉米发芽过程中还原糖含量变化Fig.8 Change in reducing sugar of maize cultivars during germination under hypoxia
2.1.9 GABA含量
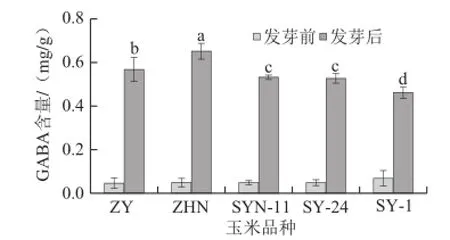
图9 玉米低氧胁迫发芽期间GABA含量的变化Fig.9 GABA content of maize cultivars after germination under hypoxia
由图9可知,发芽72 h时,各品种玉米中GABA含量存在显著性差异。ZHN品种玉米中GABA含量最高达0.65 mg/g,其较发芽初始增加13.2倍;ZY中的GABA含量为0.56 mg/g,增加12.9 倍;SYN-11、SY-24和SY-1品种玉米的GABA含量显著低于ZHN和ZY品种。
2.2 玉米发芽生理生化指标和GABA含量的相关性分析
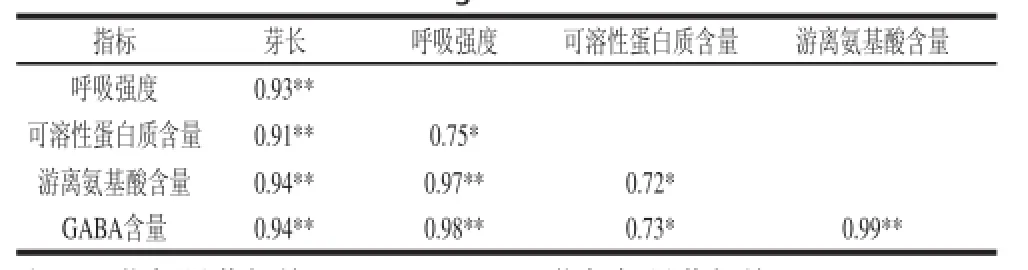
表2 发芽玉米生理指标和GABA含量的相关性分析Table 2 Correlation analysis between physiological indexes and GABA content in germinated maize
玉米发芽期间GABA含量提高,芽长增长,呼吸强度增加,可溶性蛋白质和游离氨基酸含量增加,这些指标的相关性分析结果见表2。品种ZHN在0~72 h低氧胁迫发芽期间,GABA含量与芽长、呼吸强度、游离氨基酸的相关系数r均高于0.90,呈极显著正相关(P<0.01),与可溶性蛋白质含量也呈显著正相关(P<0.05)。随着发芽时间的延长,玉米芽长增长,呼吸强度增大,从而使干物质含量降低。同时,在蛋白酶的作用下,大分子的贮藏蛋白分解为小分子的可溶性蛋白质和游离氨基酸,这种变化有利于GABA的富集。
比较5 个玉米品种在低氧胁迫发芽72 h时的GABA含量与相关生理生化指标,可以权衡出品种ZHN在低氧胁迫条件下发芽富集GABA能力高于其他品种。故玉米ZHN可作为低氧胁迫富集GABA的良好材料。
3 讨 论
低氧胁迫是指植物生长的环境中溶氧浓度低于正常大气中浓度。植物在低氧环境中,其正常呼吸受到抑制,新陈代谢和生长速度减缓[9,16]。当电子传递链受到抑制后,糖类经糖酵解途径转化为丙酮酸,然后生成乳酸和乙醇,导致细胞质酸化。存在于植物细胞质中谷氨酸脱羧酶(glutamate decarboxylase,GAD)在酸性条件下被激活,催化Glu脱羧生成GABA,从而达到GABA富集的效果[17]。溶液中氧气浓度较低,可以形成低氧环境。目前采用浸泡方式处理籽粒,形成低氧环境以达到富集GABA的目的。本实验选择30 ℃温度、黑暗条件、去离子水浸泡并通以1.0 L/min空气进行发芽,是一种低氧胁迫发芽方式。选择最适发芽温度(30 ℃)可避免不适当的温度引起的双重胁迫。若选择非最适温度,逆境胁迫程度加深,玉米发芽率低且易致致死亡。选择通气量1.0 L/min条件是参考糙米[18]和蚕豆[19]发芽富集GABA通气条件、结合玉米发芽预实验以GABA含量为指标选择的结果。
玉米籽粒呼吸增强是萌发过程中最显著的生理变化之一。本实验中5 个玉米品种的呼吸强度在萌发12 h后显著增强,与报道的稻、麦等禾谷类种子变化趋势一致。但是玉米在0~24 h阶段呼吸强度是先减弱后增强的,这与玉米萌发初期无氧呼吸占主导地位的特点有关[2]。呼吸作用的增强表明玉米营养物质代谢旺盛,大量有机物质被酶分解消耗,这正是本研究中干物质含量在玉米发芽过程中逐渐降低的原因。刘娟等[4]研究表明,玉米正常发芽84 h时其干物质含量降至未发芽的50%左右,本实验中干物质含量消耗速率较正常发芽低,这与低氧胁迫下呼吸作用被抑制有关。可溶性蛋白质与游离氨基酸关系紧密,可溶性蛋白质在发芽期间含量增高可推测是酶系统的组建和完成,这验证了薛云皓等[20]得出玉米发芽期间可溶性蛋白质含量逐渐增的结果。游离氨基酸含量大幅度增加,可视为贮藏蛋白在蛋白酶作用下消解的结果以及新蛋白物质合成的开启。此外,可溶性蛋白质与游离氨基酸的含量变化,促进了相关酶活性增加、增加了合成GABA的底物形成。发芽过程中在淀粉含量减少的同时还原糖含量增加,这有利于玉米营养被人体吸收利用和食用品质的改善[21-22]。
根据芽长与GABA相关性分析发现,芽长与GABA相关性高达0.94,呈现显著相关性。糙米[23]和粟谷[24]中GABA含量与芽长也均呈显著正相关。芽体长则表明玉米生理状态良好,此时GABA富集量高,这表明GABA是植物、特别是新生植物抵御胁迫的重要调节因子[25]。可溶性蛋白质和游离氨基酸也与GABA呈正相关。因此,不同品种玉米可溶性蛋白质和游离氨基酸含量差异也会导致GABA含量差异。推测可溶性蛋白质含量在一定程度上反映了酶的活性,其含量增加则酶促反应程度高,而氨基酸含量的提高为GABA富集提供了充足的底物,因而促进了GABA的富集。
[1] 任军, 才卓, 张志军, 等. 玉米的营养品质及发展方向[J]. 玉米科学, 2006, 14(2): 93-95.
[2] 赵可夫. 玉米生理[M]. 济南: 山东科学技术出版社, 1982.
[3] 龚魁杰, 许金芳, 吴建军. 中国玉米食品加工业的现状与发展对策[J].粮食科技与经济, 2003, 28(3): 43-44.
[4] 刘娟, 史晓媛, 王庆南, 等. 玉米发芽过程中碳水化合物代谢变化的研究[J]. 食品科学, 2011, 32(11): 97-102.
[5] 张钟, 叶华, 孙青月. 发芽对黑糯玉米营养成分, 热能变化和蛋白质消化率的影响[J]. 中国粮油学报, 2009, 24(10): 36-40.
[6] BAI Qinyun, YANG Runqiang, ZHANG Lixia, et al. Salt stress induces accumulation of gamma-aminobutyric acid in germinated foxtail millet (Setaria italica L.)[J]. Cereal Chemistry, 2013, 90(2): 145-149.
[7] KOMATSUZAKI N, TSUKAHARA K, TOYOSHIMA H, et al. Effect of soaking and gaseous treatment on GABA content in germinated brown rice[J]. Journal of Food Engineering, 2007, 78(2): 556-560.
[8] LI Yan, BAI Qingyun, JIN Xinjiang, et al. Effects of cultivar and culture conditions on gamma-aminobutyric acid accumulation in germinated fava beans (Vicia faba L.)[J]. Journal of the Science of Food and Agriculture, 2010, 90(1): 52-57.
[9] GUO Yuanxin, CHEN Hui, SONG Yu, et al. Effects of soaking and aeration treatment on gamma-aminobutyric acid accumulation in germinated soybean (Glycine max L.)[J]. European Food Research and Technology, 2011, 232(5): 787-795.
[10] YANG Runqiang, GUO Qianghui, GU Zhenxin. GABA shunt and polyamine degradation pathway on gamma-aminobutyric acid accumulation in germinating fava bean (Vicia faba L.) under hypoxia[J]. Food Chemistry, 2013, 136(1): 152-159.
[11] BAI Qingyun, CHAI Ming, GU Zhenxin, et al. Effects of components in culture medium on glutamate decarboxylase activity and gammaaminobutyric acid accumulation in foxtail millet (Setaria italica L.) during germination[J]. Food Chemistry, 2009, 116(1): 152-157.
[12] GUO Yuanxin, YANG Runqiang, CHEN Hui, et al. Accumulation of γ-aminobutyric acid in germinated soybean (Glycine max L.) in relation to glutamate decarboxylase and diamine oxidase activity induced by additives under hypoxia[J]. European Food Research and Technology, 2012, 234(4): 679-687.
[13] 国家标准化管理委员会. GB/T5520—2011粮油检验 籽粒发芽试验[S].北京: 中国标准出版社, 2011.
[14] 郑永华, 苏新国, 李欠盛, 等. 高氧对枇杷果实贮藏期间呼吸速率和多酚氧化酶活性及品质的影响(简报)[J]. 植物生理学通讯, 2000, 36(4): 318-320.
[15] 王学奎. 植物生理生化实验原理和技术[M]. 北京: 高等教育出版社, 2006.
[16] DAS A, UCHIMIYA H. Oxygen stress and adaptation of a semiaquatic plant: rice (Oryza sativa)[J]. Journal of Plant Research, 2002, 115(5): 315-320.
[17] SOUSA C A F D, SODEK L. The metabolic response of plants to oxygen deficiency[J]. Brazilian Journal of Plant Physiology, 2002, 14(2): 83-94.
[18] 曹晓虹, 温焕斌, 李翠娟, 等. 糙米发芽过程中蛋白酶活力及含氮物质的变化[J]. 南京农业大学学报, 2010, 33(2): 96-100.
[19] 杨润强, 陈惠, 顾振新. 低氧联合NaCl胁迫下蚕豆发芽富集γ-氨基丁酸培养条件优化[J]. 食品与发酵工业, 2012, 38(5): 77-80.
[20] 薛云皓, 仵红梅, 王爱月, 等. 玉米发芽前后的营养变化[J]. 河南医学研究, 2001, 3(1): 5-7.
[21] 黄国平. 粮食种子萌发过程中营养特性的变化[J]. 中国食物与营养, 2005, 12(3): 26-27.
[22] HELLAND M, WICKLUND T, NARVHUS J. Effect of germination time on alpha-amylase production and viscosity of maize porridge[J]. Food Research International, 2002, 35(2): 315-321.
[23] 姚森, 杨特武, 赵莉君, 等. 发芽糙米中γ-氨基丁酸含量的品种基因型差异分析[J]. 中国农业科学, 2008, 41(12): 3974-3982.
[24] 白青云. 低氧胁迫和盐胁迫下发芽粟谷γ-氨基丁酸富集机理及抗氧化性研究[D]. 南京: 南京农业大学, 2009.
[25] BOUCHE N, LACOMBE B, FROMM H. GABA signaling: a conserved and ubiquitous mechanism[J]. Trends in Cell Biology, 2003, 13(12): 607-610.
Changes in Physio-biochemical Indexes and γ-Aminobutyric Acid Content during Germination of Maize (Zea mays L.) under Hypoxia Stress
YIN Yong-qi1, WU Jin-xian1, LIU Chun-quan2, LI Da-jing2, YANG Run-qiang1, GU Zhen-xin1,*
(1. Key Laboratory of Agricultural and Animal Products Processing and Quality Control, Ministry of Agriculture, Nanjing Agricultural University, Nanjing 210095, China; 2. Institute of Farm Product Processing, Jiangsu Academy of Agricultural Sciences, Nanjing 210014, China)
The changes in physio-biochemical indexes and γ-aminobutyric acid (GABA) content during germination of five maize cultivars under hypoxia stress were investigated. Results showed the physiological and biochemical indexes of five maize cultivars significantly changed during 72 h germination under hypoxia. At the end of germination, the sprout length increased to 15.5-26.3 mm, the respiratory rate was improved by 1.7-3.2 folds, the dry matter was lost by 35.6%-40.6%, the starch content was consumed by 15.5%-28.9%, and the content of reducing sugar and free amino acids increased by 1.7-4.7 and 7.4-13.3 folds, respectively. GABA content in germinated maize increased by 9.3-13.2 folds when compared with the original maize. Furthermore, significant differences in GABA content and germination rate among different maize cultivars during germination were observed. Germination rate of cultivar ZHN was the highest (85.5%) with a maximum GABA content of 0.65 mg/g md. Hence, ZHN could be considered as a good source for GABA accumulation. GABA content in maize during germination under hypoxia revealed a significantly (P < 0.01) positive correlation with sprout length, respiration rate and free amino acid content, respectively. The nutritional quality of maize could be improved through germination under hypoxia stress.
maize; germination; hypoxia stress; γ-aminobutyric acid
TS210.1
A
1002-6630(2014)17-0104-05
10.7506/spkx1002-6630-201417021
2013-08-23
江苏高校优势学科建设工程资助项目;江苏省农业科技自主创新资金项目(CX(11)2067)
尹永祺(1988—),男,博士研究生,研究方向为食品中功能成分的富集技术。E-mail:2011208009@njau.edu.cn
*通信作者:顾振新(1956—),男,教授,博士,研究方向为生物技术与功能食品。E-mail:guzx@njau.edu.cn

