β-呋喃果糖苷酶在离子液体中的酶学特性研究
■马歌丽 韩甜甜 李全喜 魏 涛 毛多斌
(郑州轻工业学院食品与生物工程学院,河南郑州450001)
β-呋喃果糖苷酶(β-fructofuranosidase,EC3.2.1.26)是一种重要的工具酶,主要用于催化合成功能性低聚糖和糖苷类化合物。国内外有关β-呋喃果糖苷酶的催化反应研究多在水介质中进行。近年来,离子液体作为一种新型溶剂已成为酶催化反应的重要介质,不仅具有不易挥发、对环境友好、可设计等优点,而且其独特的结构还可以增加酶的稳定性[1-2]。离子液体是由有机阳离子和无机或有机阴离子构成的、在100℃以下呈液体状态的盐类。用于酶催化反应的离子液体通常由烷基取代的咪唑阳离子([R1R3IM]+)与非配位性的四氟硼酸根()、六氟磷酸根()、三氟甲磺酸根()等阴离子组成。在离子液体的酶催化反应研究中,文献报道较多的是脂肪酶、蛋白酶和氧化还原酶,而糖苷酶在离子液体中的催化反应报道很少[3-4],所以将β-呋喃果糖苷酶引入到离子液体介质中进行研究具有重要意义。
主要通过探索离子液体的种类和浓度、反应温度、pH值、底物浓度对酶活性的影响,研究了黑曲霉YA03产β-呋喃果糖苷酶在离子液体中的酶学特性,以期得到离子液体中β-呋喃果糖苷酶的最佳作用条件,了解酶在离子液体中的反应动力学参数,为离子液体中酶催化反应提供指导。
1 材料与方法
1.1 材料
1.1.1 菌种
黑曲霉YA03,郑州轻工业学院生物工程实验室诱变选育。
1.1.2 主要试剂
蔗糖,分析纯,广东省化学试剂工程技术研究开发中心;葡萄糖,分析纯,BioBasic公司;果糖,优级纯,Amresco公司;蔗果三糖(1-Kestose),色谱纯,日本和光纯药工业株式会社;乙腈,色谱纯,天津市四友精细化学品有限公司;[BMIM][PF6]和[BMIM][BF4],分析纯,上海成捷化学试剂公司。
1.1.3 仪器与设备
JY1001电子天平,上海浦春计量仪器有限公司;UV1000紫外可见分光光度计,上海天美科学仪器有限公司;HH-S4数显恒温水浴锅,金坛市医疗仪器厂;DHG-9145A电热恒温鼓风干燥箱,上海一恒科技有限公司;JY92-ⅡDN超声波细胞粉碎机,宁波新芝生物科技股份有限公司;GL-22M高速冷冻离心机,赛特湘仪离心机仪器有限公司;702型微量进样器,Hamil⁃ton公司;2424型蒸发光散射检测仪,美国Waters公司;1525型高效液相色谱仪,美国Waters公司。
1.2 试验方法
1.2.1 β-呋喃果糖苷酶的制备
黑曲霉YA03菌种经种子培养和发酵培养后,发酵液进行真空抽滤,收集菌体,用pH值5.0磷酸盐-柠檬酸缓冲液溶解,冰浴下超声波破碎,于4℃、10 000 r/min离心20 min,上清液即为胞内粗酶液。
向胞内粗酶液中缓慢加入硫酸铵至95%饱和度,边加边缓慢搅拌至硫酸铵完全溶解,在4℃冰箱中放置3 h,于4℃、8 000 r/min离心20 min,弃去上清液,得沉淀。沉淀物用pH值5.0的磷酸盐-柠檬酸缓冲液溶解,残留的不溶性物质通过离心除去,上清酶液于4℃下透析24 h,中间更换透析液两次,得粗酶液。
1.2.2 酶活测定——高效液相色谱法(HPLC)
1.2.2.1 离子液体中酶催化反应体系
取1 ml 60%蔗糖溶液(用pH值5.0磷酸盐-柠檬酸缓冲液配制),加至1 ml离子液体中,再加入酶液0.5 ml,于40℃恒温水浴反应24 h[5],沸水浴中10 min终止反应。
1.2.2.2 酶活定义
在上述反应条件下,每分钟生成1 μmol蔗果三糖所需要的酶量为一个酶活力单位(U),用U/ml表示。
1.2.2.3 酶活计算
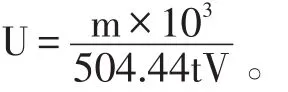
式中:m——蔗果三糖的量(mg);
504.44——蔗果三糖的摩尔质量(g/mol);
t——反应时间(min);
V——酶液体积(ml)。
1.2.2.4 蔗果三糖标准曲线的绘制
准确称取0.02 g蔗果三糖标准品,加水溶解并定容至10 ml,配制成2 mg/ml标准母液,再分别稀释成浓度为1、0.4、0.2、0.1 mg/ml的标准溶液,用HPLC进行检测分析,以蔗果三糖浓度为横坐标,色谱峰面积为纵坐标作图。
1.2.2.5 样品处理
酶反应后的样品液离心,除去蛋白沉淀,上清液用纯水适当稀释,再用0.45 μm微孔滤膜过滤,然后进行HPLC分析。
1.2.2.6 HPLC检测条件[6-7]
检测器为蒸发光散射检测仪,色谱柱为Amide柱(46 mm×250 mm,内经×长度),流动相为乙腈∶水=80∶20,流速1.0 ml/min,进样量10 μl,柱温35 ℃,管温70 ℃,分析时间40 min,对照为1.0 mg/ml的蔗果三糖、蔗糖、葡萄糖和果糖标准品。
1.2.3 离子液体种类对酶活的影响
选择疏水性离子液体[BMIM][PF6]和亲水性离子液体[BMIM][BF4]纯溶剂加入反应体系中[8-10],酶催化反应后通过HPLC测定反应产物蔗果三糖的量,考察离子液体种类对β-呋喃果糖苷酶催化活性的影响。
1.2.4 离子液体浓度对酶活的影响
选择1.2.3得到的最佳离子液体,用缓冲液配制成浓度为25%、50%、75%、100%(V/V)的离子液体溶液,加入反应体系中,酶催化反应后通过HPLC测定反应产物蔗果三糖的量,考察离子液体浓度对β-呋喃果糖苷酶催化活性的影响。
1.2.5 离子液体中酶学特性研究
1.2.5.1 温度对酶活的影响
将反应体系分别置于 35、40、45、50、55 ℃和60℃水浴中进行反应,反应结束后取样进行HPLC分析,确定酶的最适反应温度。
1.2.5.2 酶的热稳定性研究
将酶液分别置于30、40、50、60、70、80 ℃水浴中5 h,分别取上述酶液加入反应体系中,进行反应,反应结束后取样进行HPLC分析,确定酶的热稳定性。
1.2.5.3 pH值对酶活的影响
分别用pH值4.0、4.6、5.2、5.8、6.4、7.0的磷酸盐-柠檬酸缓冲液配制60%的蔗糖溶液,添加到离子液体反应体系中,再加入酶液进行反应,反应结束后取样进行HPLC分析,确定酶的最适pH值。
1.2.5.4 酶的pH值稳定性研究
分别用pH值3~8的磷酸盐-柠檬酸缓冲液溶解经硫酸铵沉淀后的酶,室温保持5 h,分别取上述酶液加入反应体系中,反应结束后取样进行HPLC分析,确定酶的pH值稳定性。
1.2.5.5 底物对酶活性的影响
分别配制15%、30%、45%和60%浓度的蔗糖溶液,添加到离子液体中,再加入酶液,反应24 h后取样进行HPLC分析,确定最佳底物浓度。
1.2.5.6 水相和离子液体中酶动力学参数的测定
用pH值5.2的磷酸盐-柠檬酸缓冲液配制不同浓度(0.4、0.6、0.8、1.0、2.0 mol/l)的蔗糖溶液,各取1 ml,加入0.5 ml酶液,再加入1 ml缓冲液。于40℃恒温水浴反应2 h,置沸水浴中10 min,终止反应,取样进行HPLC分析。
用pH值5.2的磷酸盐-柠檬酸缓冲液配制不同浓度(0.4、0.6、0.8、1.0、2.0 mol/l)的蔗糖溶液,各取1 ml,加入0.5 ml酶液,再加入1 ml 50%离子液体[BMIM][PF6]。于40℃恒温水浴反应2 h后,置沸水浴中10 min,终止反应,取样进行HPLC分析。
反应初速度(V)定义为单位时间内,反应体系中的蔗果三糖浓度的增加量,计算公式如下。

式中:M——反应时刻蔗果三糖的浓度(mmol/l);
M0——反应初使时刻蔗果三糖的浓度(mmol/l,M0=0);
t——反应时间(min)。
2 结果与讨论
2.1 蔗果三糖标准曲线
以蔗果三糖浓度为横坐标,色谱峰面积为纵坐标,绘制标准曲线如图1所示。

图1 蔗果三糖标准曲线
2.2 标准品HPLC图谱
将终浓度为1.0 mg/ml的混合标准糖液进行HPLC分析,结果如图2所示。

图2 混合标准糖液的HPLC图谱
2.3 离子液体种类对酶活的影响
将60%蔗糖底物和酶液分别加入疏水性离子液体[BMIM][PF6]和亲水性离子液体[BMIM][BF4]中,在相同条件下进行酶反应,以水相为对照,HPLC分析结果如图3~图5可知。
分别对图3~图5中的蔗果三糖峰面积进行积分,得到不同反应体系中酶催化反应产物蔗果三糖的量,由外标法计算得到β-呋喃果糖苷酶在水相、[BMIM][PF6]和[BMIM][BF4]中的酶活力分别为0.155 7、0.294 8 U/ml和0.083 8 U/ml。由此可见,在相同的反应条件下,β-呋喃果糖苷酶在疏水性离子液体[BMIM][PF6]中的催化活性比水相中提高了89.3%,而在亲水性离子液体[BMIM][BF4]中的催化活性比水相中降低了46.2%。分析原因可能是反应体系的极性影响酶的活性。由于离子液体[BMIM][BF4]的极性大于[BMIM][PF6],在极性较高的环境中,酶分子的构象变化较大从而导致酶催化位点的部分失活。另外,离子液体的亲水性会导致维持酶结构与功能的水分子被离子液体剥夺,对酶活性产生一定影响。由于离子液体[BMIM][BF4]的亲水性大于[BMIM][PF6]的亲水性,使酶在[BMIM][BF4]中的部分活性丧失[11-12]。因此选择疏水性离子液体[BMIM][PF6]为反应介质。

图3 水相中酶催化反应产物的HPLC图谱

图4 离子液体[BMIM][PF6]中酶催化反应产物的HPLC图谱

图5 离子液体[BMIM][BF4]中酶催化反应产物的HPLC图谱
2.4 离子液体浓度对酶活的影响
分别在25%、50%、75%、100%(V/V)的疏水性离子液体[BMIM][PF6]中进行酶催化反应,对产物进行HPLC分析,离子液体浓度对酶活的影响结果如图6所示。
由图6可知,随着疏水性离子液体[BMIM][PF6]浓度的增大,酶活呈先增大后减小的趋势。当疏水性离子液体[BMIM][PF6]浓度为50%时,β-呋喃果糖苷酶的转移活性最大。原因可能是适当浓度的离子液体能促进底物和酶的结合,使酶活增大;但离子液体浓度过大,反应体系的黏度增大和离子强度较高,增大了传质阻力,影响底物和酶分子的结合,从而使酶活降低[13]。因此选择50%疏水性离子液体[BMIM][PF6]作为后续反应的最佳浓度。
2.5 温度对酶活的影响
将60%蔗糖与酶液加入50%疏水性离子液体[BMIM][PF6]中,分别于35、40、45、50、55、60 ℃水浴中反应24 h,测定酶活,温度对酶活的影响结果如图7所示。
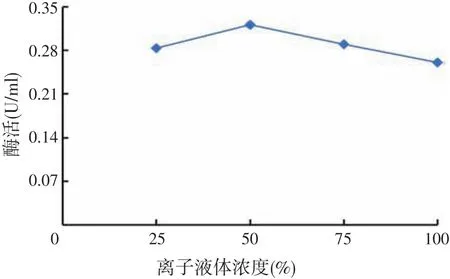
图6 离子液体浓度对酶活性的影响

图7 β-呋喃果糖苷酶的最适温度
温度不仅影响酶的活性,还会影响离子液体的黏度。温度升高,离子液体的黏度降低,使酶和底物在反应介质中分散更均匀;但温度过高,酶的活性构象遭到破坏,导致酶活降低甚至丧失[14]。由图7可知,在小于40℃范围内,β-呋喃果糖苷酶的活性随着反应温度的升高而增大;在40~60℃范围内,酶活随着温度的升高而降低。由此确定,β-呋喃果糖苷酶的最适温度为40℃。
2.6 酶的热稳定性研究
将酶液分别置于30、40、50、60、70、80 ℃水浴中保温5 h,分别取上述酶液和60%蔗糖加入疏水性离子液体[BMIM][PF6]中进行反应,反应结束后测定剩余酶活,结果如图8所示。
由图8可知,β-呋喃果糖苷酶在30~50℃范围内是稳定的,保温5 h后残余酶活达80%以上;温度大于50℃时,酶活力急剧下降;当温度达到80℃时,酶活几乎全部丧失。
2.7 pH值对酶活的影响
分别将不同pH值(4.0、4.6、5.2、5.8、6.4、7.0)缓冲液配制的60%蔗糖溶液和酶液加入疏水性离子液体[BMIM][PF6]中催化反应24 h,测定酶活,pH值对酶活的影响结果如图9所示。

图8 β-呋喃果糖苷酶的热稳定性

图9 β-呋喃果糖苷酶的最适pH值
pH值不仅会影响酶的活性,还会影响底物与酶复合物的解离状态,从而影响酶与底物的结合;过酸或过碱的环境还可使酶变性失活。由图9可知,β-呋喃果糖苷酶的最适pH值为5.2,小于或大于此pH值β-呋喃果糖苷酶的转移活性均降低。
2.8 酶的pH值稳定性
将酶在不同pH值缓冲液中放置5 h,分别取上述酶液和60%蔗糖加入疏水性离子液体[BMIM][PF6]中反应24 h,测定剩余酶活,结果如图10所示。
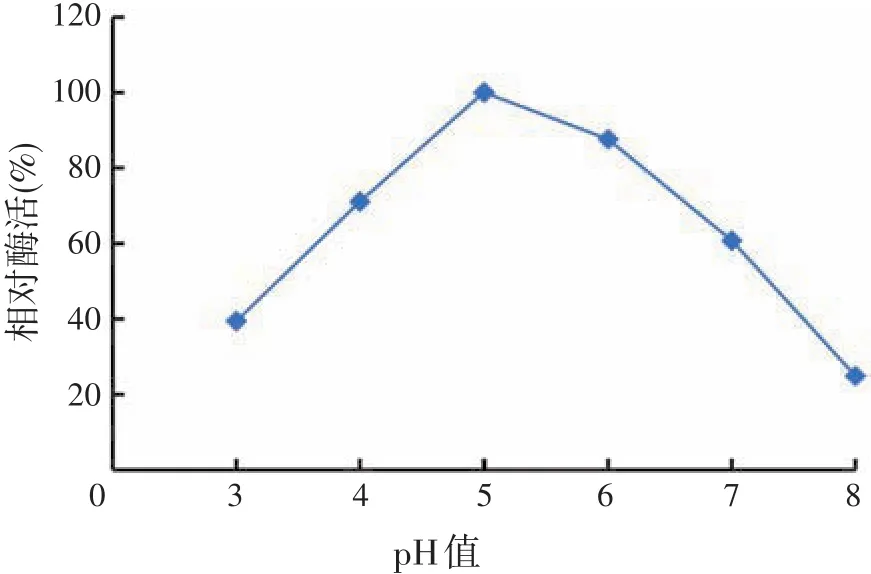
图10 β-呋喃果糖苷酶的pH值稳定性
由图10可知,在pH值4.5~6.5范围内,β-呋喃果糖苷酶具有较好的稳定性,酶活力保持在80%以上;pH值达到8.0时,酶活力损失最多。
2.9 底物浓度对酶活的影响
分别将不同浓度(15%、30%、45%、60%)的蔗糖溶液与酶液加入疏水性离子液体[BMIM][PF6]中,反应24 h后测定酶活力,结果如图11所示。

图11 底物浓度对酶活性的影响
由图11可以看到,蔗糖浓度在15%~60%范围内,β-呋喃果糖苷酶的转移活性随着蔗糖浓度的增大而升高,说明增大底物浓度,有利于反应的进行和产物的合成。由于蔗糖溶解度的原因,蔗糖浓度不再增大。由此确定,β-呋喃果糖苷酶的最适底物浓度为60%。
2.10 酶动力学参数的测定
为进一步了解离子液体对β-呋喃果糖苷酶催化蔗糖反应生成蔗果三糖的影响,比较研究了水相和离子液体中酶反应的动力学参数[13]。
米氏方程两侧取倒数,得到下面方程式:

以底物浓度的倒数l/[S]为横坐标,反应初速度的倒数1/V为纵坐标作图,结果如图12所示。
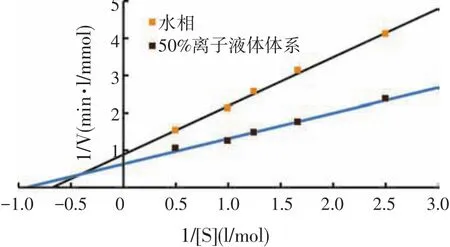
图12 β-呋喃果糖苷酶的Lineweaver-Burk图
由图12可知,l/[S]对1/V进行线性拟合,计算得到水相中动力学参数Km和Vmax值分别为1.475 mol/l和1.131 mmol/(min·l),50%疏水性离子液体[BMIM][PF6]中动力学参数Km和Vmax值分别为1.081 mol/l和1.585 mmol/(min·l)。根据酶反应理论,米氏常数Km为酶促反应的特征常数,反映了酶与底物的亲和能力,Km值大,表示酶与底物的亲和力小,反之则大[15]。由上面结果可知,在50%疏水性离子液体[BMIM][PF6]中酶的Km值比水相中的小,说明疏水性离子液体[BMIM][PF6]的存在增强了β-呋喃果糖苷酶和底物的亲和能力,从而使β-呋喃果糖苷酶在疏水性离子液体[BMIM][PF6]中的活性增加。最大反应速度Vmax则表示酶催化反应能力的大小,Vmax大,反应能力越强。由上面的结果可知,50%疏水性离子液体[BMIM][PF6]中的Vmax值比水相中的大,说明50%离子液体[BMIM][PF6]的反应体系比水相体系更有利于提高β-呋喃果糖苷酶的转移活性。
3 结论
①与水相对比,β-呋喃果糖苷酶在疏水性离子液体[BMIM][PF6]中的酶催化活性提高了89.3%,而在亲水性离子液体[BMIM][BF4]中的酶催化活性降低了46.2%,且50%疏水性离子液体[BMIM][PF6]是β-呋喃果糖苷酶催化蔗糖合成蔗果三糖的最佳反应介质。
②在50%疏水性离子液体[BMIM][PF6]中,β-呋喃果糖苷酶的最适蔗糖浓度为60%,最适温度为40℃,最适pH值为5.2,酶在30~50℃及pH值4.5~6.5范围内有较好的稳定性。
③疏水性离子液体[BMIM][PF6]的存在增强了β-呋喃果糖苷酶和底物的亲和能力,更有利于提高β-呋喃果糖苷酶的转移活性。

