曲马多对大鼠创伤骨折及脆性骨折愈合的影响
王一寒,张 超,董宇启,张天浩,董英海
(上海交通大学医学院附属仁济医院,上海200127)
临床上,中老年患者因骨质疏松导致脆性骨折 时,常因伴有心脑血管等疾病不能耐受手术而不得不采取保守治疗,需要服用镇痛药物缓解骨折疼痛以提高生活质量。有研究者认为部分骨折术后规范服用镇痛药物可以提高功能愈后[1]。目前,非甾体类镇痛药物延缓骨折愈合已得到了文献的验证[2]。但中枢性镇痛药物对骨折愈合的影响,尤其是对因骨质疏松导致的脆性骨折愈合有何影响尚缺乏足够的论证。本文以盐酸曲马多为研究对象,从组织学和生物力学的角度观察其对骨折愈合的影响。
1 材料与方法
1.1 材料 8个月龄雌性SD大鼠120只(上海斯莱克实验动物有限责任公司提供,合格证号SCXK(沪)2003-0003),体质量300~320 g,自由进食颗粒饲料,室温控制在19~22℃,12 h间隔照明,定期消毒和通风。盐酸曲马多购买于北京萌蒂制药有限公司,双氯芬酸钠购买于宁波斯迈克制药有限公司。多功能全自动荧光显微镜(AxioplanⅡ型)、AxioCam数码相机(分辨率1 200万像素,3 900×3 090)、KS400 图像分析系统(Kontron System,Ver 3.0)为德国Zeiss公司产品,万能材料力学实验机(Autograph,SLBL-1kN型)为日本Shimadzu公司产品。
1.2 方法 大鼠120只随机分为创伤骨折模型组、脆性骨折模型组各60只。创伤骨折模型组再分为A、B、C 3个亚组,脆性骨折模型组再分为Ⅰ、Ⅱ、Ⅲ3个亚组,每组20只,分别采用曲马多、双氯芬酸钠、生理盐水干预。
1.2.1 建立骨质疏松及创伤骨折模型 ①骨质疏松模型:水合氯醛3 mL/kg腹腔麻醉,备皮后行腹腔正中纵行切口,长约3 cm。逐层切开暴露腹腔内脏器,用无菌棉签分别向两侧寻找子宫末端,完全切除附着于子宫末端的双侧卵巢组织,彻底止血,回纳腹腔脏器后逐层关闭切口。术后均青霉素80万U肌注,2次/d,连续使用3 d。术后自由活动和进食3个月。②创伤骨折模型:水合氯醛3 mL/kg腹腔麻醉,双侧股骨中段分别行纵行切口,切开皮肤、皮下组织及深筋膜。在肌间隙中分离暴露股骨,于股骨中点切开骨膜,横行锯断股骨,随即用直径1.2 mm克氏针髓内固定,依次关闭切口。骨质疏松造模后3个月和创伤骨折模型组同时进行骨折造模,然后灌胃给药,1次/d,给药时间为术后当天至处死前1 d。药物用量为:盐酸曲马多混悬液20 mg/(kg·d)、双氯芬酸钠混悬液5 mg/(kg·d)、生理盐水10 mL/(kg·d)。
1.2.3 组织学观察 术后第2、3、4、6周,从每组大鼠中随机选取3只,处死后截取双侧股骨,剔除肌肉及周围组织,将股骨中段及骨痂组织置于10%中性甲醛溶液固定(4℃)48 h,100 g/L的EDTA-2Na(pH=7.2,4℃)脱钙3~4周,7 d更换1次脱钙液。脱钙满意后,纵向石蜡包埋,5 μm切片,HE染色。多功能全自动荧光显微镜观察,AxioCam数码相机拍照,KS400图像分析系统进行图像分析,计算单位面积内新生骨小梁面积的比值(即新生骨小梁密度)。
1.2.4 生物力学检测 术后第6周,拔出双侧股骨克氏针,用生理盐水浸湿的纱布包裹股骨,置于-20℃冰箱保存备用。标本收齐后常温下解冻,在万能材料力学实验机上用三点弯曲法检测股骨骨折处最大载负荷。
1.2.5 统计学方法 采用SPSS10.0软件进行统计分析,数据以±s表示,组间比较用单因素方差分析。P≤0.05为差异有统计学意义。
2 结果
2.1 组织学观察结果 ①创伤骨折模型:A、C组术后第2周骨痂生长旺盛,以软骨痂为主,新生骨小梁较多;第3、4周纤维骨痂向软骨痂转换的速度较快,骨小梁开始出现并逐渐增多,成骨细胞逐渐向骨细胞转化;第6周骨痂开始塑形改造。B组术后第2周在骨折断端间仍有较多的死骨及碎片,新生组织以纤维骨痂为主,骨小梁较少。与A、C组比较,B组第3、4、6周,纤维骨痂向软骨痂转换的速度较慢,新生骨小梁较少且较细,小梁间不连续,间距增宽;同时骨折后各时期骨小梁面积变化不明显,软骨细胞多,成骨细胞少且体积小。②脆性骨折模型:相比于创伤骨折模型,各组骨小梁密度显著降低;Ⅰ、Ⅱ、Ⅲ组组织学表现与创伤骨折模型A、B、C组相同。
2.2 骨小梁密度检测结果 创伤骨折模型不同时间点各组骨小梁密度见表1,脆性骨折模型不同时间点各组骨小梁密度见表2。
表1 创伤骨折模型不同时间点各组骨小梁密度(%,±s)
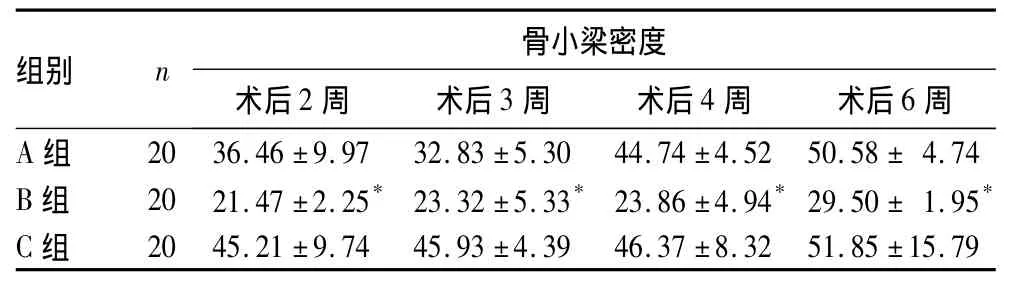
表1 创伤骨折模型不同时间点各组骨小梁密度(%,±s)
注:与 A 组比较,*P <0.05
组别 n 骨小梁密度术后2周 术后3周 术后4周 术后6周A 组 20 36.46 ±9.97 32.83 ±5.30 44.74 ±4.52 50.58 ± 4.74 B 组 20 21.47 ±2.25* 23.32 ±5.33* 23.86 ±4.94*29.50 ± 1.95*C 组 20 45.21 ±9.74 45.93 ±4.39 46.37 ±8.32 51.85 ±15.79
表2 脆性骨折模型不同时间点各组骨小梁密度(%,±s)
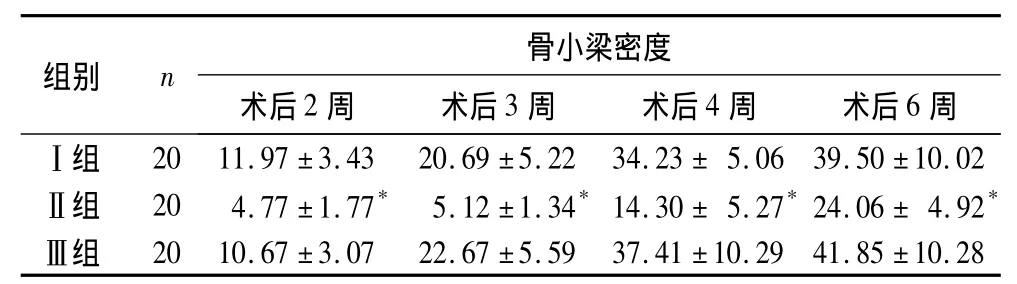
表2 脆性骨折模型不同时间点各组骨小梁密度(%,±s)
注:与 I组比较,*P <0.05
组别 n 骨小梁密度术后2周 术后3周 术后4周 术后6周Ⅰ组 20 11.97 ±3.43 20.69 ±5.22 34.23 ± 5.06 39.50 ±10.02Ⅱ组 20 4.77 ±1.77* 5.12 ±1.34*14.30 ± 5.27*24.06 ± 4.92*Ⅲ组 20 10.67 ±3.07 22.67 ±5.59 37.41 ±10.29 41.85 ±10.28
2.3 生物力学观察结果 ①创伤骨折模型:术后6周,A、B、C 组生物力学强度值分别为(32.14±18.32)、(10.91 ±4.56)、(39.13 ±19.35)N;与 A、C组比较,B组生物力学强度明显降低(P<0.05),A、C组生物力学强度比较无统计学差异(P>0.05)。②脆性骨折模型:术后6周,Ⅰ、Ⅱ、Ⅲ组生物力学强度值分别为(25.05 ±8.75)、(9.36 ±2.62)、(27.84 ±18.96)N,各组相对于骨折模型生物力学强度均有所降低(P均<0.05);与Ⅰ、Ⅲ组比较,Ⅱ组生物力学强度明显降低(P<0.05),Ⅰ、Ⅲ组生物力学强度比较无统计学差异(P>0.05)。
3 讨论
骨质疏松症是一种以骨量降低和骨组织微结构破坏为特征,导致骨脆性增加和易于骨折的代谢性骨病,其严重后果是导致脆性骨折。有研究资料表明,国人每14人中有1人患不同程度的骨质疏松症[3],尤其是绝经后妇女发病率更高。雌性大鼠切除卵巢后,骨组织转换加快,骨量减少,骨强度下降.这种特点类似于人正常绝经后的骨丢失状态[4],是常用制作骨质疏松模型的方法,但这种模型也有其局限性。首先,大鼠虽有着和人类相似骨代谢过程,但存在缺乏哈佛系统、没有哈佛重建、骨骺闭合迟、骨重建周期较人类短暂等不同。其次,去势模型可致卵巢间质细胞分泌缺失、负氮平衡、产生应激反应等,这些因素可能对检测结果产生干扰[5]。此外,中老年患者另一个常见骨关节病是骨关节炎,其往往需要长期服用镇痛药物。美国风湿病协会提示,选择性环氧化酚-2抑制剂是治疗骨关节炎的一线镇痛药物,曲马多是75岁以上患者的二线镇痛药物[6]。
本文组织学观察结果显示,双氯芬酸钠会影响创伤骨折及脆性骨折的愈合,表现为软骨痂期的延长,成骨活动减少;而盐酸曲马多不影响两种模型骨折端血肿机化和骨痂的形成改造。生物力学测试从宏观角度评价骨折愈合的过程和强度,是检测骨折愈合的金标准。显示双氯芬酸钠降低了骨折愈合强度,延缓了骨折的愈合过程,而盐酸曲马多不存在类似的不良结果,表明创伤后和术后服用曲马多镇痛较安全。阿片类存在较多的不良反应,如成瘾性,呼吸抑制,可出现恶心、呕吐、便秘、瘙痒,胃排空延迟、性功能障碍、睡眠障碍、镇静等[7],但不同的阿片类药物伴随的风险不尽相同[8]。盐酸曲马多是一种弱阿片类药物,镇痛效果约为吗啡的1/6,能满足大部分临床止痛的需要;其优点是相对于传统阿片类药物,有着较低的成瘾性[9],常规剂量下不会产生呼吸抑制作用、便秘、尿潴留等,相对于其他阿片类药物其引起骨折风险小,因而是一种较安全的阿片类药物。
本研究选择双氯芬酸钠作为阳性对照,因为有足够的动物实验证明非甾体类镇痛药对骨折以及骨质疏松引起的脆性骨折的愈合产生不利影响[10],其机制是通过抑制环氧化酶的活性从而阻碍前列腺素的合成[11],但这一影响在临床实验中缺乏足够的证据[12]。本文的不足之处在于仅从动物实验角度比较了曲马多和双氯芬酸钠对创伤骨折及脆性骨折愈合的影响,未进行临床实验的比较和验证;两种骨折模型均是手术切开骨折造模,并未很好地模拟临床创伤骨折和脆性骨折的发生机制;而且本实验采用克氏针髓内固定,并未讨论保守治疗及钢板固定等其他固定方式。因此,中老年患者脆性骨折合并骨关节炎时,其长期服用的镇痛药物对脆性骨折愈合有何影响,需要进一步讨论。
[1]Chin RP,Ho CH,Cheung LP.Scheduled analgesic regimen improves rehabilitation after hip fracture surgery[J].Clin Orthop Relat Res,2013,471(7):2349-2360.
[2]Brown KM,Saunders MM,Kirsch T,et al.Effect of COX-2-specific inhibition on fracture-healing in the rat femur[J].J Bone Joint Surg Am,2004,86-A(1):116-123.
[3]赵伟业,董碧蓉,欧雪,等.骨质疏松药物治疗的新进展及循证证据[J].中国骨质疏松杂志,2003,9(1):80-82.
[4]Chachra D,Lee JM,Kasra M,et al.Differential effects of ovariectomy on the mechanical properties of cortical and cancellous bones in rat femora and vertebrae[J].Biomed Sci lnstrum,2000,36:123-128.
[5]李素萍.骨质疏松动物模型的研究现状[J].中国组织工程研究与临床康复,2011,15(20):3767-3770.
[6]McCarberg B,Tenzer P.Complexities in the pharmacologic management of osteoarthritis pain[J].Curr Med Res Opin,2013,29(5):539-548.
[7]Kurmis AP,Kurmis TP,O'Brien JX,et al.The effect of nonsteroidal anti-inflammatory drug administration on acute phase fracture-healing:a review[J].J Bone Joint Surg Am,2012,94(9):815-823.
[8]Lee TK,Stupans I.Radioprotection:the non-steroidal anti-inflammatory drugs(NSAIDs)and prostaglandins[J].J Pharm Pharmacol,2002,54(11):1435-1445.
[9]Geusens P,Emans PJ,de Jong JJ,et al.NSAIDs and fracture healing[J].Curr Opin Rheumatol,2013,25(4):524-531.
[10]Bouloux GF.Use of opioids in long-termmanagement of temporomandibularjoint dysfunction[J].J Oral Maxillofac Surg,2011,69(7):1885-1891.
[11]Solomon DH,Rassen JA,Glynn RJ,et al.The comparative safety of opioids for nonmalignant pain in older adults[J].Arch Intern Med,2010,170(22):1979-1986
[12]Altman RD.Practical considerations for the pharmacologic management of osteoarthritis[J].Am J Manag Care,2009,15(8 Suppl):S236-S243.

