吲哚-2,3-二酮对小鼠骨髓细胞微核和染色体的影响
孙慧莉,武建凤
(滨州医学院附属医院,山东滨州256602)
吲哚-2,3-二酮(ISA)又名靛红,系天然存在的吲哚类化合物,存在于人体和中药青黛以及大青叶中,是目前国内自行研制开发的Ⅰ类抗癌新药靛玉红化学二聚体结构的单体。该物质也存在于龙虾体内,是龙虾生存所必需的一种天然海洋活性物质[1]。研究表明,ISA有促进人和小鼠神经母瘤细胞凋亡的作用[2]。2012~2013年,我们观察了ISA对小鼠骨髓细胞微核和染色体的影响及其安全性。现报告如下。
1 材料与方法
1.1 材料 昆明种小鼠(二级)100只,雌雄各半,体质量18~22 g,由河北医科大学实验动物中心提供。ISA(上海宜博生物医药科技有限公司),秋水仙素(PH0025,Sigma),甲醇、冰醋酸、KCl溶液均为分析纯,小牛血清,Giemsa储备液,pH6.8的磷酸盐缓冲液。
1.2 方法
1.2.1 骨髓细胞微核染毒试验 随机取50只小鼠,均分为5组,分别为阳性对照组、阴性对照组及ISA低、中、高剂量组。阳性对照组给予环磷酰胺0.2 mg/(10 g·d),阴性对照组给予1 mL/d生理盐水[3];ISA 低、中、高剂量组分别给予 ISA 0.2、0.6、1.8 mg/(10 g·d)腹腔注射,连续4 d,于最后1次注射后24、48、72 h 取样。
1.2.2 骨髓细胞微核标本制备及分析 采用颈椎脱臼法处死小鼠,迅速剪取胸骨,剔去肌肉,用干净纱布擦拭,剪去每节骨骺端,用止血钳挤出骨髓液,点在载玻片一端预先滴好的小牛血清中,混匀后推片。甲醇固定15 min,Giemsa染色15 min,冲洗、晾干。依次经低倍镜、高倍镜粗检后,选择细胞分布均匀、形态完整、染色良好的区域镜检,然后在油镜下按一定顺序计数微核,计数1 000个嗜多染红细胞(PCE)中含微核的PCE数,并计算200个细胞中PCE/正染红细胞(NCE)值。
1.2.3 骨髓染色体畸变试验染毒模型和染色体标本的制备 取剩余的50只小鼠,按1.2.1的方法分组并给药。于实验第4天给药6 h后,腹腔注射秋水仙素0.02 mg/10 g,2.5 h后用颈椎脱臼法处死,取出完整股骨并擦净,7 mL生理盐水冲洗股骨髓液于离心管中,反复数次至骨髓发白,离心弃上清,加入37℃的0.075 mol/L KCl溶液6 mL混合均匀,置37℃恒温水浴15 min,再加固定液1.5 mL摇匀,离心弃上清,加入新配制固定液5 mL混合,室温下静置15 min,离心弃上清。以同样方法重复固定一次。留约0.5 mL沉淀物,加0.2 mL新固定液混匀,得到细胞悬浮液。取少量细胞悬液滴于玻片上,轻轻吹散并干燥,滴加Giemsa染液染色15 min,纯净水冲洗,晾干。在低倍镜下按一定顺序选择背景清晰、分散良好、染色收缩适中的中期分裂相细胞,用油镜进行分析,每个标本观察80个,分析其染色体结构,确定畸变数目,计算畸变率。
1.2.4 统计学方法 采用 SPSS11.5统计软件,结果以±s表示,数据的比较采用方差分析。P≤0.05为差异有统计学意义。
2 结果
2.1 各组不同时间微核形成率比较 不同剂量ISA组的微核形成率与阴性对照组比较均无统计学差异(P均>0.05),与阳性对照组比较均有统计学差异(P均<0.01)。见表1。
表1 各组微核形成率比较(n=80,±s)
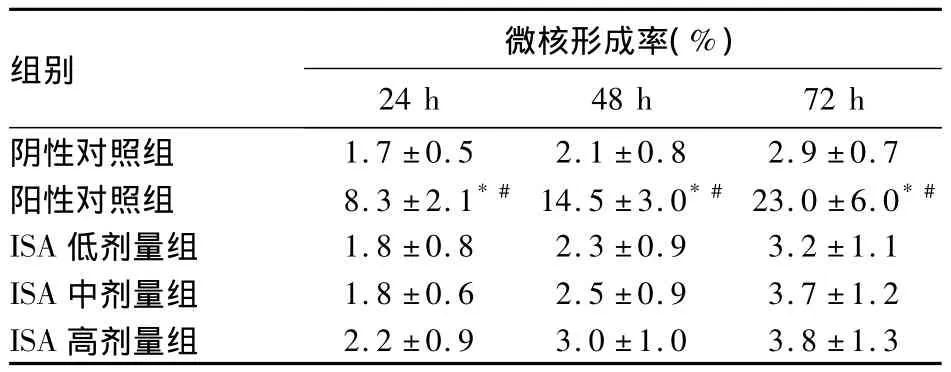
表1 各组微核形成率比较(n=80,±s)
注:与阴性对照组比较,*P<0.01;与ISA不同剂量组比较,#P<0.01
组别 微核形成率(%)24 h 48 h 72 h阴性对照组1.7 ±0.5 2.1 ±0.8 2.9 ±0.7阳性对照组 8.3 ±2.1*# 14.5 ±3.0*# 23.0 ±6.0*#ISA 低剂量组 1.8 ±0.8 2.3 ±0.9 3.2 ±1.1 ISA 中剂量组 1.8 ±0.6 2.5 ±0.9 3.7 ±1.2 ISA高剂量组2.2 ±0.9 3.0 ±1.0 3.8 ±1.3
2.2 各组PCE/NCE值及染色体畸变情况比较ISA低、中、高剂量组的PCE/NCE值分别为0.41±0.9、0.38 ±0.8、0.32 ±1.0,阴性对照组为 0.49 ±1.7,阳性对照组为 0.08 ±0.01,ISA 不同剂量组与阴性对照组比较均无统计学差异(P均>0.05),与阳性对照组比较均有统计学差异(P均<0.01)。油镜下观察显示,环磷酰胺能诱发小鼠染色体畸变,表现为断裂和易位,而阴性对照组和ISA组则少有畸变。各组细胞染色体畸变细胞数及畸变率比较见表2。
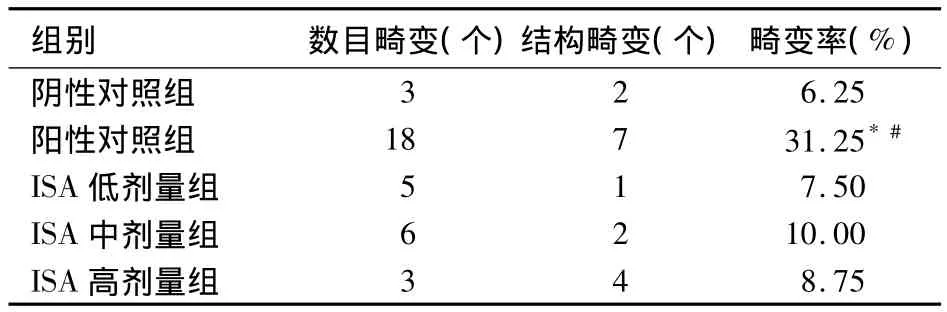
表2 各组细胞染色体畸变情况(n=80)
3 讨论
微核试验是测定细胞遗传损伤的短期试验之一[4]。一切进行分裂的细胞,在染色体断裂剂或能影响纺锤体的毒物作用下均可产生微核,故利用微核试验可对药物导致的染色体损伤进行测定。微核可出现在多种细胞中,且在有核细胞中较难与正常核的分支相区别,由于红细胞在成熟前最后一次分离后数小时可将主核排出,而仍保留微核于PCE细胞中,因此,计数PCE细胞中的微核数便能检测因化学毒物或物理因素诱导产生的染色体完整性改变以及检测染色体分离改变这两种遗传学终点[5]。
红细胞的细胞增殖动力学显示,其排核成为PCE后,通常在骨髓中停留约2~24 h后入血[6]。由于染毒次数及取样时间不同,化学毒物诱发微核出现的高峰时间也不尽相同,波动范围为24~72 h,所以要求在接触化学毒物后设立不同的采样时间点。本次微核试验于不同时间段取样3次,结果显示各组微核形成率均表现为:72 h>48 h>24 h,这与微核形成时相变化过程相符。而环磷酰胺组的微核形成率明显高于阴性对照组和ISA各剂量组,表明其较强的遗传毒性作用。ISA高、中、低剂量组的微核率与阴性对照组无统计学差异,同时PCE/NCE值均在正常范围内,提示ISA无毒性。
基因突变和染色体畸变的检测直接反映了化学毒物的致突变性,是评价化学毒物致突变性唯一可靠的方法[7]。当染色体发生畸变时,会导致基因在位置及数量上发生改变,基因间的平衡性即被打乱[8]。本研究在进行微核试验的同时,也进行了染色体核型分析,旨在比较两种试验结果的一致性。结果显示,环磷酰胺能诱发小鼠染色体畸变,表现为断裂和易位现象,而阴性对照组和ISA组少有畸变,说明环磷酰胺有致染色体损伤的遗传效应。环磷酰胺组畸变率与其他各组比较均有统计学差异,而ISA各剂量组与阴性对照组比较无统计学差异。
ISA对小鼠骨髓细胞微核和染色体的影响少见报道。本研究结果显示,ISA无遗传诱导毒性,为临床安全用药提供了参考。
[1]鞠传霞,侯琳,孙福生,等.2,3-吲哚醌抑制人神经母瘤细胞增殖及诱导其凋亡作用的研究[J].山东医药,2006,46(32):20-21.
[2]宋金莲,岳旺,侯琳,等.2,3-吲哚醌诱导人神经母细胞瘤SHSY5Y细胞凋亡及周期阻滞癌症[J].癌症,2008,27(3):283-288.
[3]马艳,董碧蓉.中药诱导小鼠防御素表达[J].四川医学,2009,30(8):1208-1209.
[4]张铁莉,贾俊芳,卢文卜.3-吲哚羧酸的性质对其印迹聚合物印迹效率的影响[J].分析化学研究报,2010,4(38):593-597.
[5]袁芳,刘映红,符晓,等.吲哚胺吡咯2,3-双加氧酶与肾细胞癌预后的预测[J].中南大学学报,2012,37(7):649-655.
[6]曹佳,林真,余争平.微核试验原理、方法及其在人群监测和毒性评价中的应用[M].北京:军事医学出版社,2000:15-60.
[7]Yue W,Li F Q,Abe Y,et al.Isatin,an endogenous MAO-B inhibitor,antagonizes the neurotoxis action of MPTP on central dopamnergic system in C57BL/6J mice[J].Chin J Neuro Sci,2002,18(4):690-693.
[8]贾庆军,郭魁亮,刘天鹏,等.环磷酞胺对小鼠遗传和生殖毒性影响的研究(1)——对骨髓细胞微核和染色体的影响[J].白求恩军医学院学报,2006,4(3):6-7.

