培养基成分对仁用杏花粉离体萌发的影响
金亚征,忻龙祚,王建民,俞凤芳
(河北北方学院 园艺系,河北 张家口 075000)
仁用杏是以杏仁为主要产品的杏属果树的总称。杏仁包括甜杏仁和苦杏仁2种,蛋白质、粗脂肪、矿物质、不饱和脂肪酸等含量高,此外,杏仁中还含有胡萝卜素、核黄素、抗坏血酸等药用成分,具有较高的食用价值和药用价值[1]。主要分布在河北、辽宁、甘肃、内蒙、山西、山西、新疆等地,是我国的优势经济树种。我国是唯一生产和出口杏仁的国家,全球对仁用杏的需求量越来越多,市场前景十分广阔[2]。但目前仁用杏生产存在产量低、产量不稳、出仁率低、品质差等问题,供需矛盾突出[3]。造成仁用杏坐果率低的主要原因是冻花冻果[4-6]、花器官败育[6-9]、开花特性[10]、管理粗放[11]等。文中以仁用杏‘优一’为材料,探寻仁用杏花粉萌发适宜培养基的成分及浓度,以期为提高仁用杏坐果率、降低花粉败育提供理论依据。
1 材料与方法
1.1 试验材料
材料为仁用杏‘优一’品种。于大蕾期选择10株长势均匀的树体,在树体不同部位随机采集含苞待放的花朵数朵,组成混合样,带回室内。用镊子拨开花瓣,取下花药,放到硫酸纸上,在室内自然阴干,待花药炸裂时收集花粉,将花粉过筛去除杂质,收集到指形离心管中,装入黑色塑料袋中保存到温度为-25℃的冰箱中备用。
1.2 试验方法
1.2.1 试验方案
(1)单因素试验 单因素试验均采用固体琼脂培养基(琼脂0.1g·L-1),分别为蔗糖、硼酸(各处理添加1g·L-1蔗糖)、二水合氯化钙(各处理添加1g·L-1蔗糖)、赤霉素素(纯度≥98%,各处理添加1g·L-1蔗糖)处理,最后用1 mol/L的NaOH、HCl将所有处理的培养基pH值调至5.2。单因素试验各处理的浓度梯度如表1所示。
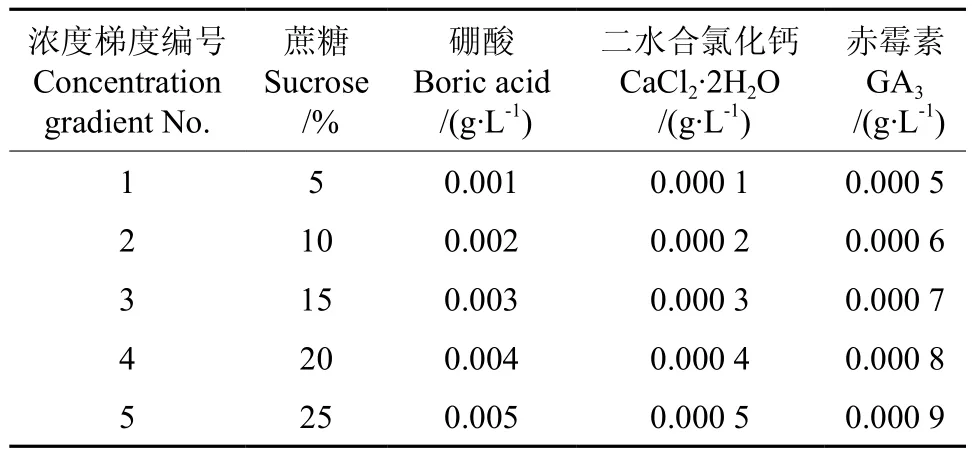
表1 单因素试验各处理的浓度梯度Table 1 Concentration gradient of each treatment under single factor experiment
(2)正交试验 在单因素试验的基础上采用L25(56)正交试验设计。
1.2.2 培养方法
将熬制好的花粉培养基用玻璃棒均匀滴到凹形载玻片上,用消毒后的头发丝蘸取花粉均匀涂抹到培养基上,播好的玻片放到有湿润滤纸的培养皿中,置于人工气候箱中培养,气候箱的温度设为25℃,湿度30%,光照调为0,在暗环境里开始培养,单因素试验6h后统计花粉萌发率,正交试验分别培养2、4、6h,其间进行观察,每个处理重复3次。
1.2.3 数据统计与分析
在10×10显微镜下观察统计。花粉管长度等于或超过花粉粒直径视为已萌发,每处理统计5个视野,每个视野花粉不少于50粒,至少3个重复。花粉培养6h后,每个视野随机选择10条已萌发的花粉管用目镜测微尺测量长度,3次重复,同时用奥林巴斯CX21相机照相。
花粉萌发势=(规定时间内花粉萌发数/花粉萌发总数)×100%。
方差分析采用SPSS软件,多重比较用duncan法(新复极差法)。
2 结果与分析
2.1 单因素处理对‘优一’花粉萌发的影响
2.1.1 蔗糖对‘优一’花粉萌发的影响
‘优一’在不同体积分数蔗糖培养基上花粉萌发率随着蔗糖体积分数的增加呈现先增后减的趋势(见图1)。适宜的蔗糖体积分数可以明显提高‘优一’花粉的萌发率,15%的蔗糖是‘优一’花粉萌发的较适宜体积分数,花粉萌发率达27.1%,较其它处理在0.05水平上差异显著。当蔗糖体积分数超过15%,花粉萌发率开始下降,高体积分数蔗糖则抑制了花粉的萌发,但仍高于低体积分数5%、10%的萌发率,在0.05水平上差异显著。
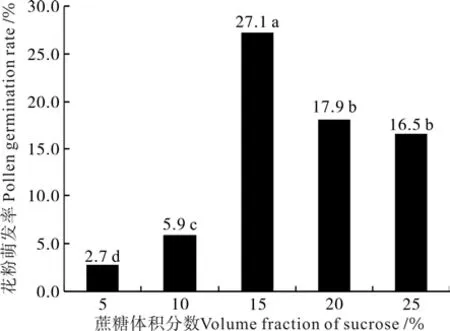
图1 不同蔗糖浓度下‘优一’花粉的萌发率Fig.1 ‘Youyi’pollen germination rates under the conditions of different volume fractions of sucrose
2.1.2 硼酸对‘优一’花粉萌发的影响
在10%蔗糖琼脂培养基中添加不同质量浓度的硼酸,随着硼酸质量浓度的增加,‘优一’花粉萌发率有显著增加,当硼酸质量浓度达0.003g·L-1时,花粉萌发率达到最高值38.8%,较其它质量浓度处理在0.05水平上差异显著。当硼酸质量浓度超过0.003g·L-1时,花粉的萌发率开始下降,高质量浓度的硼酸抑制了花粉的萌发(见图2)。
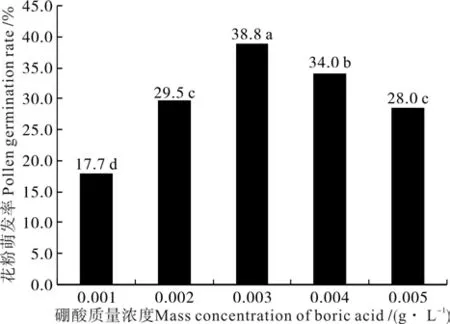
图2 不同硼酸质量浓度下‘优一’花粉的萌发率Fig.2 ‘Youyi’pollen germination rates under the conditions of different mass concentrations of boric acid
2.1.3 二水合氯化钙对‘优一’花粉萌发的影响
在10%蔗糖琼脂培养基中添加不同质量浓度的Ca2+,‘优一’花粉的萌发率如图3所示。由图3可知,低质量浓度的Ca2+可增加‘优一’花粉萌发率,较高质量浓度的Ca2+则明显抑制了花粉的萌发。当二水合氯化钙质量浓度从0.000 1g·L-1增加到0.000 2g·L-1,‘优一’花粉萌发率从14.5%增加到19.3%,随着二水合氯化钙质量浓度的增加花粉的萌发率开始呈现下降趋势,花粉萌发率明显低于0.000 2、0.000 1g·L-12个处理的萌发率,差异均达到显著水平。

图3 不同钙离子质量浓度下‘优一’花粉的萌发率Fig.3 ‘Youyi’pollen germination rates under the conditions of different Ca2+ mass concentrations
2.1.4 赤霉素对‘优一’花粉萌发的影响
在10%蔗糖琼脂培养基中添加不同质量浓度的GA3,‘优一’花粉的萌发率如图4所示。随着赤霉素质量浓度的增加,花粉萌发率的增加趋势明显,当GA3质量浓度为0.000 8g·L-1时花粉萌发率最高34.9%,与其它处理的萌发率在0.05水平上均有显著差异。当GA3质量浓度超过0.000 8g·L-1时,花粉萌发率开始下降,高浓度的赤霉素浓度抑制了‘优一’花粉的萌发。
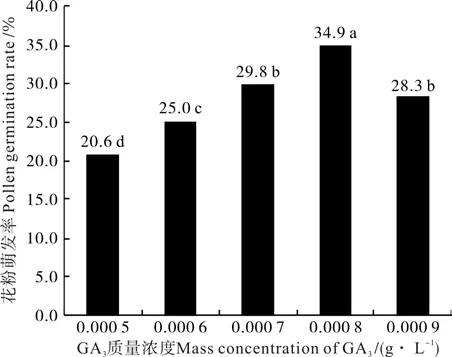
图4 不同GA3质量浓度下‘优一’花粉的萌发率Fig.4 ‘Youyi’pollen germination rates under the conditions of different mass concentrations of GA3
2.2 单因素处理对‘优一’花粉管生长的影响
2.2.1 花粉管长度
蔗糖、10%蔗糖+硼酸、10%蔗糖+二水合氯化钙、10%蔗糖+赤霉素不同质量浓度对‘优一’花粉管生长有不同影响,结果如图5所示。蔗糖、10%蔗糖+硼酸、10%蔗糖+氯化钙3种单因素处理对‘优一’花粉管生长的影响表现一致,即均随着蔗糖、硼酸、二水合氯化钙质量浓度的升高表现为“先增后减”的趋势,即低质量浓度促进生长,高质量浓度抑制生长。当蔗糖质量浓度为15%时,花粉管最长为796.7 µm,当硼酸质量浓度为0.002g·L-1时花粉管最长为905.0 µm,当二水合氯化钙浓度为0.000 4g·L-1时花粉管最长为971.7 µm。10%蔗糖+赤霉素处理的表现与前三者不同,表现为随着赤霉素质量浓度增加,花粉管的生长始终呈现增长趋势,赤霉素质量浓度从0.000 5g·L-1增加到0.000 9g·L-1时,花粉管长从1 282.3 µm增长至1 669.0 µm(见图5)。
2.2.2 花粉管生长
‘优一’在蔗糖、硼酸、二水合氯化钙、赤霉素不同培养基上,10%蔗糖+赤霉素培养基上花粉管生长量、长度、节间生长量明显要高于其它3个处理。花粉管在低质量浓度蔗糖培养基上,花粉壁破裂现象明显,花粉管顶端破裂,释放出大量内含物,随着蔗糖质量浓度的增加,花粉管破裂现象逐渐消失。在10%蔗糖里添加了硼酸、钙离子和赤霉素的培养基上,无花粉管壁破裂现象。经4种处理培养后比较,在10%蔗糖+赤霉素培养基上花粉管生长量、长度和节间生长量明显高于其它3个处理(见图6)。
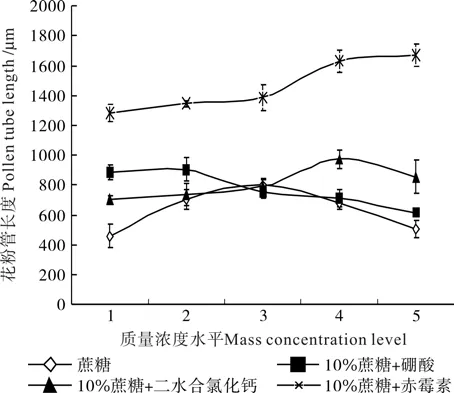
图5 单因素处理下‘优一’花粉管的长度Fig.5 ‘Youyi’pollen tube lengths under the conditions of single factor treatments
2.3 正交试验各处理对‘优一’花粉萌发的影响
‘优一’花粉萌发L25(56)正交试验结果如表2所示,4因素5水平25个水平组合的正交处理对‘优一’花粉萌发率的影响不同。培养2h的情况下,以处理14即0.1g·L-1琼脂+10%蔗糖+0.003g·L-1硼酸+0.000 0g·L-1二水合氯化钙+0.000 6g·L-1赤霉素组合的萌发率最高,达到了38.8%,较其它24个处理组合在0.05水平上差异显著,其次表现较好的组合是处理19、22、20、13、12。培养4h的情况下,以处理14的萌发率最高(42.4%),与其它24个处理组合在0.05水平上差异显著,其次表现较好的是处理19和24,萌发率分别达到了39.9%和38.4%。培养6h的情况下,处理14、24、22、20的萌发率分别为47.4%、47.3%、45.2%、43.7%,4个处理在0.05水平上无显著差异,高于其它21个处理组合且差异显著。花粉萌发势结果表明,‘优一’花粉在所观察的3个时间段中,25个处理组合在培养2h时,花粉萌发率均超过了50%,其中有5个处理达到90%以上,最高的达到96.9%,10个处理达到80%以上,其余的10个处理达到58%~70%;培养4h时,14个处理到了90%以上,最高达99.7%,9个处理达80 %以上,仅1个处理为74.3%。同时,极差R分析结果表明,培养2、4、6h时,各因素的表现一致,均为蔗糖>硼酸>二水合氯化钙>赤霉素(见表3)。

图6 单因素处理下培养6h‘优一’花粉管生长情况Fig.6 Growth status of ‘Youyi’pollen tube cultivated for six hours under the conditions of single factor treatments
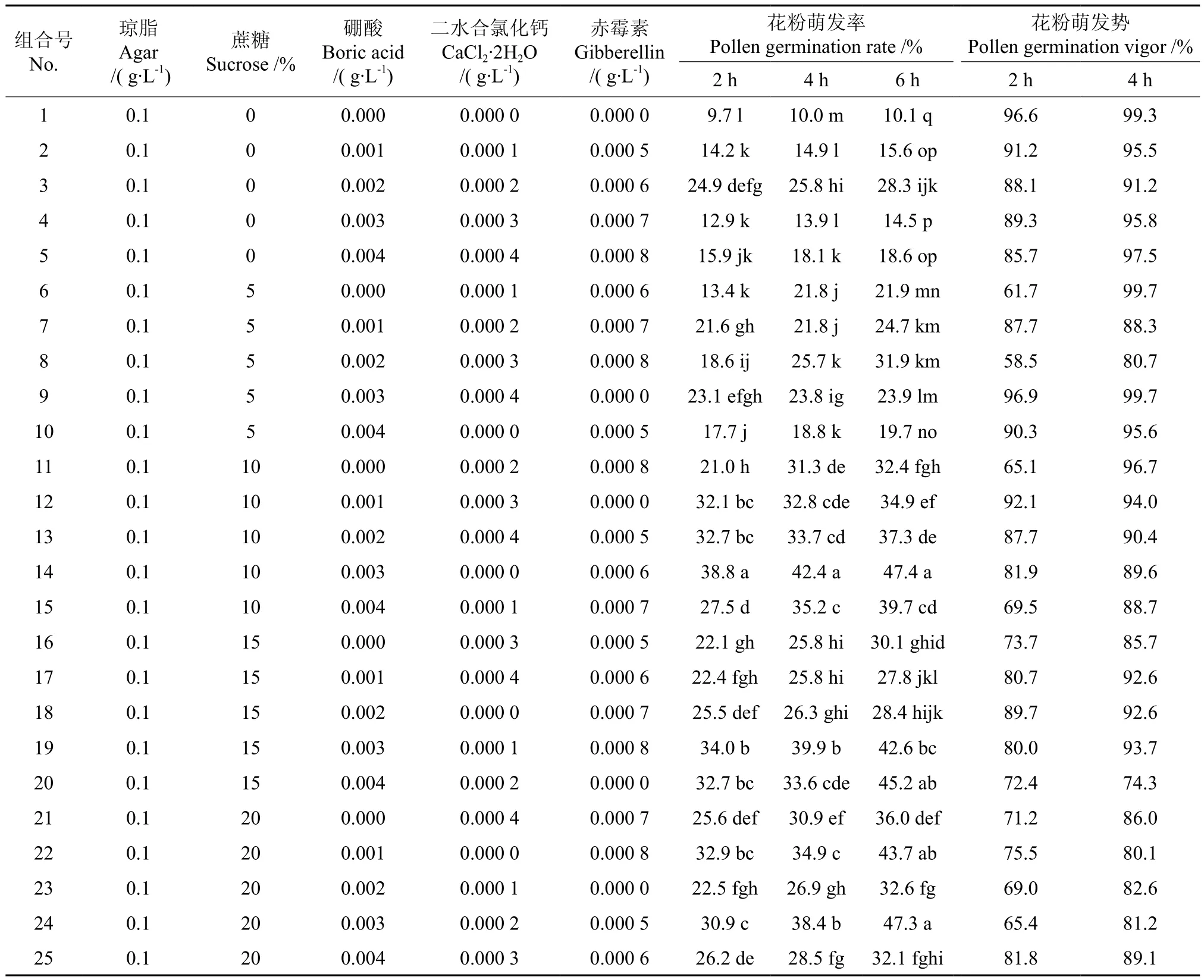
表2 ‘优一’花粉萌发L25(56)正交试验结果†Table 2 Result of L25(56)orthogonal test of ‘Youyi’pollen germination
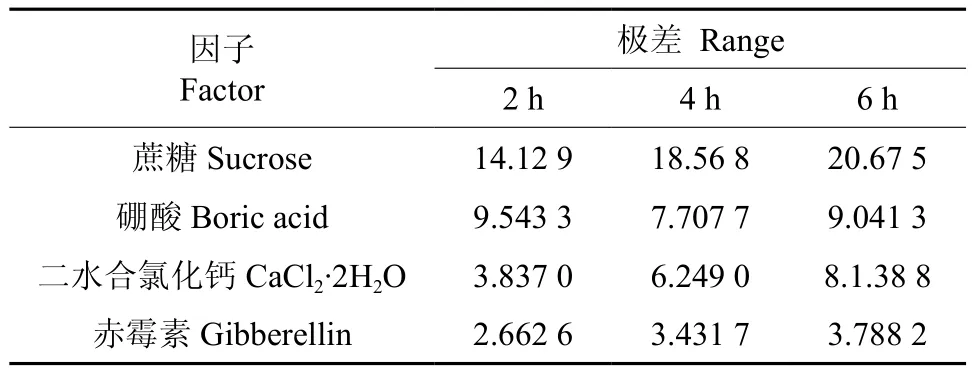
表3 ‘优一’花粉萌发L25(56)正交试验方差分析Table 3 Variance analysis of ‘Youyi’pollen germination in the L25(56)orthogonal test
3 结论与讨论
花粉离体萌发大多采用蔗糖作为基本培养基,蔗糖除了能为花粉萌发提供营养外,还可以调节花粉的渗透压[12]。当培养基中蔗糖体积分数高于花粉内部的渗透压时,花粉会发生质壁分离现象,使花粉萌发受到抑制;而蔗糖体积分数过低时又会造成花粉壁破裂,表现为花粉管顶端破裂,花粉内含物溢出[13]。本研究结果表明,‘优一’花粉随着蔗糖体积分数的增加,花粉萌发率、花粉管伸长长度均表现“先增后减”的趋势;且在低体积分数蔗糖培养基中,有部分萌发的花粉管顶端爆裂,有明显内含物明显溢出的现象,随着蔗糖体积分数增加,花粉壁破裂现象消失。适宜的蔗糖体积分数花粉管生长健壮,花粉的内外渗透压才能保持平衡,维持正常的生活力,有利于萌发。
硼的主要作用是参与花粉管顶端细胞壁的形成,增加糖的吸收、运转和代谢,形成糖硼酸复合体,增加氧的吸收,对迅速伸长的花粉管膜中果胶物质的合成起作用。一般在自然条件下,花粉本身含有一定量的硼,但是含量远不够满足自身萌发的需要,花粉中自身硼的含量是不足的,往往需要由柱头和花柱内的硼来补偿[14]。文中‘优一’花粉在10%蔗糖的离体培养上加入微量元素硼,随着硼质量浓度的增加,对花粉萌发及花粉管的伸长具有明显促进作用,花粉的萌发率最高达到38.8%,比适宜的单一蔗糖体积分数下的萌发率27.1%要高,说明在蔗糖培养基中补充一定质量浓度的硼元素是必要的。
Ca2+主要影响花粉萌发的速度和花粉管生长速度,且能诱导花粉管产生一定的趋向性,从而保持顶端的极性生长。一般认为,由于花粉内存在较多的Ca2+,而缺乏硼素,因此花粉萌发时,胞外Ca2+对花粉萌发率的影响不及硼素显著[15]。文中试验结果与此观点一致。钙离子质量浓度对‘优一’花粉萌发率和花粉管生长长度的影响与硼酸质量浓度的变化趋势一致,但所需的钙离子质量浓度远小于硼离子质量浓度,且10%蔗糖培养基中加入钙离子的萌发率比加入硼元素后的萌发率低,但就花粉管生长速度及花粉管生长长度的促进作用来说,钙离子优于硼元素。
赤霉素能抑制植物体内生长素分解系统的活动,以保证体内生长素含量水平,因此,一定质量浓度的外源赤霉素处理,能促进花粉萌发和花粉管生长[16]。本试验在10%蔗糖培养基中添加少量赤霉素,赤霉素在一定质量浓度范围内对花粉离体萌发起促进作用,超过一定质量浓度后萌发率则降低。而在赤霉素质量浓度0.000 5~0.000 9g·L-1设定范围内,随着赤霉素质量浓度增加,花粉管伸长始终呈现增长趋势,增长幅度远大于其它3个处理。超高质量浓度的赤霉素是否会抑制‘优一’花粉管伸长还有待进一步研究。
蔗糖、硼酸、二水合氯化钙、赤霉素L25(56)正交试验结果表明,0.1g·L-1琼脂+1g·L-1蔗糖+0.003g·L-1硼酸+0.000 0g·L-1二水合氯化钙+0.000 6g·L-1赤霉素组合培养2~6h时‘优一’花粉萌发率均表现最高,是花粉萌发的最佳组合。‘优一’花粉在20种组合离体条件下培养2h时,花粉萌发率均超过50%,培养4h时,有14个处理的花粉萌发势达90%以上。此结果表明,‘优一’花粉在适宜萌发条件下,培养2~4h是花粉萌发的高峰期,且蔗糖、硼酸是影响花粉萌发的最关键因素。
[1] 李全义,付桂荣,于 青,等.仁用杏的营养价值和市场销售动态[J].中国果品研究,1996,(3):31.
[2] 侯智霞,翟明普,蔡秀芝,等.我国仁用杏生产现状分析[J].北方园艺,2008,(2): 39-41.
[3] 刘 宁,刘威生,赵 锋,等.我国仁用杏主产区生产发展概述[J].北方果树,2004,(增刊): 48-49.
[4] 刘月梅,白小安.白于山区仁用杏生产中存在的问题及对策[J].延安大学学报:自然科学版,2007,3(26):77-79.
[5] 景 淼,翟明普.仁用杏开花座果的研究进展[J].中国农学通报,2008,1(24):132-135.
[6] 靳利军.仁用杏花期生物学特性及抗寒机制研究[D].北京:北京林业大学,2008.
[7] 白泽晨,冯建荣,李文慧,等.新疆5个栽培杏品种雌蕊败育率调查[J].新疆农业科学,2012,49(10):1805-1809.
[8] 田莉莉,方金豹.杏开花结果习性研究初报[J].山西果树,2002,(1):4-6.
[9] 王保明,顶改秀,童德中,等.仁用杏雌性器官败育研究[J].山西农业科学,2000,28(1):57-61.
[10] 刘立强,秦 伟,廖 康,等.新疆若干杏品种开花生物学特性研究[J].新疆农业科学,2007,44 (6):751-755.
[11] 李海英,李子平.提高仁用杏坐果率技术措施[J].黑龙江农业科学,2008,(4):66-67.
[12] 姚成义,赵 洁.钙和硼对蓝猪耳花粉萌发及花粉管生长的影响[J].武汉植物学研究,2004,22(1): 1-7.
[13] 吴开志,肖千文,廖运洪,等.核桃花粉离体萌发的培养基研究[J].果树学报,2008,25(6):941-945.
[14] 蒲光兰,周兰英,李瑾宵,等.温度、蔗糖和硼酸对麻疯树花粉离体萌发的影响[J].西北林学院学报,2011,26(3):55-58.
[15] TIANLL,WANG J,NIU L,et al.Breeding of disease resistant seedless grapes using Chinese wildVitis sppI in vitro embryo rescue and plant development[J].Scientia Horticulturae,2008,117(2): 136-141.
[16] 张绍铃,高付永,陈迪新,等.植物生长调剂物质对丰水梨花粉萌发和花粉管生长的影响[J].西北植物学报,2003,23(4):586-591.

