杜仲甲羟戊酸激酶(EuMK)基因鉴定及生物信息学分析
乌云塔娜,王 淋,叶生晶
(1.中国林业科学研究院 经济林研究开发中心,河南 郑州 450003;2.国家林业局杜仲工程技术研究中心,河南 郑州 450003;3.中南林业科技大学a.经济林育种与栽培国家林业局重点实验室;b.林学院,湖南 长沙410004;4.国家林业局中南林业调查规划设计院,湖南 长沙 410014)
杜仲Eucommia ulmoidesOliv是我国特有的药用树种和胶源树种,是第三纪孑遗植物[1-2]。杜仲作为药材富含大量苯丙素类、黄酮类、木质素类等活性成分,具有抗衰老、降血压、安胎、增强免疫功能等多种功效[3-5];作为源树种,杜仲果实、叶子、树皮等组织均含有大量的丝状天然产物——杜仲胶,具有“橡胶-塑料的双重性质”被广泛的应用于橡胶、航天、医疗等多个领域[6]。
杜仲胶是天然橡胶顺式聚异戊二烯的同分异构体,其化学结构为反式聚异戊二烯,聚异戊二烯是重要有机物质,其合成是通过甲羟戊酸代谢途径的一系列酶的酶促反应进行的[7]。甲羟戊酸激酶(mevalonate kinase,MK)是MVA代谢途径的限速酶之一,MK在动物中主要对控制胆固醇类生物合成其作用,而在植物中,MK主要参与类异戊二烯化合物的生物合成[8-9]。MK能将三磷酸腺苷(ATP-C)中的磷酸基团转移到甲羟戊酸(mevalonate,MVA)第5位的羟基上形成甲羟戊酸-5-磷酸(mevalonate-5-phosphate,MVAP)并释放 ADP,最终合成异戊烯焦磷酸(sopentenyl-PP,IPP),即合成萜类物质前体所必须的前体[8,10-11]。 本研究根据杜仲基因组数据,对杜仲MK基因进行生物信息学分析,为揭示EuMK基因调控杜仲萜类次生代谢产物的生物合成机制提供可靠的理论基础。
1 材料与方法
1.1 数据来源
文中以phytozome(http://www.phytozome.net/search.php)数据库、杜仲全基因组测序和转录组数据库为依据对MK基因相关分析[12-13]。
1.2 分析方法
文中利用各类生物信息学软件对MK基因进行在线分析。其中基因氨基酸残基数、氨基酸组成、蛋白质的亲疏水性等性质由 ExPASyProtParam完成;蛋白质跨膜结构及亲水性/疏水性的分析利用在线软件TMHMM、ProScale 完成;蛋白质二级及三级结构的预测利用PSIPRED和Swiss model在线工具完成;内含子及其外显子结构预测用GSDS完成;对EuMK3启动子功能的预测由PLANT CARE在线软件完成。
2 结果与分析
2.1 MK基因序列分析
利用Cluastl X2对EuMK与单子叶植物玉米Zea mays的ZmMK1、ZmMK2、ZmMK3, 水稻Oryza sativaL的OsMK,双子叶植物拟南芥Arabidopsis thaliana的AtMK,葡萄Viteus vitifoliae的VvMK,苔藓类小立碗藓Physcomitrella patens的PpMK等MK基因家族进行多重序列比较(见图1)。EuMK与其它植物的MK基因存在多个保守区,序列相似性可达到80%以上,因此确定为杜仲MK基因,记为EuMK3[14]。
2.2 MK基因聚类分析
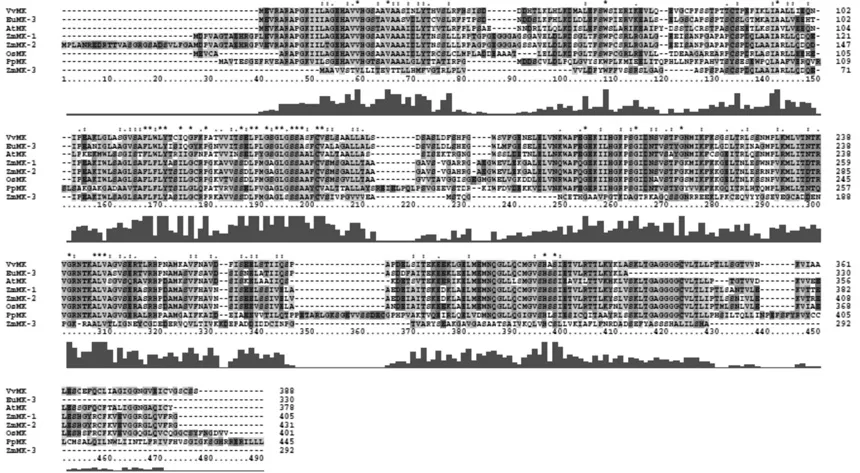
图1 全长MK蛋白多序列对比Fig.1 Multiple sequence alignment of the full length MK proteins
利 用MEGA软件对EuMK3、ZmMK1、ZmMK2、ZmMK3、OsMK、AtMK、VvMK、PpMK基因建了杜仲ACOTS的系统进化树(见图2)。从进化树中可见,共分为3个主要的分支:单子叶植物玉米、水稻为1个大分支;双子叶植物杜仲、拟南芥、葡萄为1个大分支;苔藓类小立碗藓为1个分支,这与传统植物的进化结果相一致。
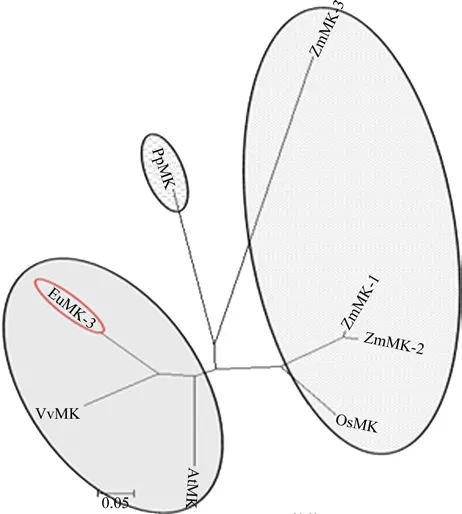
图2 MK蛋白的聚类分析Fig.2 Cluster analysis of MK proteins
2.3 MK基因的蛋白质理化性质分析
利用在线软件对植物MK基因的蛋白质具体理化性质进行了预测,结果见表1。植物MK编码氨基酸为30~450 aa;理论等电为5~8;其中,EuMK3、VvMK、ZmMK1为稳定的疏水性蛋白,而 PpMK、AtMK、ZmMK2、ZmMK3、OsMK 为稳定的亲水蛋白。
根据植物MK蛋白的氨基酸组成(见表2)可知,不用植物的HMGS基因的氨基酸组成较为不同,其中EuMK3基因中性疏水性氨基酸为Ala(A)9.7%、Asn(N)3.6%、Ile(I)6.1%、Leu(L)11.8% 、Met(M)3.0%、Phe(F)3.0%、Val(V)7.0%、Trp(W)1.2%、Tyr(Y)11.5%, 共 占56.9%;中性亲水性氨基酸为Asn(N)3.6%、Cys(C)1.5%、Gln(Q)1.2%、Gly(G)7.3%、Ser(S)11.2%、Thr(T)5.8%,共占30.6%;碱性氨基酸为Arg(R)2.7%、His(H)2.4%、Lys(K)5.5%,共占10.6%;酸性氨基酸为Asp(D)3.9%、Glu(E)7.6%,共占11.5%。
2.4 MK基因蛋白结构保守域预测
利用MEME在线工具分析了MK氨基酸序列的功能结构,见图3。所有植物MK蛋白均含有3个结构保守域均为,其中Motif1起始位置102 aa,保守序列为 IPEANIGLAAGVSAFLWLYISIQGYKPGNVVITSELPLGSGLGSSASFCV;Motif2起始位点为186 aa,保守序列为NKWAFEGERIIHG RPSGIDNTVSTYGYVVKFKKGQITRLHTQMPL RMLLT;Motif3起始位点为280 aa,保守序列为QSPASDDFAITEKEEKLEELMEMNQGLLQCMGV SHSSIETVLRTTLKYKL。
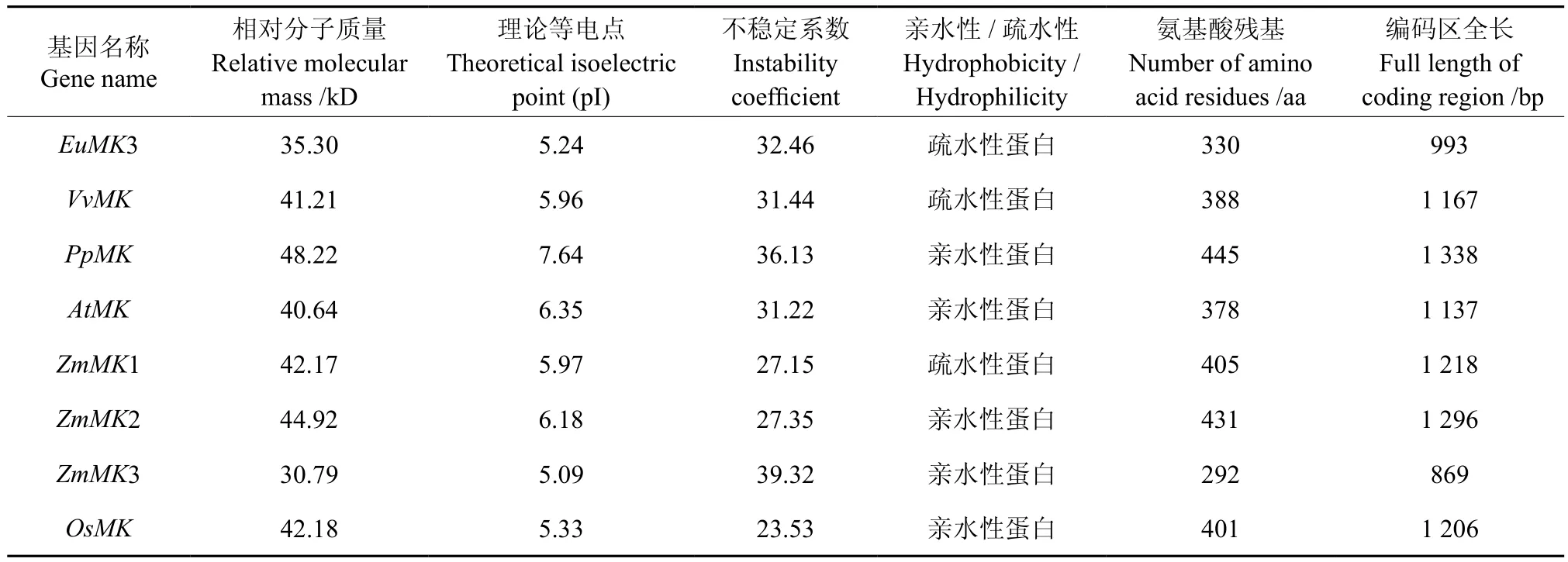
表1 MK编码氨基酸的基本理化参数Table 1 Some basis physical and chemical parmeters of MK

图3 MK基因的保守结构域Fig.3 Some conserved domains in MK gene

表2 MK蛋白质的氨基酸组成Table 2 Amino acid composition of MK protein %
2.5 EuMK3基因的蛋白质基因跨膜结构域的预测
利用在线工具TMHMM2.0对EuMK3氨基酸序列的跨膜结构域进行了预测,结果见图4。EuMK3蛋白无明显跨膜区域,蛋白全部位于膜外。
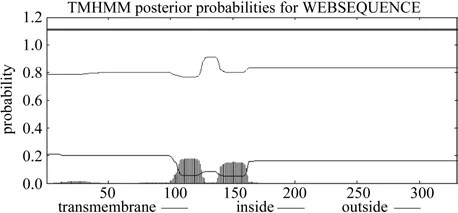
图4 EuMK3蛋白的跨膜区预测Fig.4 Predicted transmembrane domain of the deduced EuMK3 protein
2.6 EuMK3基因蛋白的二级结构的预测
根据EuMK3氨基酸序列预测其蛋白二级结构(见图5)。EuMK3二级结构中α-螺旋占42.42%,β-折叠占14.55%,螺环结构占43.03%,属于混合型结构的蛋白质。
2.7 EuMK3基因蛋白的三级结构的预测
通过在线SWISS-MODEL中的Automated Mode进行同源建模,推导EuMK3蛋白的三级结构模型(见图6)。以蛋白模板(2r3vA),ExPAsy structure assessment 程序评测推导的EuMK3蛋白模型QMEAN 6 得分为0.45,蛋白序列的相似性为32.93%。
2.8 EuMK3基因的内含子和外显子预测及分析
根据已知的杜仲EuMK3基因组序列及其对应的完整编码序列(coding sequence,CDS),预测了EuMK3基因组结构记忆分布情况,分别见图7和表3。EuMK3共有4个外显子,3个内含子,其中位于1相位的内含子2个,2相位的内含子1个。
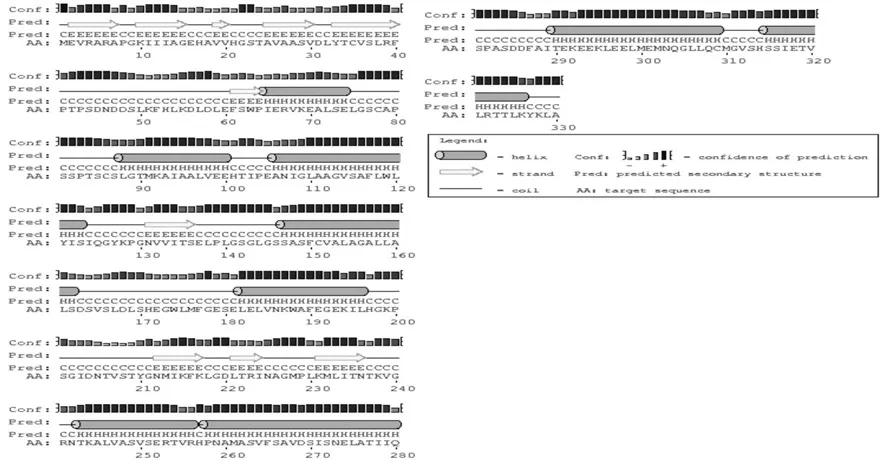
图5 EuMK3蛋白二级结构预测Fig.5 Predicted secondary structure of the deduced EuMK3 protein
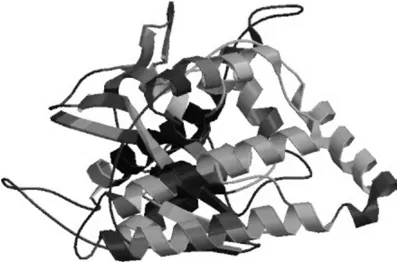
图6 EuMK3蛋白三级结构预测Fig.6 Predicted tertiary structure of the deduced EuMK3 protein

表3 EuMK3外显子和内含子分布序列Table 3 Distribution sequence on the introns and exons of EuMK3 bp
2.9 EuMK3基因启动子的顺式元件作用分析
利用plantCARE 启动子在线数据库,预测EuMK3基因的启动子(5’UTR 2 000 bp)的主要顺式元件潜在的分布以及功能。EuMK3家族基因启动子主要顺式元件潜在的分布以及功能(见表4)。结果发现EuMK3基因启动子含有大量TATAbox,CAATbox基本顺式作用元件、光响应作用元件(G-box)、防御与胁迫(TC-rich repeats)、参与生理调节(circadian)、热胁迫(HSE)以及脱落酸(ABRE)应答相关调控元件。

图7 EuMK3基因内含子和外显子预测Fig.7 Prediction on introns and exons in EuMK3
3 结论与讨论
甲羟戊酸(mevalonate pathway,MVA)途径又称细胞质途径,其中间体甲羟戊酸激酶属于细胞质酶[14],受代谢产物反馈抑制调节。Champenoy[15-17]等提出植物不同阶段的生长发育,MK酶活性是不同的,因此通过调控MK酶活性可以参与调控植物的生长发育。Tang Wei[18]等对白松MK基因的转录水平上进行分析,白松MK基因在植株的生长发育阶段均有表达,并且在根的分生组织区及花器官中表达量相对较高。叶生晶[14]提出EuMK3基因在杜仲果实和叶子中均有表达,在果实中的表达量远远高于叶子,且存在显著的差异,且对EuMK基因荧光定量PCR的引物筛选,从而在定量PCR中检测萜类物质合成MVA途径各基因的表达差异分析[19]。MK基因参与MVA途径合成各种衍生物,对植物生长发育具有一定的调控作用。
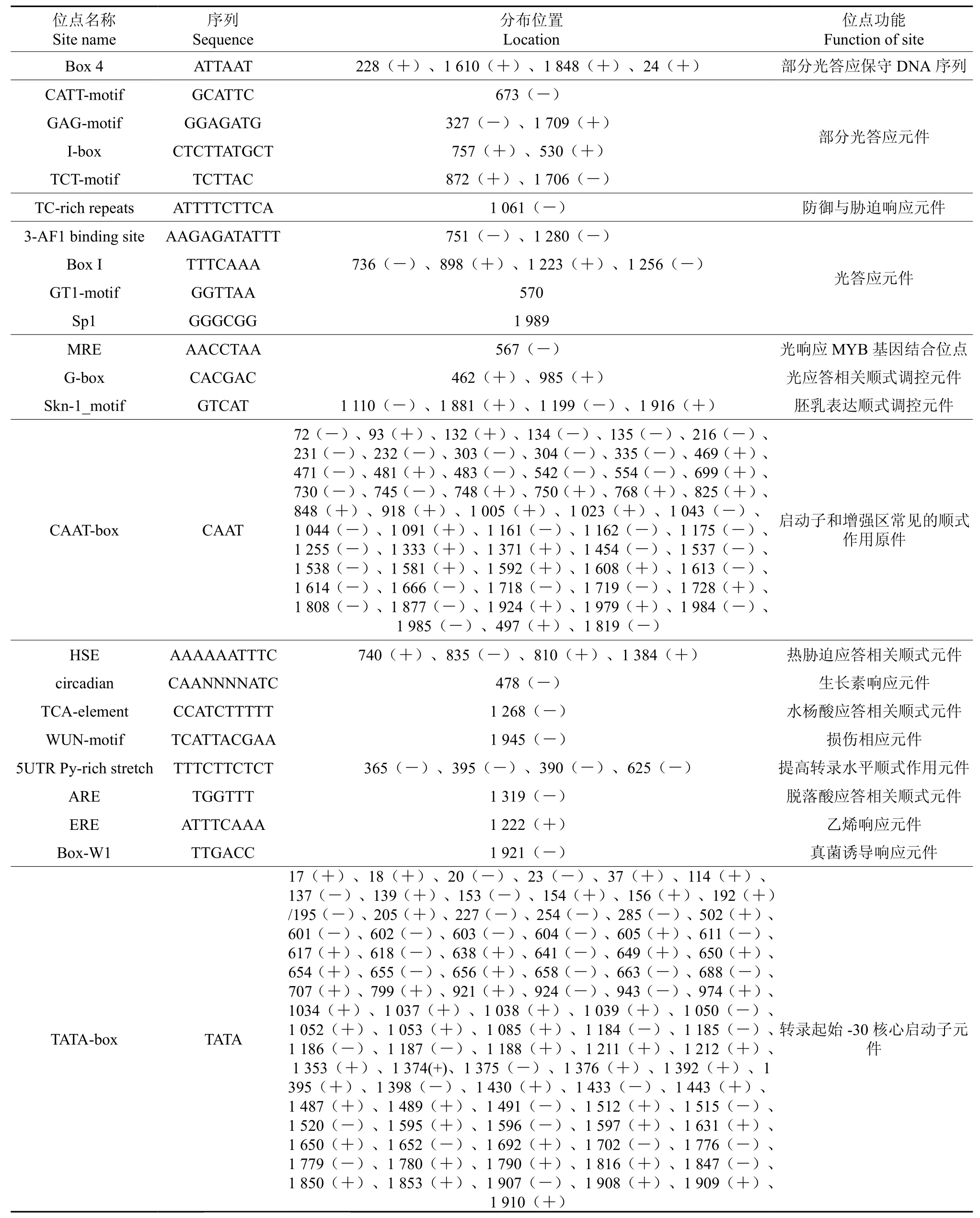
表4 EuMK3基因启动子区顺式元件作用预测Table 4 Function prediction on the cis-elements of promoters in EuMK3
通过与其它植物MK基因进行多重序列比较,杜仲MK基因其已知植物MK基因序列相似行较高,因此确定为EuMK。结构域预测显示杜仲、玉米、水稻、拟南芥、葡萄、小立碗藓的MK基因均含有与甲羟戊酸底物结合及催化反应有关的3结构保守域。不同植物MK基因,具有相似的结构保守域,说明各个植物MK基因具有相似的酶促反应机理[20]。
EuMK3基因启动子内部存在着大量光诱导型启动子相关元件(G-box、Box 4 、CATT-motif、GAG-motif、I-box、TCT-motif、Box I、GT1-motif), 推测EuMK3可能是基因启动子是一种光诱导型启动子。EuMK3启动子还含有高温胁迫应答相关元件HSE,即使应答高温等逆境胁迫[21];乙烯应答元件(ERE)、茉莉酸应答相关元件(CGTCAmotif)、水杨酸酸应答相关元件(TCA-element),推测基因启动子的转录调控活性可能受到及植物激素脱落酸、乙烯、茉莉酸等多种信号途径的协同作用[22]。
文中首次对杜仲甲羟戊酸激酶(EuMK)进行了全面的生物信息学分析,对EuMK基因的表达调控机制以及次生代谢物积累了分子机理,为萜类物质-杜仲胶的合成提供了重要的理论基础。
[1] 杜红岩,谢碧霞,邵松梅.杜仲橡胶的研究进展与发展前景[J].中南林学院学报,2003,23(4):95-99.
[2] 王弦云,朱晓敏,王 勤.杜仲ISSR-PCR反应体系的建立与引物筛选及其在遗传多样性研究中的应用[J].经济林研究,2013,31(1):30-34.
[3] 杜红岩.杜仲活性成分与药理研究的新进展[J].经济林研究,2003,21(2):58-61.
[4] 杜红岩,刘昌勇,李 钦,等.杜仲叶中3 种主要活性成分含量的季节变化[J].中南林业科技大学学报,2011,31(8): 6-9.
[5] 高 超,闫文德,田大伦,等.杜仲光合速率日变化及其与环境因子的关系[J].中南林业科技大学学报,2011,31(5): 100-104.
[6] 杜红岩,胡文臻,俞 锐.杜仲产业绿皮书:中国杜仲橡胶资源与产业发展报告[M].北京:社会科学文献出版社,2013:133-134.
[7] 王宝莲,樊庆琦,李永波.甲羟戊酸激酶基因研究进展[J].中国农业科技导报,2011,13(3):17-25.
[8] David Potter,Hellry M,Miziorko.Identifieation ofCatalytic Residuesin Human Mevalonate Kinase[J].The journal of biological chemistry,1997,(272): 25449-25454.
[9] John L Ai,Kristina D,Thomas S L.Streptococcus pneumoniae isoprenoid biosynthesis is downregulated by diphosphomevalonate: an antimicrobial target[J].Biochemistry,2004,43:16461-16466.
[10] Bach T J.Some new aspects of isoprenoid biosynthesisin plants a review[J].Lipids,1995,30(3): 191-202.
[11] Lange BM,Croteau R.sopentenyl diphosphate biosynthesis via a mevalonate-independent pathway: isopentenyl monophosphate kinase catalyzes the terminal enzymatic step[J].Proc Natl Acad Sci USA,1999,96(24):13714-13719.
[12] 李铁柱,杜红岩,刘慧敏,等.杜仲果实和叶片转录组数据组装及基因功能注释[J].中南林业科技大学学报,2012,32(11):122-130.
[13] 李铁柱,杜红岩,刘慧敏,等.杜仲幼果和成熟果实转录组数据组装及基因功能注释[J].中南林业科技大学学报,2012 ,32(10): 9-17.
[14] 叶生晶.杜仲MVA途径相关基因表达差异及全长cDNA序列特征[D].长沙:中南林业科技大学,2012.
[15] PoPjak G.Enzymes of sterol biosynthesis in liver and intermediates of sterol biosynthesis[C]// B C Raylllond.Methods Enzymology Steroids and Terpenoids.London: Academic Press,1969: 393-454.
[16] Cham penoy S,Tourte M.Expression of the yeastm evalonate kinase gene in transgenic tobacco[J].Mol Breed,1998,4(4):291-300.
[17] Cham penoy S,Vau zelle C,Tourte M.Activity of the yeastm evalonate kinase promoter in transgenic tobacco[J].Plant Sci,1999,147(1):25-35.
[18] Tang Wei,New ton R J.Mevalonate kinase activity during different stages of plant regeneration from nodular callus cultures in white pine (Pinus strobus)[J].Tree Physiol,2006,26(2):195-200.
[19] 叶生晶,乌云塔娜,田大伦,等.杜仲MVA途径相关基因的鉴定及荧光定量PCR引物筛选[J].中南林业科技大学学报,2013,8(33):50-56.
[20] Chu X,Li D.Expression,purification,and characterization of His 20 mutants of rat mevalonate kinase[J].Protein Expr Purif,2003,32:75-82.
[21] 姜志磊,李淑芳,胡 庆.水稻、拟南芥组织特异性启动子的序列特征分析[J].中国农学通报,2013,29(15):142-148.
[22] 董 浩,赵轶君,李红民.生菜rbcS基因启动子序列的克隆与分析[J].华北农学报,2013,28(1): 88-92.

