杜仲EuHMGS基因鉴定及生物信息学分析
王 淋,乌云塔娜,叶生晶
(1.中南林业科技大学 a.经济林育种与栽培国家林业局重点实验室;b.林学院,湖南 长沙 410004;2.中国林业科学研究院 经济林研究开发中心,河南 郑州 450003;3.国家林业局杜仲工程技术研究中心,河南 郑州450003;4.国家林业局中南林业调查规划设计院,湖南 长沙 410014)
我国是世界上最大的橡胶消费国,橡胶被广泛应用于工业、航空及军事等高科技领域[1]。我国对国外橡胶的需求量较大,而我国特有的经济物种杜仲是名贵的药材,已被收录于2010 版中国药典[2]。不仅如此,杜仲果实、叶片、树皮、根部均含优质天然橡胶——杜仲胶[3],其中杜仲叶含胶量为1%~3%,果实含胶量为10%~12%,是世界上极具发展潜力的优质天然胶资源[4]。杜仲果实的含胶量较高,利用杜仲果皮提取杜仲胶,可以降低杜仲胶提取的生产成本,促进杜仲胶产业的发展[5]。杜仲胶作为多萜类化合物,其结构与三叶橡胶顺式异戊二烯不同,杜仲胶为反式异戊二烯,这就决定了杜仲胶具有独特的橡塑二重性,被誉为高分子合金[6-7]。
萜类物质合成主要通过以下2条途径:一是Michel Rohmer和Duilio Arigoni等[8-9]提出位于质体的2-甲基-D-赤藓醇-4-磷酸途径(MEP),二是Lynen等[10-11]提出位于细胞质的甲羟戊酸途径(MVA),其中3-羟基-3-甲基戊二酰辅酶A合成酶(3-Hydroxy-3-methylglutaryl-coenzyme A synthase,HMGS)是位于MVA 途径中的一个重要的代谢酶,乙酰乙酰CoA(acetoacetyl-CoA)经羟甲基戊二酰CoA合酶(HMGS)的催化形成3-羟基-3-甲基戊二酰CoA(HMG-CoA),随后在HMGCoA还原酶(3-Hydroxy-3-methylglutaryl-coenzyme A reductase,HMGR)的作用下生成甲羟戊酸(MVA),甲羟戊酸经焦磷酸化和脱羧作用形成异戊烯焦磷酸IPP,从而为杜仲胶的生物合成提供通用前体[12-13]。
目前,已经从动物和植物的MVA途径中系统分离出来HMGS基因进行了研究[14],而本文中利用生物信息学技术,对杜仲胶生物合成的重要靶点之一的HMGS基因进行相关的预测及分析,旨在为利用基因工程技术代谢调控杜仲胶生物合成提供理论依据。
1 材料与方法
1.1 数据来源
玉米Zea mays、拟南芥Arabidopsis thaliana、葡萄Viteus vitifoliae、小立碗藓Physcomitrella patens基因组以及编码区序列来源于phytozome(http://www.phytozome.net/search.php)数据库,杜仲Eucommia ulmoidesOliv.数据来源于杜仲全基因组测序以及转录组数据[15-16]。
1.2 分析方法
利用生物信息学软件ExPASyProtParam、TMHMM对EuHMGS基因氨基酸残基数、氨基酸组成、蛋白质相对分子质量、理论等电点、蛋白质的亲疏水性等性质以及蛋白的结果保守域进行了预测与分析;利用PSIPRED、Swiss model预测蛋白质的二级、三级结构;利用软件GSDS对EuHMGS基因组结构进行预测;利用PLANT CARE在线软件预测EuHMGS基因启动子序列中可能存在的顺式元件进行分析。
2 结果与分析
2.1 HMGS基因序列分析
杜仲EuHMGS基因氨基酸序列与拟南芥Arabidopsis thaliana、葡萄Viteus vitifoliaeHMGS基因家族的基因序列相比较,存在多个保守区,序列相似性达到80 %以上(见图1),因此命名为EuHMGS,记为EuHMGS4[17]。

图1 全长HMGS蛋白多序列对比Fig.1 Multiple sequence alignment of the full length HMGS proteins
2.2 HMGS基因家族聚类分析
利用MEGA5.1软件对单子叶植物玉米Zea mays、双子叶植物拟南芥Arabidopsis thaliana、葡萄Viteus vitifoliae、苔藓类小立碗藓Physcomitrella patens的HMGS基因家族进行进化分析,构建了杜仲HMGS的系统进化树(见图2)。从系统进化树图中可知,单子叶植物玉米,双子叶植物杜仲、拟南芥、葡萄,苔藓类小立碗藓共分为3个主要的大分支,符合传统的进化分类结果。其中EuHMGS位于双子叶植物的1个大分支,且与VvHMGS2的遗传距离相对较近,说明EuHMGS4与VvHMGS2的同源关系较近。
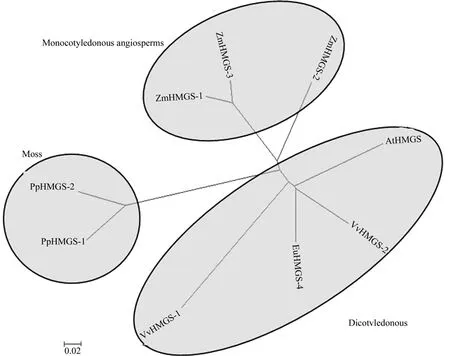
图2 HMGRS蛋白的聚类分析Fig.2 Cluster analysis of HMGRS proteins
2.3 HMGS基因家族的蛋白质理化性质分析
对各个植物HMGRS基因家族的蛋白质理化性质进行了预测,结果如表1所示。HMGRS基因编码氨基酸为450~470 aa;相对分子质量为50~52kD;理论等电点为5~6,不同植物的HMGS基因编码氨基酸数、相对分子质量以及理论等电点均较为一致。EuHMGS4、VvHMGS1为不稳定的疏水蛋白;ZmHMGS3为不稳定的亲水蛋白;AtHMGS为稳定的疏水蛋白;VvHMGS2、PpHMGS1、PpHMGS2、ZmHMGS1、ZmHMGS2为稳定的亲水蛋白。

表1 HMGS编码蛋白质的基本理化参数Table 1 Physical and chemical parmeters of HMGS
HMGS蛋白质的氨基酸组成如表2所示。由表2可见,HMGS基因所编码蛋白质的氨基酸组成大致相同,其中EuHMGS4中性疏水性氨基酸 为 Asn(N)3.3%、Ala(A)8.2%、Ile(I)4.6%、Leu(L)7.7%、Met(M)3.5%、Phe(F)4.9%、Val(V)6.0%、Trp(W)0.4%、Tyr(Y)5.3%,共43.8%;中性亲水性氨基酸为Asn(N)3.3%、Cys(C)2.2%、Gln(Q)3.5%、Gly(G)6.4%、Ser(S)9.7%、Thr(T)6.2%,共31.3%;碱性氨基酸为Arg(R)3.3%、His(H)2.0%、Lys(K)7.1%,共10.4%;酸性氨基酸为Asp(D)5.3%、Glu(E)6.2%,共11.5%。
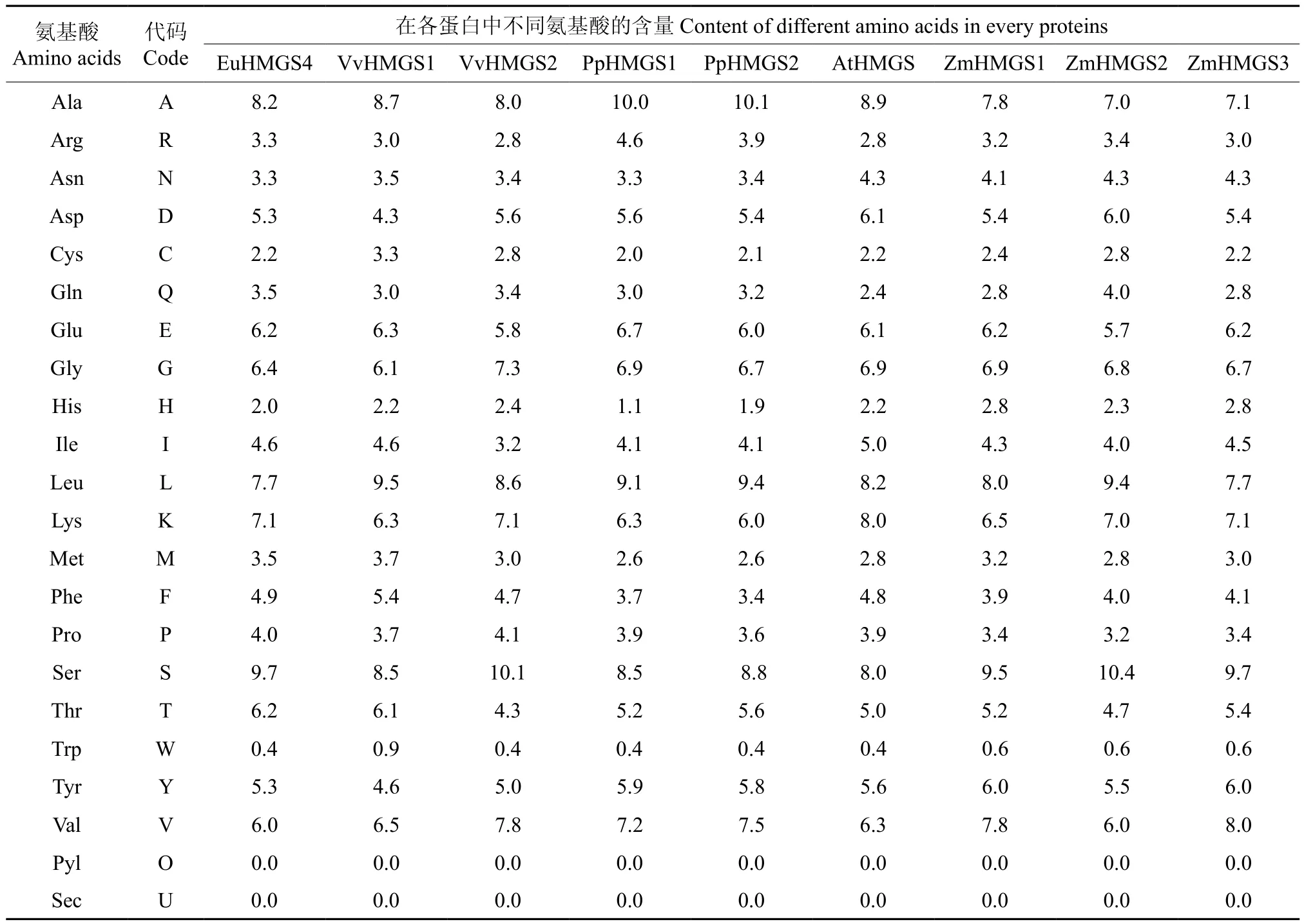
表2 HMGS蛋白质的氨基酸组成Table 2 Amino acid composition of HMGS %
2.4 EuHMGS基因蛋白结构保守域预测
利用MEME在线工具分析HMGRS氨基酸序列的功能结构域(见图3),无论是单子叶植物、双子叶植物还是苔藓类植物,HMGRS蛋白的结构保守域均为3个,且3个保守区均靠近蛋白的N端,其中Motif1起始位点为9 aa,保守序列为 ILAMEI YFPPTCVQQEAMETHDGVSKGKYTIGLGQDCM AFCTEVEDVISM;Motif2起始位点为72 aa,保守序列为IDPTQIGRMEVGSETVIDKSKSIKTFLMQI FEECGNTDIEGVDSTNACYG;Motif3起始位点为128 aa,保守序列为NCTNWVESSSWDGRYGLVV CTDSAVYAEGPARPTGGAAAIAMLIGPDAPI。
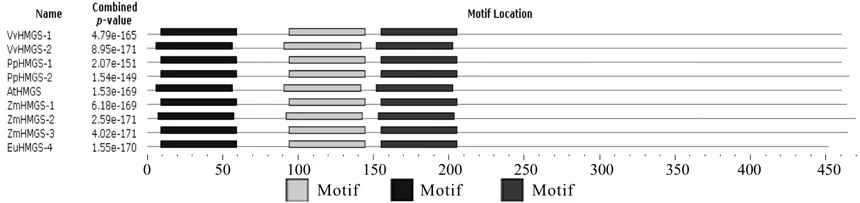
图3 HMGS基因的保守结构域Fig.3 The conserved domains in HMGS gene
2.5 EuHMGS基因的蛋白质基因跨膜结构域的预测
利用在线工具TMHMM2.0对EuHMGS4氨基酸序列的跨膜结构域进行预测(见图4)。EuHMGS4蛋白无明显跨膜区,蛋白全部位于膜外。
2.6 EuHMGS4蛋白的二级结构的预测
根据EuHMGS4氨基酸序列,预测其蛋白的二级结构(见图5)。结果表明,EuHMGS4蛋白二级结构中α-螺旋占38.05 %,β-折叠占12.17 %,螺环结构占49.78 %,属于混合型结构的蛋白质。

图4 EuHMGS4蛋白的跨膜区预测Fig.4 Predicted transmembrane region of the deduced protein of EuHMGS4 protein

图5 EuHMGS4蛋白二级结构预测Fig.5 Predicted secondary structure of the deduced EuHMGS4 protein
2.7 EuHMGS蛋白的三级结构的预测
采用Auto mode建模方式对EuHMGS4蛋白进行同源建模,得到了EuHMGS4蛋白的三维空间模型,如图6所示。ExPAsy structure assessment程序评测推导的EuHMGS4蛋白模型QMEAN 6 得分为0.7。
2.8 EuHMGS基因的内含子和外显子预测及分析
将杜仲HMGS基因组序列及其对应的完整编码序列(coding sequence CDS)提交到GSDS在线网站预测基因组序列特征,结果如图7和表3所示。EuHMGS基因家族不同的基因具有不同的外显子和内含子数量,其中EuHMGS4有11个外显子,10个内含子,其中位于0相位的内含子6个,1相位的内含子1个,2相位的内含子3个。
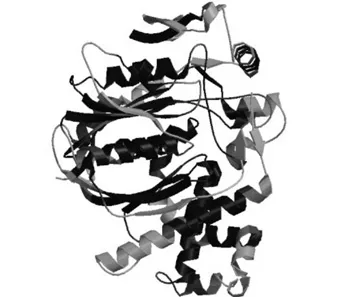
图6 EuHMGS4蛋白三级结构预测Fig.6 Predicted tertiary structure of the deduced EuHMGS4 protein

图7 EuHMGS基因内含子和外显子预测Fig.7 Prediction on the intron and exon in EuHMGS

表3 EuHMGS4外显子和内含子分布序列Table 3 Distribution sequence on the intron and exon in EuHMGS4 bp
2.9 EuHMGS4基因启动子的顺式元件作用分析
利用PLACE 和plantCARE 在线数据库,预测EuHMGS基因启动子(5’UTR 2 000bp)的主要顺式元件潜在的分布以及功能(见表4)。结果发现,EuHMGS基因启动子含有大量基本顺式作用元件TATAbox、CAATbox,除此之外,EuHMGS4启动子部分还还有热胁迫(HSE)、脱落酸(ABRE)、水杨酸(TCA-element)、乙烯(ERE)等相关调控元件,这些顺式作用元件均可能参与杜仲MK基因功能以及萜类物质代谢调控的过程。
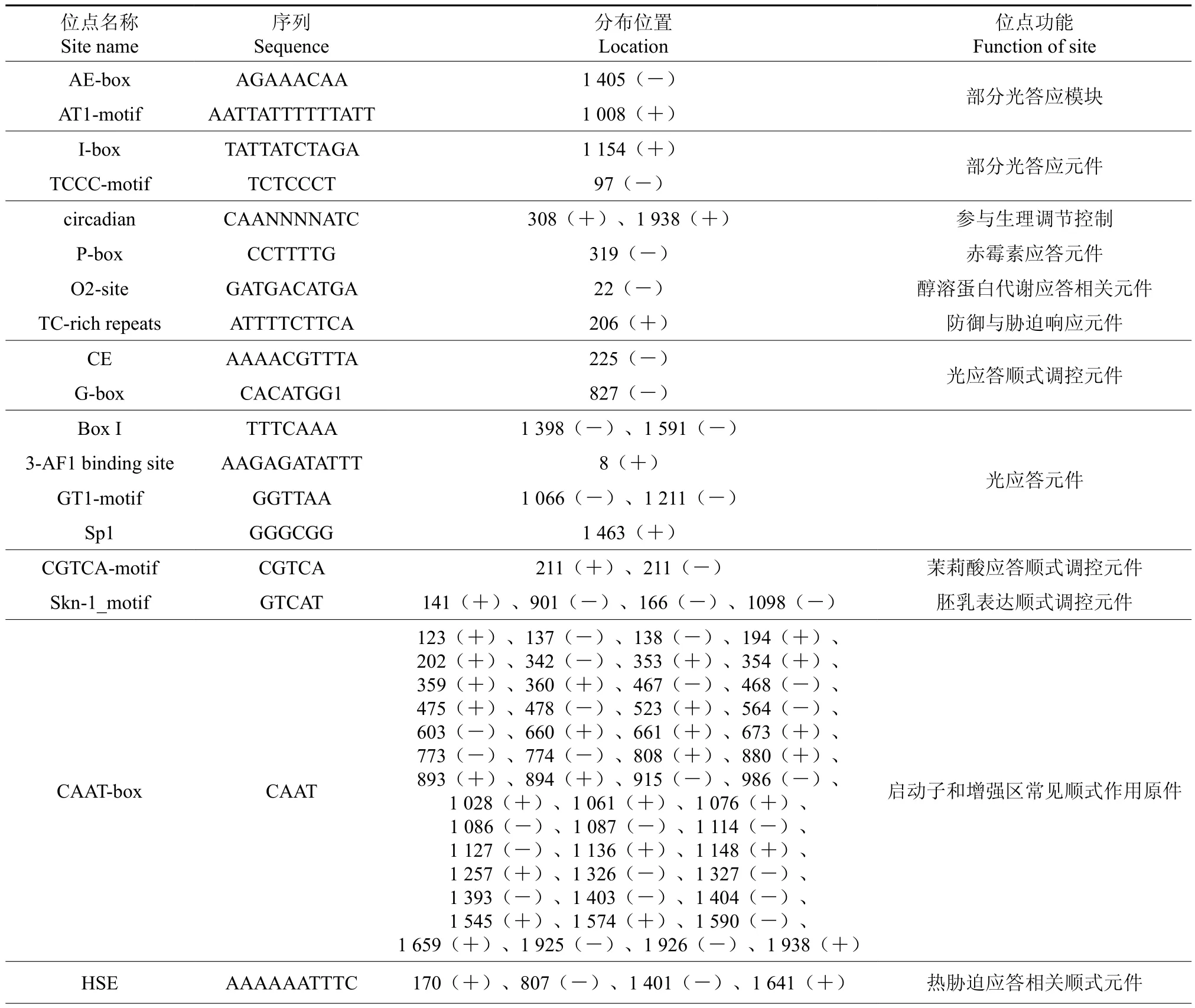
表4 EuHMGS4基因启动子区顺式元件作用预测Table 4 Function prediction on the cis-elements of promoter in EuHMGS4

续表1Table 1 Continuation
3 结论与讨论
杜仲羟甲基戊二酰辅酶A 合酶基因(EuHMGS)是甲羟戊酸途径(MVA)中的第1个催化酶,催化乙酰乙酰CoA 生成羟甲基戊二酰CoA,对于杜仲胶-多萜类的生物合成起着十分重要的作用[18]。序列上高度保守且功能相似的基因被称为是同一个基因家族,生理功能的实现一般是通过一个家族的功能来实现,而不是单独的1个基因,利用基因组数据,从基因家族的角度分析代谢途径以及基因的功能具有重要的意义[19],根据杜仲HMGS的完整编码框(CDS),在杜仲基因组数据中找到唯一1个HMGS基因,目前认为杜仲HMGS家族就只包含1个基因,而巴西橡胶树(Hevea brasiliensis)HMGS也是一个小的基因家族,包括HMGS1和HMGS2[17]。对EuHMGS基因进行生物信息学分析结果表明,含有HMGS蛋白的典型保守序列GNTDIEGVDSTNACYGGTA;聚类分析显示EuHMGS与双子叶植物遗传距离较近,符合遗传进化规律。EuHMGS基因启动子中含有大量的脱落酸、水杨酸、茉莉酸响应调控元件。用甲基茉莉酸和水杨酸诱导CaHMGS 喜树子叶和胚轴中的表达,结果发现在不同的组织中具有不同的表达调控模式[20],因此,推测EuHMGS基因也可能具有组织特异性表达基因,而且在巴西橡胶树中HMGS基因的mRNA和酶的活性在白天显著高于夜间,推测HMGS可能因含有大量的光调控顺式作用元件,导致HMGS基因的表达受到光变化的调控[21]。
[1] 杜红岩.我国的杜仲胶资源及其开发潜力与产业发展思路[J].经济林研究,2010,28(3):1-6.
[2] 杜红岩,刘昌勇,李 钦,等.杜仲叶中3 种主要活性成分含量的季节变化[J].中南林业科技大学学报,2011,31(8): 6-9.
[3] 杜红岩,刘攀峰,孙志强.我国杜仲产业发展布局探讨[J].经济林研究,2012,30(3):130-144.
[4] 李芳东,杜红岩.杜仲[M].北京:中国中医药出版社,2001:232-256.
[5] 杜兰英,刘攀峰,朱景乐,等.环剥与环割强度对果园化栽培条件下杜仲生长和结果的影响[J].中南林业科技大学学报,2013,33(8):14-18.
[6] 纪奎江.我国橡胶资源与废橡胶循环利用[J].技术交流,2010,(4):21-24.
[7] 杜红岩,胡文臻,俞 锐.杜仲产业绿皮书:中国杜仲橡胶资源与产业发展报告[M].北京:社会科学文献出版社,2013:1-2.
[8] Duilio A,Silvia S,Christoph,et al.Terpenoid Biosynthesis from 1-Deoxy-D-xylulose in Higher Plantd by Intramolecular Skeletal Rearrangement[J] Proc Natl Acad Sci USA,1997,94:10600-10605.
[9] Hartmut K L,Michel R,Jörg S.Two Independent Biochemical Pathways for Isopentenyl Diphosphate and Isoprenoid Biosynthesis in Higher Plants[J].Physiol Plant,1997,101:643-652.
[10] Lynen F,Efferer H,Henning U,et al.Farnesylpyrophosphatund 3-Methyl-Δ3-butenyl-1-pyrophosphat,diebiologischen Vorstufendes Squalens Zur Biosyntheseder Terpene,III [J].Angewandte Chemie,1958,70(24):738-742.
[11] Chaykin S,Law J,Phillips A H,et al.Phosphorylated Intermediates in the Synthesis of Squalene[J].Proc N A S,1958,44 (10):998-1004 .
[12] 韩军丽,李振秋,刘本叶.植物萜类代谢工程[J].生物工程学报,2007,23(4):561-569.
[13] Mann V,Harker M,Pecker I,et al.Metabolic engineering of astaxanthin production in tobaccof lowers [J].Nat Biotechnol,2000,18: 888-892.
[14] 叶生晶,乌云塔娜,田大伦,等.杜仲MVA途径相关基因的鉴定及荧光定量PCR引物筛选[J].中南林业科技大学学报,2013,33(8)51-56.
[15] 李铁柱,杜红岩,刘慧敏,等.杜仲果实和叶片转录组数据组装及基因功能注释[J].中南林业科技大学学报,2012,32(11):122-130.
[16] 李铁柱,杜红岩,刘慧敏,等.杜仲幼果和成熟果实转录组数据组装及基因功能注释[J].中南林业科技大学学报,2012,32(10):9-17.
[17] 叶生晶.杜仲MVA途径相关基因表达差异及全长cDNA序列特征[D].长沙:中南林业科技大学,2012.
[18] T Dairi.Biosynthetic Genes and Enzymes of Isoprenoids Produced by Actinomycetes[C]//Isoprenoid Synthesis in Plants and Microorganisms.New York: Springer-Verlag,2013: 29-49.
[19] 王凤华,刘文锋.拟南芥HMGS家族成员全基因组分析[J].安徽农业科学,2012,40(36):17478-17481.
[20] Pluang S,Nualpun S,Wallie S.Regulation of 3-Hydroxy-3-Methylglutaryl-CoA Synthase and 3-Hydroxy-3-Methylglutaryl-CoA Reductase and Rubber Biosynthesis ofHevea brasiliensis(BHK)Mull Arg[C]//Isoprenoid Synthesis in Plants and Microorganisms.New York: Springer-Verlag,2013: 315-327.
[21] 王 伟.喜树毛状根培养体系的建立及喜欢HMGS基因的克隆分析[D].上海:上海师范大学,2009.

