生草覆盖苹果园不同衰老时期叶片光合生理特性的比较
李芳东,吕德国,秦嗣军,杜国栋,马怀宇,刘国成
(1.沈阳农业大学 园艺学院,辽宁 沈阳 110866;2.沈阳市北方果树栽培与生理生态重点实验室,辽宁 沈阳110866;3.山东省烟台市农业科学研究院,山东 烟台 265500)
衰老是植物生长发育过程中由遗传基因控制的高度有序的生理和生化变化,是植物完成其生命周期的一种防御或适应机制[1],是一种可以调控的退化过程[2]。叶片是植物利用光能合成有机化合物的重要场所,也是植物衰老最敏感的器官之一;衰老是叶片生长发育的最终阶段,主要特征为叶绿素和蛋白质、膜脂和RNA等大分子分解[3]以及营养物质再利用[4]等。研究表明,自然条件下叶片的衰老受生长发育时期、激素、营养物质水平等内在因素以及温度、光照、水分及创伤和病原伤感染等外在因素的相互作用影响[5-6]。此外,叶片衰老与植物种植方式[7]、地面管理方式[8]等密切相关。目前相关研究大多主要集中在烤烟[7]、小麦[8]等1年生经济作物上,关于苹果叶片衰老方面的研究报道较少见。
‘寒富’(‘东光’ב富士’)是由沈阳农业大学1994年育成的抗寒、优质的大苹果品种,将中国大苹果栽植区域的北缘从N40°17′推进到了N42°75′,栽植面积达 7.5×104hm-2,大多栽植区秋季气温下降较快、冬季气温低。因此,增加秋季树体贮藏营养水平对于果树安全越冬及早春开花、坐果、展叶等发育过程至关重要。衰老过程中的光合能力及叶片养分降解向枝条等部位的回流状态,直接影响果树秋季节树体贮藏水平。生草覆盖是改善果园土壤环境和维持土壤肥力的有效方法之一,具有良好的生态效益和经济效益,对于推动我国果树产业可持续发展具有重要的意义[9]。因各产区气候、立地条件差别较大,在草种选择与利用上缺乏规范化技术,推广应用步伐缓慢,仍处于试验和研究阶段;目前的研究主要集中在果园小气候[10]、土壤理化性质[11]、果实品质[12]等对生草覆盖的响应特性以及优势草种的筛选[13]方面,进一步研究生草覆盖条件下不同衰老时期叶片光合生理特性的差异可以为秋季叶片管理提供理论依据。
1 材料与方法
1.1 试验材料
试验于2011年在沈阳农业大学果树试验基地(41°83′ N,123°56′ E;海拔76.2m)进行。试验苹果园于2006年5月定植,品种为‘寒富/GM256/山定子’(Malus domesticaM./GM256/Malus baccata Borkh.),南北行向,株行距为2.0m×4.0m,按照细长纺锤形整形。果园地面管理采用生草覆盖,生草覆盖采用自然生草种,主要包括马唐、稗草、狗牙草、荠菜等;自然生草种在行间3.0m宽的范围内自然繁殖;6月上旬至9月中旬,当草长至40~50cm高时留茬20cm刈割,每年刈割3~5次,并将刈割下的残草覆盖于行内(100cm宽)。
1.2 试验方法
在2011年9月30日~11月9日晴天的08:30~11:00进行叶绿素含量、可溶性蛋白质含量、超氧化物歧化酶(SOD)活性、超氧阴离子(O2-·)含量、丙二醛(MDA)含量、净光合速率(Pn)和叶绿素荧光参数的测定,每10d测定1次。每个处理选取树势中庸、生长一致的植株作为试验用树。
1.2.1 叶绿素含量的测定
每个处理选取5株树,每株树选取树冠外围同一高度5个新梢,每个新梢选取1片功能叶片(第6~8片)用于测量,共测定25个叶片,每次测定相同的叶片。采用LC-01型叶绿素仪(Hansatech Instruments公司,英国)测定叶绿素含量(相对值)。
1.2.2 净光合速率的测定
每个处理3株树,每株树选取树冠外围南侧同一高度3个新梢,每个新梢选取1片功能叶片用于测量,共测定9个叶片,每次测定相同的叶片。采用CIRAS-2便携式光合测定系统(PP Systems公司,美国)测定净光合速率。
1.2.3 叶绿素荧光参数的测定
每个处理选取5株树,每株树选取树冠外围南侧同一高度的3个新梢,每个新梢选取1片功能叶片用于测量,共测定15个叶片,每次测定相同的叶片。叶片经叶夹暗适应30min后进行测量。采用多功能植物效率分析仪M-PEA(Hansatech Instruments公司,英国)测定叶片的叶绿素荧光参数,参照Strasser等[17]的方法命名和计算参数(见表1);参照邱念伟等[18]的方法对Sm、N、Mo、ψo、φEo和Fv/Fm进行标准化处理。
1.2.4 其它参数的测定
每个处理选取5株树,每株树选取树冠外围同一高度3个新梢,每个新梢采取1片功能叶片放入冰盒中,迅速带回实验室,液氮速冻后放入-70℃保存;叶片分别从相同的植株上采取。采用考马斯亮蓝G-250染色法测定可溶性蛋白质含量,采用硫代巴比妥酸(TBA)法测定丙二醛(MDA)含量[14];采用氮蓝四唑(NBT)显色法测定SOD活性[15];采用羟胺氧化法测定O2-·含量[16]。

表1 叶绿素荧光诱导动力学曲线参数公式与中文名称Table 1 Formulae and Chinese name of the parameters of chlorophyll fluorescence induction kinetic curve
1.3 数据分析
采 用 SPSS 12.0(SPSS Company,Chicago,IL)对数据进行单因素方差分析(ANOVA),采用Duncan新复极差法检验差异显著性;采用Excel 2003进行数据处理及绘图。
2 结果与分析
2.1 叶绿素和可溶性蛋白质含量的比较
叶绿素和蛋白质的降解是叶片衰老的主要标志[19-20]。不同衰老时期苹果叶片叶绿素和蛋白质含量的比较见表2。由表2可知,叶片叶绿素含量随衰老程度的加剧呈显著降低趋势,可溶性蛋白质含量在衰老中期、中后期和后期显著降低。衰老中后期叶片叶绿素和可溶性蛋白质含量分别为初期的55.0%和51.8%,后期两者的含量分别为初期的5.5%和35.5%,说明后期叶绿素的降解速率高于可溶性蛋白质。
2.2 SOD活性、O2-·和MDA含量的比较
不同衰老时期苹果叶片SOD活性、O2-·和MDA含量的比较见表3。由表3可知,叶片SOD活性随叶片衰老程度的加剧呈先升高后下降的趋势,O2
-·含量随叶片衰老程度的加剧呈显著递增趋势,MDA含量于衰老中期显著递增。说明衰老初期至中期,SOD活性的升高是对秋季气温降低和叶片衰老的适应性调节;衰老中后期和后期,由于O2
-·等活性氧的积累显著升高并达到较高水平,开始攻击SOD,使其活性显著降低,并导致膜脂过氧化作用不断增强。
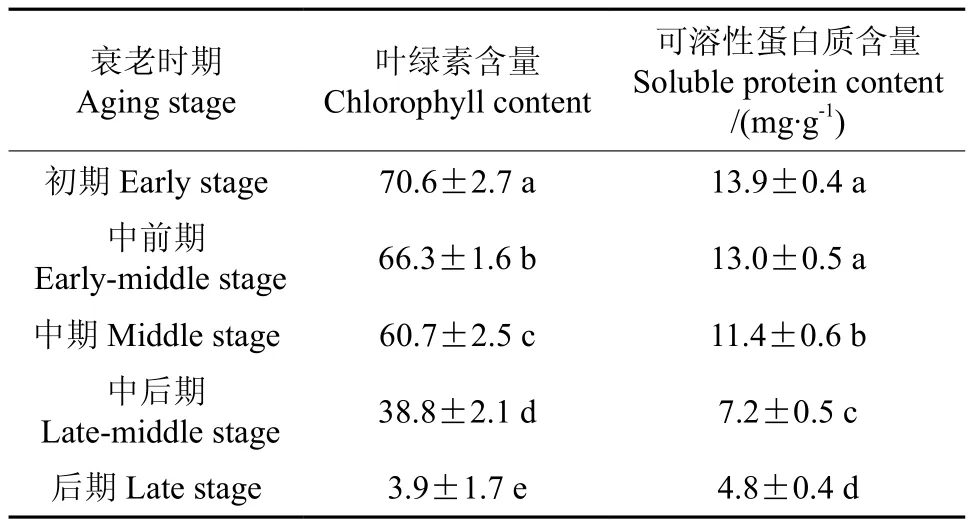
表2 不同衰老时期苹果叶片叶绿素和可溶性蛋白质含量的比较Table 2 Comparison of chlorophyll content and soluble protein content in apple leaves at different aging stages

表3 不同衰老时期苹果叶片SOD活性、O2-·和MDA含量的比较Table 3 Comparison of SOD activity,and contents of O2-·and MDA in apple leaves at different aging stages
2.3 净光合速率和荧光强度的比较
净光合速率反映了叶片作为物质流的源制造和输出同化物的潜在能力。不同衰老时期苹果叶片净光合速率和荧光强度的比较见表4。由表4可知,叶片净光合速率(Pn)随叶片衰老程度加剧呈先升高后降低变化。中前期叶片Pn的显著升高可能是对秋季低温和衰老的应激性调节,随后显著降低,说明叶片制造和输出同化物的能力随衰老程度的加剧明显下降,衰老中期、中后期和后期叶片Pn分别为初期的94.8%、57.7%和2.8%,推测中后期可能是叶片制造和输出同化物的能力衰减的半衰期,后期叶片制造和输出同化物的能力基本丧失。
衰老初期至中期,初始荧光(Fo)和可变荧光Fk占Fj-Fo振幅的比例(Wk)无明显变化、J相相对可变荧光(Vj)显著升高、最大荧光(Fm)逐渐降低,表明PSⅡ受体侧电子传递明显受阻、接受电子的能力逐渐降低。在中后期,Fo和Wk仍无明显变化、Vj变化平稳、Fm较初期显著降低,表明PSⅡ受体侧接受电子的能力明显降低,说明PSⅡ的基本结构和功能受到严重破坏。后期,Fo较初期显著降低、Wk较初期显著升高、Vj较中后期急剧升高(为P相相对可变荧光的81.6%)、Fm较中后期急剧降低(为初期的26.8%),表明PSⅡ受体侧放氧复合体和受体侧受到严重损伤、受体侧接收电子的能力基本丧失,说明PSⅡ基本结构受到严重破坏、功能基本丧失。荧光强度(Fo、Wk、Vj和Fm)的变化进一步证实了中后期为叶片制造和输出同化物的能力衰减的半衰期。
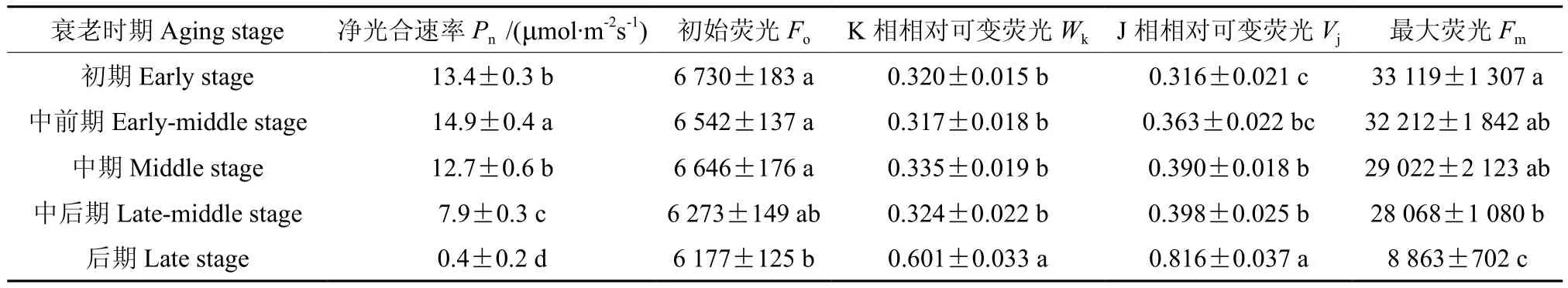
表4 不同衰老时期苹果叶片净光合速率和荧光强度的比较Table 4 Comparison of Pn and fluorescence intensity of apple leaves at different aging stages
2.4 PSⅡ受体侧功能的比较
Sm、N、Mo、ψo、φEo、φPo等参数主要反映了PSⅡ受体侧的变化,PSⅡ受体侧主要包括QA、QB、PQ库等[21],数值标准化处理后可以更直观地比较PSⅡ受体侧参数的变化[18]。不同衰老时期苹果叶片PSⅡ受体侧功能的比较如图1所示。由图1可知,衰老初期至中期,叶片Sm、N和Mo逐渐升高,说明叶片衰老程度逐渐增强;随后Sm显著降低,表明叶片衰老程度越重,QA被还原所需要的能量越少,Mo和N的下降表明叶片衰老程度越重,QA被还原的速率和次数均迅速减少。衰老初期至中后期,Fv/Fm变化平稳,φEo于中前期显著降低并保持较高水平,ψo于中前期和中期显著降低并保持较高水平,表明QA下游的电子传递接受的能量和占总能量的比值随衰老程度的加剧均下降,说明光合机构通过调控Fv/Fm来维持较高水平的ψo和φEo,该阶段细胞仍然维持PSⅡ的功能活性。衰老后期,ψo、φEo和φPo急剧下降,分别为初期的29.7%、11.3%和38.0%,说明PSⅡ的功能基本丧失。

图1 不同衰老时期苹果叶片PSⅡ受体侧功能的比较Fig.1 Comparison of PSⅡ acceptor side function of apple leaves at different aging stages
3 讨 论
活性氧的产生是植物细胞对非生物胁迫和衰老最早的响应之一[20];叶片衰老与活性氧积累呈正相关,而植物体内的抗氧化酶活性反映了植物对活性氧的清除能力[22]。文中结果表明,生草覆盖条件下苹果叶片O2-·和MDA含量随叶片衰老程度的加剧不断升高,SOD活性呈先升高后降低变化,于衰老中期达到最大值(见表3)。衰老初期至中期,SOD活性的升高是对秋季气温降低和叶片衰老的适应性调节,MDA含量逐渐升高,表明仍有过剩的活性氧启动了膜脂过氧化;中后期和后期,由于O2-·等活性氧的积累显著升高并达到较高水平,开始攻击SOD,使其活性显著降低,MDA含量为前期的3.3倍和3.9倍,表明此时活性氧的酶促清除系统严重受损,使膜脂过氧化严重,造成膜系统功能和结构的损伤[22]。
蛋白质降解是植物衰老的第一步,活性氧是启动蛋白质降解的主要因素之一;降解的蛋白质主要是以酶的形式存在的可溶性蛋白质,其中RuBP羧化酶约占可溶性蛋白的50%,在胁迫和衰老过程中RuBP羧化酶会快速、选择性地降解;因此,可溶性蛋白质的降解标志着以RuBP羧化酶为主的各类酶含量不断降低[20,24]。叶绿体是蛋白质降解的主要场所,也是活性氧破坏的主要目标[20]。因此叶绿素降解是衰老的原发过程及衰老的真正标志,叶绿素含量迅速降低是叶片老化最重要的特征[19,25]。Pn则反映了叶片作为物质流的源制造和输出同化物的潜在能力。本试验中,衰老中后期叶片叶绿素、可溶性蛋白质含量和Pn分别为初期的55.0%、51.8%和57.7%,推测衰老中后期可能是叶片光合能力衰减的半衰期。
胁迫对光合电子传递的干扰诱发了活性氧的升高,通过PSⅡ荧光诱导动力学可以更深入分析叶片衰老过程中PSⅡ功能和结构的变化[26]。衰老初期至中期,Vj显著升高、Fm逐渐降低,表明PSⅡ受体侧电子传递明显受阻、接受电子的能力逐渐降低;中后期,Vj变化平稳、Fm较初期显著降低,说明PSⅡ的基本结构和功能受到严重破坏;后期,Fo较初期显著降低、Wk较初期显著升高、Vj较中后期急剧升高、Fm较中后期急剧降低,表明PSⅡ受体侧放氧复合体和受体侧受到严重损伤、受体侧接收电子的能力基本丧失,说明PSⅡ基本结构受到严重破坏、功能基本丧失(见表4)。Fo、Wk、Vj和Fm的变化进一步证实了中后期为叶片制造和输出同化物的能力衰减的半衰期。ψo、φEo和Fv/Fm的变化表明,衰老初期至中后期光合机构通过调控Fv/Fm来维持较高水平的ψo和φEo,该阶段细胞仍然维持可以PSⅡ的功能活性;后期ψo、φEo和Fv/Fm分别为初期的29.7%、11.3%和38.0%,说明PSⅡ的功能基本丧失(图1)。ψo、φEo和φPo的变化表明,中后期为PSⅡ的功能丧失的临界期。因此,秋季采取苹果叶片管理措施应于衰老中期进行。
4 结 论
苹果叶片合成光合产物的能力随叶片的衰老而逐渐降低。在衰老中后期,尽管光合机构通过调控Fv/Fm来维持较高水平的ψo和φEo,PSⅡ的基本结构和功能仍受到严重破坏;后期叶片PSⅡ的基本结构受到严重破坏、功能基本丧失。
[1] Procházková D,Wilhelmová N.Leaf senescence and activities of the antioxidant enzymes [J].Biologia Plantarum,2007,51(3):401-406.
[2] 苏冬梅,杨定海,冯兆云,等.银杏叶片衰老与调节的生理生化变化[J].经济林研究,2001,19(1): 4-6.
[3] Thomas H,Ougham H J,Wagstaff C.Defining senescence and death [J].Journal of Experimental Botany,2003,54(385):1127-1132.
[4] Himelblau E,Amasino R M.Nutrients mobilized from leaves of Arabidopsis thaliana during leaf senescence [J].Journal of Plant Physiology,2001,158(10): 1317-1323.
[5] Hensel L L,Grbic V,Baumgarten D A,et al.Developmental and age-related processes that in fl uence the longevity and senescence of photosynthetic tissues in Arabidopsis [J].The Plant Cell,1993,5(5): 553-564.
[6] LEE R H,WANG C H,HUANG L T,et al.Leaf senescence in rice plants: cloning and characterization of senescence upregulated genes[J].Journal of Experimental Botany,2001,52(358): 1117-1121.
[7] 杨铁钊,杨志晓,柯油松,等.不同种植模式对烤烟根系和叶片衰老特性的影响[J].应用生态学报,2009,20(12):2977-2982.
[8] 鱼 欢,冯佰利,张 英,等.不同栽培模式下冬小麦叶片衰老与活性氧代谢研究[J].作物学报,2007,33(10):1729-1732.
[9] 吕德国,秦嗣军,杜国栋,等.果园生草的生理生态效应研究与应用[J].沈阳农业大学学报,2012,43(2):131-136.
[10] 孟 林,俞立恒,毛培春,等.苹果园间种鸭茅和白三叶对园区小环境的影响[J].草业科学,2009,26(8):132-136.
[11] 李会科,张广军,赵政阳,等.渭北黄土高原旱地果园生草对土壤物理性质的影响[J].中国农业科学,2008,41(7):2070-2076.
[12] 李国怀,伊华林.生草栽培对柑橘园土壤水分与有效养分及果实产量、品质的影响[J].中国生态农业学报,2005,13(2):161-163.
[13] 邱昌朋,王 忆,张新忠,等.北京郊区苹果园生草栽培适宜草种的筛选与评价[J].中国果树,2012,(2):18-22.
[14] 李合生.现代植物生理学[M].北京:高等教育出版社,2002:85-111.
[15] Parida A K,Jha P B.Antioxidative defense potential to salinity in the euhalophyte Salicornia brachiata[J].Journal of Plant Growth Regulation,2010,29(2): 137-148.
[16] 孔祥生,易现峰.植物生理实验技术[M].北京:中国农业出版社,2008,126-260.
[17] Strasser R J,Tsimilli-Michael M,Srivastava A.Analysis of the chlorophyll a fluorescence transient [C]// Papageorgiou G,Govindjee.Chlorophyll Fluorescence: A Signature of Photosynthesis.Netherlands: Kluwer Academic Publishers,2004:321-362.
[18] 邱念伟,周摇峰,顾祝军,等.5种松属树种光合功能及叶绿素快相荧光动力学特征比较[J].应用生态学报,2012,23(5):1181-1187.
[19] Buchanan-Wollaston V.The molecular biology of leaf senescence[J].Journal Experiment Botany,1997,48(307):181-199.
[20] Khanna-Chopra R.Leaf senescence and abiotic stresses share reactive oxygen species-mediated chloroplast degradation[J].Protoplasma,2012,249(3): 469-481.
[21] 李鹏民,高辉远,Strasser R J.快速叶绿素荧光诱导动力学分析在光合作用研究中的应用[J].植物生理学与分子生物学,2005,31(6): 559-566.
[22] 刘群龙,王 朵,吴国良,等.硒对酥梨叶片衰老及抗氧化酶系统的影响[J].园艺学报,2011,38(11): 2059-2066.
[23] 尚庆茂,陈淑芳,张志刚.硒对高温胁迫下辣椒叶片抗氧化酶活性的调节作用[J].园艺学报,2005,32 (1): 35-38.
[24] Wang Hong,Gu Min,Cui Jin-xia,et al.Effects of light quality on CO2assimilation,chlorophyll-fl uoescence quenching,expression of Calvin cycle genes and carbohydrate accumulation inCucumis sativus[J],Journal of Photochemistry and Photobiology B:Biology,2009,96(1): 30-37.
[25] Zheng Shao-qing,Ceng Guang-wen.Senescence of plant leaf and the molecular approach for its delaying[J].Acta Phytophysiologica Sinica,1999,35(2): 152-157.
[26] Diaz-Vivancos P,Clemente-Moreno M J,Rubio M,et al.Alteration in the chloroplastic metabolism leads to ROS accumulation in pea plants in response to plum pox virus[J].Journal of Experimental Botany,2008,59(8): 2147-2160.

