罗非鱼肉蛋白酶解液的制备及体内外抗氧化活性研究
王 强,李贵节,赵 欣,任彦荣
(重庆第二师范学院生物与化学工程系,重庆 400067)
罗非鱼肉蛋白酶解液的制备及体内外抗氧化活性研究
王 强,李贵节,赵 欣,任彦荣
(重庆第二师范学院生物与化学工程系,重庆 400067)
采用木瓜蛋白酶酶解罗非鱼肉蛋白,通过测定不同剂量罗非鱼肉蛋白酶解液的还原力,1,1-二苯基-2-三硝基苯肼(1,1-diphenyl-2-picrylhydrazyl radical 2,2-diphenyl-1-(2,4,6-trinitrophenyl)hydrazyl,DPPH)自由基、·OH和O2-·清除率及对D-半乳糖致衰老模型小鼠的抗氧化作用,评价罗非鱼肉蛋白酶解液的体内外抗氧化特性。结果表明:罗非鱼肉蛋白酶解液具有较高的还原力,清除DPPH自由基、·OH和O2-·的半数有效质量浓度分别为1.57、1.68 mg/mL和2.76 mg/mL;罗非鱼肉蛋白酶解液能显著提高小鼠血清和肝脏组织中超氧化物歧化酶活力、谷胱甘肽过氧化物酶活力和总抗氧化能力(P<0.05),同时使血清和肝脏组织中的丙二醛含量显著降低(P<0.05)。罗非鱼肉蛋白酶解液有较强的体内外抗氧化活性。
罗非鱼肉;酶解液;体外抗氧化活性;D-半乳糖衰老模型小鼠
在生物氧化代谢过程中,会不断产生各种自由基,而自由基过多与体内多种功能性障碍和疾病发生有关,是引起机体衰老根本原因,也是诱发肿瘤、癌症等恶性疾病的重要原因[1]。研究发现,抗氧化活性肽通过减少自由基,阻断脂质氧化的链式反应,从而达到抗氧化、延缓衰老的作用[2-3]。其中动物源抗氧化肽如沙丁鱼抗氧化肽[4]、鸡胸抗氧化肽[5]、紫贻贝抗氧化肽[6]、鹿肉抗氧化肽[7]等,在体外有较强的抗氧化活性,有的在体内也有抗氧化的效果。蛋白质酶解液是生物活性肽的主要来源,这些生物活性肽具有抗氧化、免疫调节、降血糖和降血压等作用[1,8-9]。
罗非鱼(Oreochromis niloticus)又称非洲鲫鱼,属鲈形目、鲡鱼科,具有生长快、肉质好、产量高等特点。我国是世界上最大的罗非鱼生产国,年产量约占世界年产总量的一半[10]。罗非鱼肉蛋白酶解液中含有较丰富的多肽和氨基酸,尽管近年来已有罗非鱼酶解液抗氧化特性的相关报道[11-12],但仅限于研究体外,1,1-二苯基-2-三硝基苯肼(1,1-diphenyl-2-picrylhydrazyl radical 2,2-diphenyl-1-(2,4,6-trinitrophenyl)hydrazyl,DPPH)自由基、·OH等自由基的抗氧化性未见有关其在体内抗氧化特性的报道。为此,本研究采用木瓜蛋白酶,制备罗非鱼肉蛋白酶解液,研究罗非鱼肉蛋白酶解液在体内外的抗氧化特性,以期为罗非鱼肉蛋白酶解液的利用提供参考。
1 材料与方法
1.1 材料、动物、试剂与仪器
罗非鱼购于附近农贸市场,取罗非鱼肉,绞碎,放置于聚乙烯袋内于-18 ℃冻藏备用。
昆明种小鼠50只,雌雄各半,SPF级,体质量18~22 g,购自重庆第三军医大学。
木瓜蛋白酶、D P P H、D-半乳糖 美国Sigma-Aldrich公司;超氧化物歧化酶(superoxide dismutase,SOD)试剂盒、谷胱甘肽过氧化物酶(glutathione peroxidase,GSH-Px)试剂盒、丙二醛(malondialdehyde,MDA)试剂盒、总抗氧化能力(total antioxidative capacity,T-AOC)试剂盒 南京建成生物工程研究所;其他试剂均为国产分析纯;所用水为双蒸水,所用其他溶液均自行配制。
DK-8D三孔电热恒温水槽 上海齐欣科学仪器有限公司;FA2004A型分析天平 上海精天科贸有限公司;UV-2450紫外-可见分光光度计 日本岛津公司;TGL-16G高速台式离心机 上海安亭科学仪器厂。
1.2 方法
1.2.1 罗非鱼肉蛋白酶解液的制备
根据预实验,将罗非鱼肉50 g与蒸馏水100 mL混合匀浆,按质量比1.5∶1 000加入木瓜蛋白酶,在52 ℃、pH 6.5条件下酶解6 h,置沸水中灭酶15 min,冷后于4 ℃、4 000 r/min离心20 min,取上清液进行抽滤,滤液即为实验所用的酶解液。
1.2.2 体外抗氧化活性的测定
1.2.2.1 还原力的测定
参照文献[13]的方法,在具塞比色管中加入0.2mol/L、pH 6.6的磷酸缓冲液2 mL、不同质量浓度的样品溶液(0.5、1.0、1.5、2.0、2.5 mg/mL)0.2 mL和质量分数为1%的铁氰化钾溶液2 mL,50 ℃水浴反应20 min后迅速冷却,加入质量分数为10%的三氯乙酸溶液2 mL,3 000 r/min离心20 min,取上清液2 mL,加入2 mL蒸馏水和质量分数为0.1%的三氯化铁0.4 mL,混匀后室温放置10 min,测定A700nm。
1.2.2.2 清除DPPH自由基的测定
参照文献[14]进行,将DPPH溶液2 mL(10–4mol/L, 95%乙醇)与不同质量浓度(0.5、1.0、2.0、3.0、4.0、5.0 mg/mL)的样品溶液2 mL混匀后于波长517 nm处测定吸光度(Ai),同时,将DPPH溶液2 mL与样品空白2 mL混匀后测定吸光度(Ac),将不同浓度的样品溶液2 mL与95%乙醇2 mL混匀后测定吸光度(Aj),按式(1)计算DPPH自由基清除率。
1.2.2.3 清除·OH的测定
参照文献[15]方法并略有修改。取0.6 mL 5 mmol/L邻二氮菲的乙醇溶液,加入0.4 mL的磷酸盐缓冲液(0.15mol/L,pH 7.40)和0.6 mL 0.75 mmol/L的FeSO4溶液,加入待测酶解液2 mL混匀后,加入0.4 mL 0.1%的H2O2摇匀,37 ℃条件下水浴60 min,在536 nm波长处测其吸光度(Ai);以去离子水代替酶解液和H2O2溶液重复上述操作,在536 nm波长处测其吸光度(Ac);以去离子水代替酶解液来重复以上操作,在536 nm波长处测得吸光度(Aj)。按式(2)计算·OH清除率。
1.2.2.4 清除O2–·的测定
参照文献[16],取酶解液0.1 mL,加入0.1mol/L Tris-HCl(pH8.2)缓冲溶液2.8 mL混匀,在25 ℃水浴10 min后加入3 mmol/L的邻苯三酚溶液(25 ℃水浴预热)0.1 mL,混匀后迅速在320 nm波长处测定吸光度,每隔30 s读取A320nm,5 min后结束;以去离子水0.1 mL和0.1 mol/L的Tris-HC1(pH 8.2)缓冲溶液2.8 mL调零;空白对照管以去离子水代替酶解液。作吸光度随时间变化的回归方程,其斜率为邻苯三酚自氧化速率v,按式(3)计算O2-·清除率。
1.2.3 体内抗氧化活性的测定
1.2.3.1 实验动物条件和分组
实验小鼠饲养条件为:温度18~22 ℃、相对湿度45%~55%,自然光照,自由采食和饮水。实验前将50只小鼠在实验环境下给予基础饲料饲养7 d,按体质量随机分成5组(雌雄各半分笼饲养),分别是正常对照组、模型对照组、罗非鱼肉蛋白酶解液低、中、高剂量组。除正常对照组外,其余4组腹腔注射500 mg/(kg·d)D-半乳糖,同时罗非鱼肉蛋白酶解液低、中、高剂量组按125、250、500 mg/(kg·d)的剂量灌胃罗非鱼肉蛋白酶解液,正常对照组注射等体积生理盐水,灌胃等体积的蒸馏水,实验持续42 d。
1.2.3.2 样品的制备和抗氧化活性的测定
实验小鼠末次灌胃后,禁食l2 h,断头取血致死,收集血液,4 000 r/min离心10 min,上清液备用。解剖小鼠,取出肝脏,称取0.1 g肝脏,加入9倍体积的生理盐水于匀浆器中制成组织匀浆液,4 000 r/min离心10 min,取上清液备用。所有处理均在4 ℃条件下完成。
样品的SOD活力、GSH-Px活力、MDA含量和T-AOC采用南京建成生物工程研究所生产的试剂盒进行测定;蛋白质含量测定采用考马斯亮蓝法。
1.2.4 数据统计分析
2 结果与分析
2.1 体外抗氧化活性分析
研究发现,物质的还原能力与它潜在的抗氧化活性密切相关。抗氧化物质能够提供电子把铁氰化钾中Fe3+还原成Fe2+,Fe2+在700 nm波长处有最大的吸光度[17],吸光度值越大说明样品还原能力越强。由图1可知,在实验质量浓度(0.5~2.5 mg/ mL)范围内,还原力(Y)与罗非鱼肉蛋白酶解液质量浓度(x,mg/mL)呈线性关系,回归方程为Y = 0.016 6-0.190 8x(R2=0.993 8)。
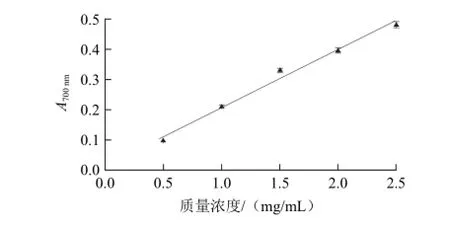
图1 罗非鱼肉蛋白酶解液的还原力Fig.1 Reducing power of tilapia protein hydrolysate
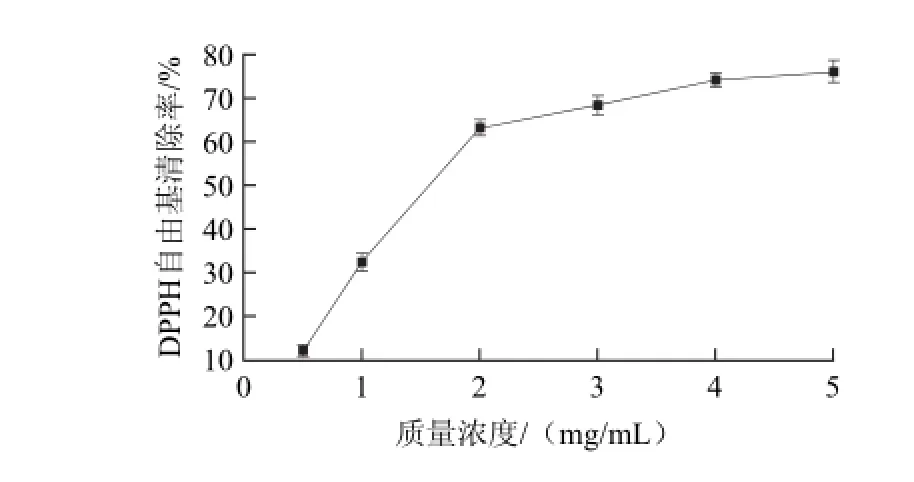
图2 罗非鱼肉蛋白酶解液清除DPPH自由基的能力Fig.2 DPPH radical scavenging activity of tilapia protein hydrolysate
自由基与机体的许多功能障碍和疾病的发生密切相关[1,14]。体内过多的活性氧能与氨基酸、蛋白质和DNA等生物分子发生反应,造成身体疾病[18]。抗氧化剂能与自由基发生反应,生成稳定的物质。因此,探讨罗非鱼肉蛋白酶解液对DPPH自由基、·OH和O2-·的清除作用具有重要意义。如图2所示,罗非鱼肉蛋白酶解液对DPPH自由基的清除率随着罗非鱼肉蛋白酶解液质量浓度的增加而逐渐增大,清除率在12.4%~76.2%,两者呈正相关;罗非鱼肉蛋白酶解液质量浓度在0.5~2 mg/mL时,两者线性关系良好;当质量浓度大于2 mg/mL时,DPPH自由基清除效果变化不明显。罗非鱼肉蛋白酶解液对·OH清除率的变化趋势与其清除DPPH自由基相似(图3),其清除DPPH自由基和·OH的半数有效质量浓度(EC50)分别为1.57、1.68 mg/mL。如图4所示,罗非鱼肉蛋白酶解液清除O2–·的能力较弱,EC50仅为2.76 mg/mL。

图3 罗非鱼肉蛋白酶解液清除·OH的能力Fig.3 Hydroxyl radical scavenging activity of tilapia protein hydrolysate
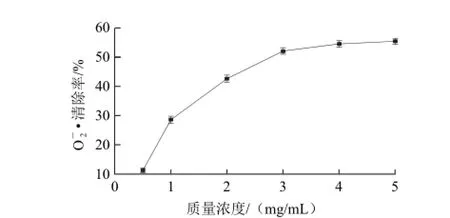
图4 罗非鱼肉蛋白酶解液清除的能力Fig.4 Superoxide anion radical scavenging activity of tilapia protein hydrolysate
2.2 体内抗氧化活性分析
D-半乳糖衰老模型被广泛用于衰老机理研究和抗氧化剂、延缓衰老药物的药效学评价[5]。自由基导致脂质过氧化而产生MDA,SOD活力、GSH-Px活力和T-AOC是体内生物防护体系中最重要的抗氧化指标,可清除体内的自由基。由表1、图5、6可知,正常对照组血清、肝脏组织中SOD活力、T-AOC均显著高于模型对照组(P<0.05)。高剂量组血清和肝脏组织中SOD活力、GSH-Px活力和T-AOC不仅显著高于其相对应的模型对照组,而且显著高于其相对应的正常对照组(P<0.05)。GSH-Px对和机体组织产生的·OH及H2O2有较强的清除能力,可减轻脂质由于过氧化对机体组织的造成的损伤,由此推断,高剂量罗非鱼蛋白酶解液在预防衰老方面有重要的作用。

表1 罗非鱼肉蛋白酶解液对小鼠血清SOD、GSH-Px活力、T-AOOCC和MDA含量的影响(x±s,n=10)Table 1 Effect of tilapia protein hydrolysate on SOD and GSH-Px activities, MDA level and T-AOC in mouse serum(x ±s,, n = 10)
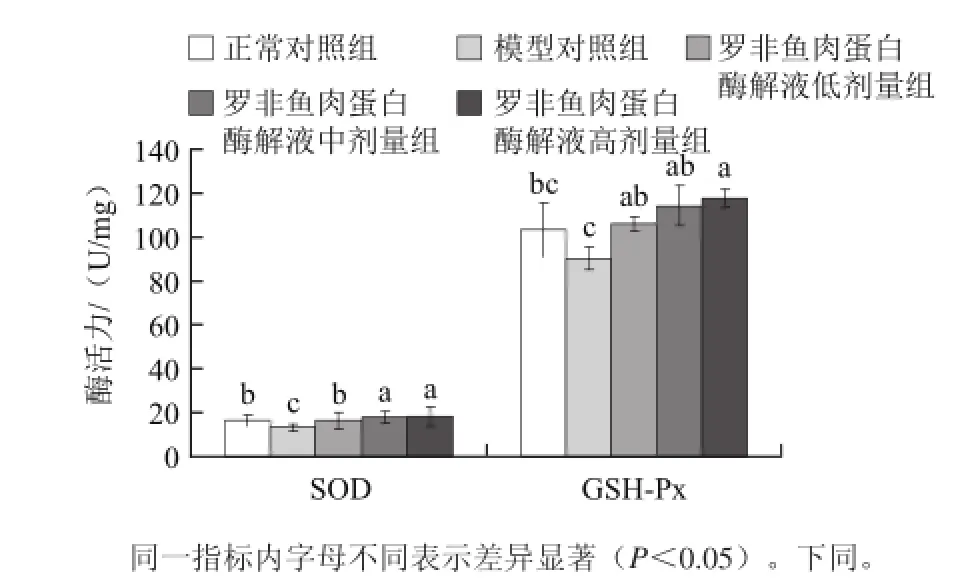
图5 罗非鱼肉蛋白酶解液对小鼠肝脏SOD、GSH-Px活力的影响(x±s,n=10)Fig.5 Effect of tilapia protein hydrolysate on the activities of SOD and GSH-Px in mouse liver (x ±s, n = 10)

图6 罗非鱼肉蛋白酶解液对小鼠肝脏T-AOC的影响Fig.6 Effect of tilapia protein hydrolysate on T-AOC in mouse liver
体内过量自由基会侵害细胞膜中不饱和脂肪酸,形成过氧化脂质。脂质过氧化物的降解产物MDA可与氨基酸和蛋白质等反应形成脂褐素,使得蛋白质破坏变性蓄积于胞浆,最终使细胞发生变形坏死[19]。MDA含量的检测可以反映细胞脂质过氧化的程度。从表1和图7可以看出,对照组血清和肝脏组织中的MDA含量显著低于模型对照组。3个剂量组的小鼠血清和肝脏组织中MDA含量均低于模型对照组,低、中、高剂量血清中MDA含量分别降低了18.9%、34.7%、35.5%,低、中、高剂量组肝脏组织中MDA含量分别较模型对照组降低了32.6%、35.4%、42.0%。说明罗非鱼肉蛋白酶解液具有抗氧化活性,并且呈一定的量效关系。
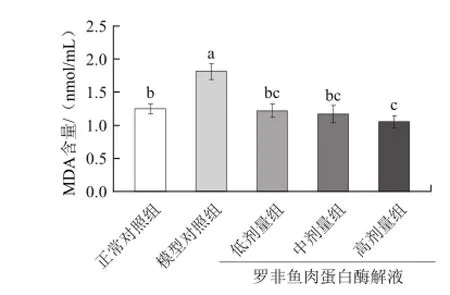
图7 罗非鱼肉蛋白酶解液对小鼠肝脏MDA含量的影响Fig.7 Effect of tilapia protein hydrolysate on MDA level in mouse liver
2.3 肝脏组织及血清中T-AOC/MDA比值
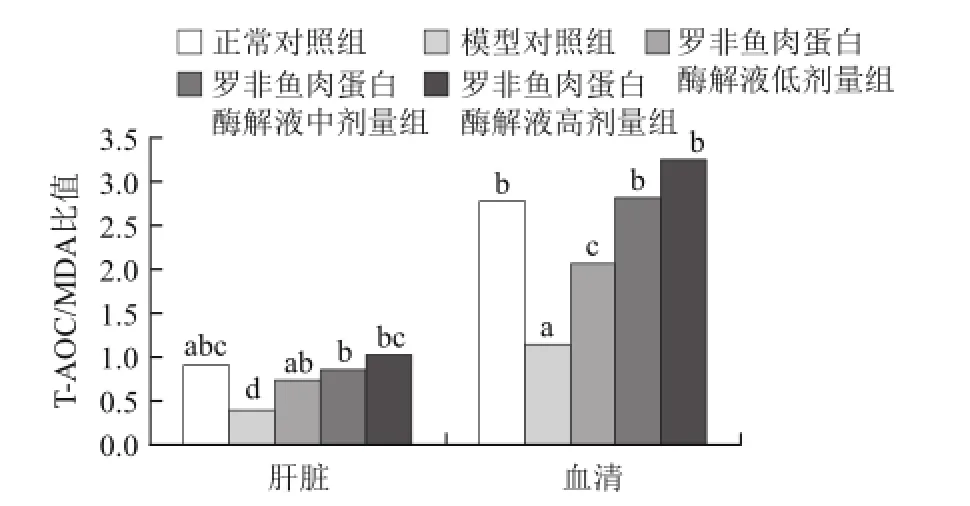
图8 小鼠肝脏组织及血清中T-AOC/MDA比值Fig.8 T-AOC/MDA ratios in mouse serum and liver
T-AOC/MDA比值能够较好的反映体内抗氧化/氧化平衡状态[20]。由图8可知,肝脏和血清中高剂量组中T-AOC/ MDA比值均显著高于低剂量组和模型对照组。其中,血清中高剂量组T-AOC/MDA比值约为模型对照组的300%,高剂量组明显优于低剂量组(P<0.05),这对稳定、持续地保持体内抗氧化作用将起到积极的促进作用。
3 结 论
罗非鱼肉蛋白酶解液具有较高的还原力和自由基清除能力,可以显著提高D-半乳糖衰老模型小鼠血清和肝脏组织中的SOD、GSH-Px活力和T-AOC,降低血清及肝脏组织MDA含量,高剂量罗非鱼肉蛋白酶解液对小鼠体内抗氧化/氧化平衡状态有明显的稳定作用。因此罗非鱼肉蛋白酶解液的整体抗氧化性能较好,有必要研究将其开发成天然抗氧化剂或自由基清除剂。
参考文献:
[1] SAMARANAYAKA A G P, LI-CHAN E C Y. Food-derived peptidic antioxidants: a review of their production, assessment, and potential applications[J]. Journal of Functional Foods, 2011, 3: 229-254.
[2] CHALAMAIAH M, DINESH KUMAR B, HEMALATHA R, et al. Fish protein hydrolysates: proximate composition, amino acid composition, antioxidant activities and applications: a review[J]. Food Chemistry, 2012, 135: 3020-3038.
[3] NAJAFIAN L, BABJI A S. A review of fish-derived antioxidant and antimicrobial peptides: their production, assessment, and applications[J]. Peptides, 2012, 33: 178-185.
[4] BOUGATEF A, NEDJAR-ARROUME N, MANNI L, et al. Purification and identification of novel antioxidant peptides from enzymatic hydrolysates of sardinelle (Sardinella aurita) by-products proteins[J]. Food Chemistry, 2010, 118: 559-565.
[5] SUN Yangying, PAN Daodong. Puri cation of chicken breast protein hydrolysate and analysis of its antioxidant activity[J]. Food and Chemical Toxicology, 2012, 50: 3397-3404.
[6] WANG Bin, LI Li, CHI Changfeng, et al. Purification and characterisation of a novel antioxidant peptide derived from blue mussel (Mytilus edulis) protein hydrolysate[J]. Food Chemistry, 2013, 138: 1713-1719.
[7] KIM E K, LEE S J, JEON B T, et al. Purification and characterisation of antioxidative peptides from enzymatic hydrolysates of venison protein[J]. Food Chemistry, 2009, 114: 1365-1370.
[8] 王莹, 徐秀林, 朱乃硕. 生物活性肽降血糖功能的研究进展[J]. 食品科学, 2012, 33(9): 341-344.
[9] 王春艳, 田金强, 王强. 改善心血管健康的食源性生物活性肽构效关系研究进展[J]. 食品科学, 2010, 31(1): 307-311.
[10] 曾绍东, 吴建中. 罗非鱼酶解液中挥发性成分分析[J]. 食品科学, 2010, 31(18): 342-346.
[11] 陈胜军, 李来好, 曾名勇. 罗非鱼鱼皮胶原蛋白降血压酶解液的制备与活性研究[J]. 食品科学, 2005, 26(8): 229-233.
[12] 马赛蕊, 胡晓, 吴燕燕, 等. 罗非鱼肉蛋白酶解液的抗氧化活性[J].食品科学, 2012, 33(19): 198-202.
[13] WU H C, CHEN H M, SHIAU C Y. Free amino acids and peptides as related to antioxidant properties in protein hydrolysates of mackerel (Scomber austriasicus)[J]. Food Research International, 2003, 36: 949-957.
[14] LIU L, SUN Y, LAURA T, et al. Determination of polyphenolic content and antioxidant activity of kudingcha made from Ilex kudingcha C.J. Tseng[J]. Food Chemistry, 2009, 112: 35-41.
[15] WANG Hongyuan, JIANG Xiaolu, MU Haijin, et al. Structure and protective effect of exopolysaccharide from P. agglomerans strain KFS-9 against UV radiation[J]. Microbiological Research, 2007, 162: 124-129.
[16] ZHANG Tao, JIANG Bo, MIAO Ming, et al. Combined effects of high-pressure and enzymatic treatments on the hydrolysis of chickpea protein isolates and antioxidant activity of the hydrolysates[J]. Food Chemistry, 2012, 135: 904-912.
[17] XU Jing, LIU Wei, YAO Wenbing, et al. Carboxymethylation of a polysaccharide extracted from Ganoderma lucidum enhances its antioxidant activities in vitro[J]. Carbohydrate Polymer, 2009, 78: 227-234.
[18] CACCIUTTOLOA M A, TRINHA L, LUMPKINA J A, et al. Hyperoxia induces DNA damage in mammalian cells[J]. Free Radical Biology and Medicine, 1993, 14(3): 267-276.
[19] DURYEE M J, KLASSEN L W, SCHAFFERT C S, et al. Malondialdehyde-acetaldehyde adduct is the dominant epitope after MDA modification of proteins in atherosclerosis[J]. Free Radical Biology and Medicine, 2010, 49(10): 1480-1486.
[20] LUO Yangchao, CHEN Gang, LI Bo, et al. Evaluation of antioxidative and hypolipidemic properties of a novel functional diet formulation of Auricularia auricula and hawthorn[J]. Innovative Food Science & Emerging Technologies, 2009, 10(2): 215-221.
Preparation of Tilapia (Oreochromis niloticus) Protein Hydrolysate and Analysis of Its Antioxidant Activity in vitro and in vivo
WANG Qiang, LI Gui-jie, ZHAO Xin, REN Yan-rong
(Department of Biological and Chemical Engineering, Chongqing University of Education, Chongqing 400067, China)
Tilapia (Oreochromis niloticus) protein hydrolysate was prepared with papain. Its antioxidant activities at different doses were evaluated in vitro and in vivo using reducing power, 1,1-diphenyl-2-picrylhydrazyl radical 2,2-diphenyl-1-(2,4,6-trinitrophenyl)hydrazyl (DPPH), hydroxyl and superoxide anion radical scavenging assays and D-galactose-induced mouse aging model. The reducing power of the hydrolysate was high. The EC50values in the DPPH radical, hydroxyl and superoxide anion radical scavenging assays were 1.57, 1.68 and 2.76 mg/mL, respectively. The hydrolysate could significantly increase the activities of superoxide dismutase (SOD) and glutathione peroxidase (GSH-Px) and total antioxidative capacity (T-AOC) in the serum and liver of aging mice (P < 0.05). Furthermore, the content of malondialdehyde (MDA) in serum and liver displayed a reducing trend (P < 0.05). In conclusion, the tilapia protein hydrolysate has a good antioxidant effect in vitro and vivo as expected.
tilapia; hydrolysate; antioxidant activity in vivo; D-galactose-induced mouse aging model
TS254.1
A
1002-6630(2014)05-0199-05
10.7506/spkx1002-6630-201405039
2013-04-13
重庆市教委科学技术研究项目(KJ121504);重庆高校创新团队建设计划资助项目(KJTD201325)
王强(1982—),男,副教授,硕士,研究方向为油脂化学及抗氧化生物资源生理生化。E-mail:wangqiang8203@163.com

