海水中316不锈钢表面Na2MoO4与羧酸类缓蚀剂的协同作用机理研究
(国家海洋局天津海水淡化与综合利用研究所,天津 300192)
海水中316不锈钢表面Na2MoO4与羧酸类缓蚀剂的协同作用机理研究
王 静 崔振东 尹建华 高丽丽
(国家海洋局天津海水淡化与综合利用研究所,天津 300192)
本文采用电化学阻抗谱测试、极化曲线分析等试验手段对316不锈钢在添加Na2MoO4及羧酸类缓蚀剂海水中的协同作用机理进行了研究。结果表明:Na2MoO4作为一种阳极沉淀膜型缓蚀剂单独作用于316不锈钢表面时,形成一层较基体表面性能更好的保护膜。极化曲线结果表明,Na2MoO4单独作用点蚀击破电位约为580mV,单宁酸单独作用约为600mV,而两者共同作用时使得极化曲线点蚀击破电位正移较多,约为780mV。两者起到了协同增效的作用。
海水 Na2MoO4单宁酸 316不锈钢
0 引言
为了防止金属材料在海水中腐蚀破坏,人们通过投加缓蚀剂的方法抑制腐蚀。随着人们对环境保护的重视,对水处理剂的环保要求也日渐提高,绿色缓蚀剂[1]成为21世纪水处理剂发展的方向。钼酸盐[2-4]作为无机盐缓蚀剂,是一种低毒、稳定性好的绿色缓蚀剂之一。钼酸盐对金属材料的缓蚀作用大多采用的是均匀腐蚀的方法[5-7],而钼酸盐的很多优点主要体现在局部腐蚀的抑制方面[8]。不锈钢在氯浓度较高时(氯化物介质),常常出现局部腐蚀(点蚀)。目前,对于在海水中钼酸盐在不锈钢表面成膜机理的报道较为少见。同时,有机羧酸类缓蚀剂能够吸附在金属表面形成保护膜,防止有害性离子的入侵。
本文选择典型的有机羧酸类缓蚀剂,通过电化学方法对316不锈钢在添加Na2MoO4及羧酸类缓蚀剂海水中的缓蚀行为进行了研究,初步探讨了Na2MoO4与羧酸类缓蚀剂的协同作用机理,为开发新型的海水中316不锈钢绿色缓蚀剂奠定了基础。

表1 海水成分表
1 试验
1.1 试样制备
电化学阻抗谱及极化曲线测试:电极试样所用实验材料为市售3 1 6不锈钢标准试片(50×25×2mm)。从试片上截取适当大小的试块,焊接导线并用环氧树脂涂封,预留有效工作面1×1cm。试样用水砂纸逐次打磨,经200#、600#、1000#、1500#至2000#。
1.2 实验溶液
本文所用溶液为天津塘沽净化海水,成分见表1。
1.3 测试条件
电化学测试仪器为Autolab.VWP31Z型多通道电化学综合测试系统。电化学测试采用三电极体系,工作电极为316不锈钢,铂电极作为辅助,参比电极为饱和甘汞电极。测试前电极在介质中稳定1h,阻抗谱测试在开路电位下进行,测试频率范围为200kHz~10mHz,正弦电位扰动信号幅值±10mV。
2 结果与讨论
2.1 海水中316不锈钢表面Na2MoO4沉淀膜腐蚀反应机理研究
图1示出了Na2MoO4作用下316不锈钢的电化学阻抗谱及极化曲线。Nyquist图呈现单容抗特征,容抗弧半径随着Na2MoO4浓度增加逐渐增大,表明海水中Na2MoO4有助于提高了316钝化状态的稳定性,但当Na2MoO4浓度增加到100mg/L时,容抗弧半径逐渐减小,阻抗值也随之减小。极化曲线图表明Na2MoO4溶度为10mg/L时试样点蚀击破电位Eb明显正移,点蚀击破电位约为580mV,说明316不锈钢表面钝化膜耐受点蚀的能力提升了,而浓度的升高点蚀击破电位反而负移,说明Na2MoO4添加浓度达到10mg/L时,316不锈钢表面即达到了饱和状态。
上述结果表明,Na2MoO4的添加使得316不锈钢表面形成一层保护膜,原因在于MoO42-本身是一种弱的氧化剂,海水中MoO42-与Fe反应,生成Fe2O3、MoO3及难溶的FeMoO4,沉淀附着在不锈钢表面。因此,Na2MoO4应属于阳极沉淀膜型的缓蚀剂。与不锈钢表面原有的氧化膜相比,Na2MoO4形成的保护膜性能更好。
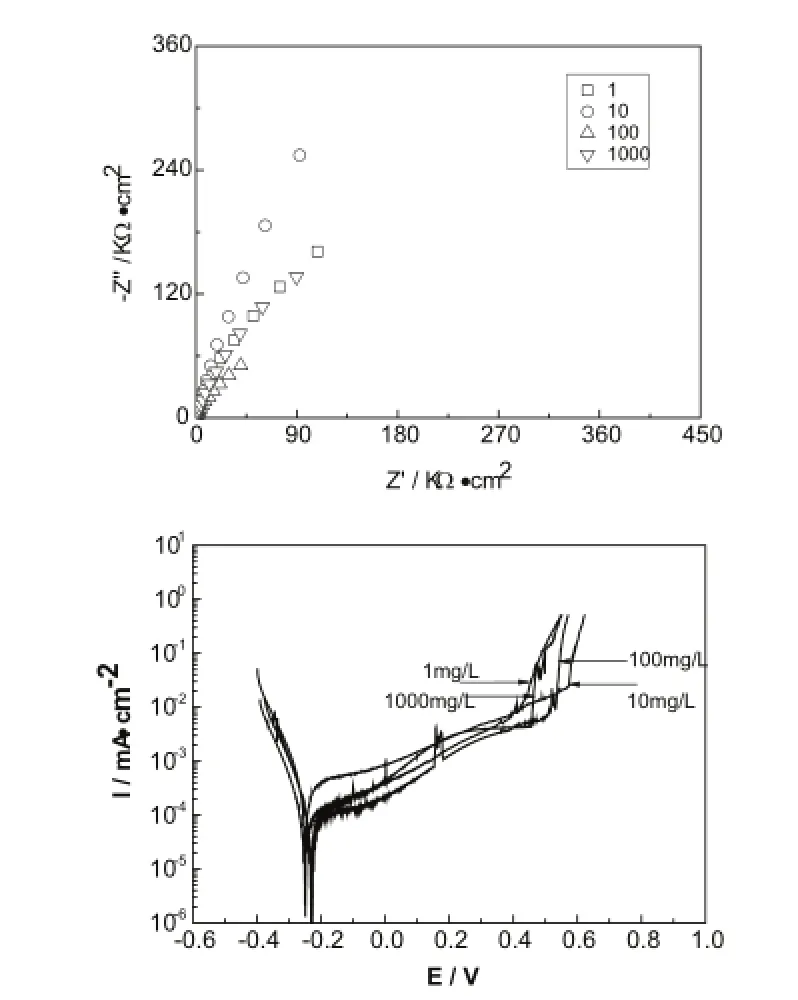
图1 316不锈钢表面钝化膜在添加不同浓度Na2MoO4海水中的阻抗谱及极化曲线图
2.2 海水中有机羧酸类缓蚀剂单剂作用下316不锈钢的耐蚀性研究
图2示出了多种有机羧酸类缓蚀剂单剂作用的电化学阻抗谱及极化曲线。Nyquist图可以看出只有苯丙酸钠单剂作用时容抗弧半径较小,且阻抗值也较小。其他羧酸缓蚀剂单剂作用的容抗弧及阻抗值较空白实验变化不大。苯甲酸钠与PESA单剂作用下的极化曲线点蚀击破电位较空白实验(约为500mV)负移,而单宁酸、柠檬酸钠与葡萄糖酸钠单独作用时击破电位正移,其中单宁酸单独作用的点蚀击破电位Eb值最大,约为600mV。
上述结果表明:苯丙酸钠与PESA单剂作用在海水介质中,并没有增强316不锈钢表面钝化膜的抗腐蚀能力,反而使其较容易发生点蚀。而单宁酸、柠檬酸钠与葡萄糖酸钠这三种羧酸类缓蚀剂单独作用,能够提升316不锈钢表面钝化膜的耐点蚀能力。其中单宁酸添加在海水中,316不锈钢表面钝化膜抗点蚀能力最强。

图2 不同药剂单剂作用下的阻抗谱及极化曲线图
2.3 Na2MoO4沉淀膜与有机羧酸类缓蚀剂在316不锈钢表面协同作用研究
2.3.1 Na2MoO4+ PESA
图3(a)示出了Na2MoO4与PESA同时作用下的电化学阻抗谱,容抗弧半径变化不大,但阻抗值增大,表明Na2MoO4与PESA同时作用能够在316不锈钢金属表面形成较强的保护膜。极化曲线点蚀击破电位Eb与单剂使用相比正移较多,如图3(b)所示。表明Na2MoO4与PESA共同作用能够产生协同增效。因为Na2MoO4的加入能够增强PESA在金属表面的静电吸附能力,使PESA在金属表面形成的保护膜更加致密。
PESA分子式如图4所示。对于海水中316不锈钢点蚀抑制而言,Na2MoO4和PESA共同作用时能够产生协同增效是因为PESA通过静电作用吸附在金属表面,而Na2MoO4则是MoO42-与Fe形成难溶的无机盐沉淀附着在金属表面。Mo的原子序数较大,静电引力强,Mo在316不锈钢表面沉积,可增强试样表面对PESA分子的吸附。Na2MoO4和PESA形成的复合膜层,能够较好的抑制Cl-在不锈钢表面的吸附,从而产生点蚀抑制作用。

图3 Na2MoO4+ PESA共同作用下的阻抗谱及极化曲线

图4 PESA分子式
2.3.2 Na2MoO4+苯甲酸钠
图5(a)示出了Na2MoO4+苯甲酸钠共同作用下的电化学阻抗谱,Nyquist图表示的容抗弧半径变化有所增大,但阻抗值变化不大。表明两种药剂同时作用在316不锈钢表面,金属表面形成的保护膜膜层较弱。极化曲线点蚀击破电位较苯甲酸钠单剂使用正移了约60mV,如图5(b)所示。表明Na2MoO4的加入对苯甲酸钠在金属表面的静电吸附能力增加较少。
苯甲酸钠分子式如图6所示。苯甲酸钠是一种酸性缓蚀剂,其亲油性大,但亲水性较差,其单独作用于海水中时316不锈钢表面钝化膜耐点蚀能力降低。与Na2MoO4共同作用,钼酸钠先于苯甲酸钠沉淀在316不锈钢表面形成保护膜,而此时的苯甲酸钠并没有再次吸附在金属表面,故两者没有形成协同增效的作用。

图5 Na2MoO4+苯甲酸钠共同作用下的阻抗谱及极化曲线
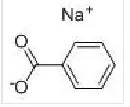
图6 苯甲酸钠的分子式
2.3.3 Na2MoO4+单宁酸
图7(a)示出了Na2MoO4与单宁酸共同作用下的电化学阻抗谱,明显看得出两种药剂同时作用的容抗弧半径较大,说明Na2MoO4与单宁酸共同作用下能够在316不锈钢表面形成较好的保护膜。阳极极化曲线点蚀击破电位较单剂使用时正移较多(约180mV),如图7(b)所示。表明Na2MoO4与单宁酸共同作用产生了较好的协同增效。
单宁酸分子式如图8所示。单宁酸单独作用时316不锈钢表面钝化膜抗点蚀增强较少,而与Na2MoO4共同作用,表面钝化膜保护能力有很大的提高。因为单宁酸本身有多个羧酸团,能够吸附于金属表面,而Na2MoO4的加入使得单宁酸在316金属表面的吸附力更强,在金属表面形成了较致密的保护膜,增加了其抗点蚀能力。

图7 Na2MoO4+单宁酸共同作用下的阻抗谱及极化曲线
2.3.4 Na2MoO4+柠檬酸钠
Na2MoO4与柠檬酸钠共同作用下的电化学阻抗谱如图9(a)所示,两种药剂共同作用时,Nyquist图容抗弧半径变化不大,但阻抗值较柠檬酸钠单独作用时减小。而两者共同作用的极化曲线点蚀击破电位较单剂作用时减少了约210mV,如图9(b)所示,两种药剂同时作用没有产生协同增效,反而互相抑制。
柠檬酸钠的分子式如图10所示。柠檬酸钠单剂作用于海水中时,可以吸附于金属表面,形成一层较弱的钝化膜,而Na2MoO4的加入并没有增强这层保护膜的耐蚀性,反而阻碍了柠檬酸钠在金属表面的吸附行为,使316金属表面形成的保护膜逐渐脱附,316不锈钢耐点蚀能力大幅降低。
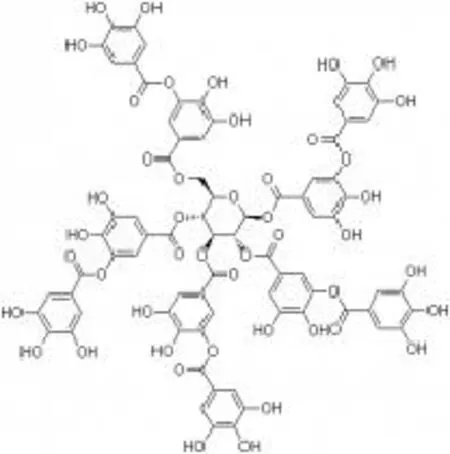
图8 单宁酸分子式

图9 Na2MoO4+柠檬酸钠共同作用下的阻抗谱及极化曲线
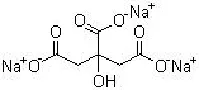
图10 柠檬酸钠分子式
2.3.5 Na2MoO4+葡萄糖酸钠
Na2MoO4与葡萄糖酸钠共同作用的电化学阻抗谱如图11(a)所示,两者的阻抗谱容抗弧半径没有明显变化,阻抗值也十分接近。极化曲线点蚀击破电位较接近,约为580mV,如图11(b)所示。说明,Na2MoO4的加入对于葡萄糖酸钠在316不锈钢表面的吸附作用没有明显的影响。
葡萄糖酸钠的分子式如图12所示。葡萄糖酸钠是一种水质稳定剂,在316不锈钢表面吸附性能较差,Na2MoO4的添加也并没有增强其吸附效果,两者没有产生协同增效作用。
图11 Na2MoO4+葡萄糖酸钠共同作用下的阻抗谱及极化曲线

图12 葡萄糖酸钠分子式
3 结论
(1)Na2MoO4作为一种阳极沉淀膜型缓蚀剂单独作用于316不锈钢表面时,形成一层较基体表明性能更好的保护膜。
(2)比较多种羧酸类缓蚀剂单剂作用,其中单宁酸的添加使得316不锈钢表面钝化膜抗腐蚀能力增强。
(3)Na2MoO4与多种羧酸类缓蚀剂共同作用的极化曲线结果表明,Na2MoO4单独作用点蚀击破电位约为580mV,单宁酸单独作用约为600mV,而两者共同作用时使得极化曲线点蚀击破电位正移较多,约为780mV。两者起到了协同增效的作用。
[1] 邵丽艳等. 绿色海水缓蚀剂的研究进展. 海洋科学, 2005, 29(7): 84-86.
[2] 龚利华,环毅.钼酸盐水处理缓蚀剂复配研究. 给水排水. 2006,32(6):60-62.
[3] M. Saremi,C. Dehghanian,M. Mohammadi Sabet. The effect of molybdate concentration and hydrodynamic effect on mild steel corrosion inhibition in simulated cooling water. Corrosion Science. 2006,48(6).
[4] Celeste Rabacal Alentejano,Idalina Vieira Aoki. Celeste Rabacal Alentejano;Idalina Vieira Aoki. Electrochimica Acta. 2004, 49(17-18).
[5] 龚利华等. 钼酸盐水处理缓蚀剂复配研究. 给水排水. 2006,32(6):60-62.
[6] M. Saremi,C. Dehghanian,M. Mohammadi Sabet. The effect of molybdate concentration and hydrodynamic effect on mild steel corrosion inhibition in simulated cooling water. Corrosion Science. 2006,48(6).
[7] Celeste Rabacal Alentejano,Idalina Vieira Aoki. Celeste Rabacal Alentejano;Idalina Vieira Aoki. Electrochimica Acta. 2004,49(17-18).
[8] 李宇春, 龚洵洁. 钼酸盐系列缓蚀剂在中性介质中的应用研究.热力发电. 2002,31(3):33-35.
Na2MoO4and Carboxylic Acid Corrosion Inhibitor in the Seawater in 316 Stainless Steel Surface of Mechanism of Synergistic Effect Studies
WANG Jing, CUI Zhen-dong, YIN Jian-hua, GAO Li-li
(The Institute of Seawater Desalination and Multipurpose Utilization,SOA(Tianjin), Tianjin 300192, China)
In this paper, using EIS, polarization curve analysis test method of 316 stainless steel in seawater in the addition of Na2MoO4and carboxylic acid corrosion mechanism of synergistic effect of inhibitor were studied. The results show that: Na2MoO4as an anode membrane type inhibitor alone on the surface of 316 stainless steel, forming a layer of a substrate shows better performance of protective film. Polarization curves show that, Na2MoO4alone pitting breaking potentia l is about 580mV, tannic acid alone is about 600mV, and both the polarization curve of pitting potential shifted positivelymore broken, is about 780mV. Both played a synergistic effect.
seawater; Na2MoO4; tannic acid; 316ss
TG174.42
A
10.13726/j.cnki.11-2706/tq.2014.11.053.06
王静 (1981-) ,女,天津人,工程师,硕士,主要研究方向为金属材料腐蚀与控制方向。

