Fenton体系的优化及其对酪蛋白的氧化作用
刘建垒,景 浩*
(中国农业大学食品科学与营养工程学院,北京 10 0083)
Fenton体系的优化及其对酪蛋白的氧化作用
刘建垒,景 浩*
(中国农业大学食品科学与营养工程学院,北京 10 0083)
酪蛋白是乳与乳粉中的主要蛋白组分,在加工和贮藏过程中会发生氧化反应从而影响产品的品质。研究Fenton体系诱导的酪蛋白氧化后化学及结构特性的变化。首先对Fenton体系中Fe2+浓度、抗坏血酸(ascorbic acid,Asc)浓度、H2O2浓度进行了优化,以酪蛋白为靶分子,采用十二烷基硫酸钠-聚丙烯酰胺凝胶电泳研究了Fenton体系主要成分以及体系的温度和时间对酪蛋白氧化程度的影响;并进一步研究了氧化后酪蛋白的溶解性、变性程度、总巯基含量及羰基含量的变化。结果表明:当Fenton体系中Fe2+浓度为0.8 mmol/L,EDTANa2浓度为1 mmol/L,H2O2浓度为10 mmol/L,Asc浓度为0.8 mmol/L,酪蛋白质量浓度为5 mg/mL,37 ℃条件下加热4 h时,酪蛋白氧化程度最明显。随着Fe2+浓度、Asc浓度、H2O2浓度、氧化温度的升高和氧化时间的延长,酪蛋白4 个组分条带的密度均逐渐减小,并在相应的高分子区域出现逐渐致密的新条带;但随着酪蛋白质量浓度的升高,酪蛋白条带的变化减小。酪蛋白氧化后,其溶解度和巯基含量显著降低,变性程度和羰基含量显著升高。综上所述,酪蛋白氧化后发生蛋白交联和氨基酸功能基团变化,导致蛋白的变性程度增大以及溶解度下降。
酪蛋白;Fenton体系;氧化;优化;化学及结构特性
酪蛋白是牛奶蛋白的主要组分,约占乳中蛋白的80%[1]。酪蛋白由αs1-酪蛋白、αs2-酪蛋白、β-酪蛋白、κ-酪蛋白4 个组分组成,在脱脂乳中的含量分别为12~15、3~4、9~11、2~4 g/L[2]。乳中酪蛋白是以胶体粒子的形式存在,直径在50~600 nm(平均直径约为150 nm),又被称为“酪蛋白胶束”(casein micelles)[3]。酪蛋白含有较多的磷酸残基,易与钙离子结合形成胶体磷酸钙,有助于维持酪蛋白胶束的稳定性[4]。酪蛋白在食品工业中应用广泛,添加酪蛋白有助于增加食品的风味,还可以改善产品的乳化性、搅打性、保水性及黏度等特性[4]。其中αs-酪蛋白和β-酪蛋白有助于维持热加工过程中蛋白质的稳定性,并防止蛋白质的聚集、沉淀和凝胶[5],对乳饮料加工具有重要意义。
乳制品在加工及贮藏过程中可发生蛋白氧化,影响产品的品质。目前采用的乳蛋白氧化体系有类Fenton体系(Fe3+-H2O2-Asc)[6]、核黄素诱导的光氧化[7]、紫外线照射[8-9]、乳过氧化物酶体系(lactoperoxidase-H2O2)[10]及多不饱和脂肪酸光氧化体系[11]等。乳蛋白氧化后其颜色加深[9],蛋白溶液混浊度升高,巯基含量减少[6],羰基含量增加[6-7,11],二酪氨酸含量增加[6,10],表面疏水性增大[6]。乳蛋白氧化后,其构象发生变化,容易被胃蛋白酶水解[8];还会发生聚合反应,生成二聚体或多聚体[6-7,9,11]。氧化作用还可以使芳香族氨基 酸生成N-甲酰犬尿氨酸或二酪氨酸[8]。总之,氧化反应不仅使乳蛋白的营养价值下降,还会造成乳蛋白的功能特性及流变学特性发生变化,如乳清蛋白的溶解性降低,蛋白凝胶的硬度及弹性下降,但乳化性和起泡性等表面特性有所改善[12]。
Fenton试剂指的是亚铁盐和过氧化氢的组合,是由英国人Fenton在1894年首先研究报道的,其实质是H2O2在Fe2+的催化作用下生成具有高反应活性的羟自由基(·OH)[13]。之后研究发现其他金属离子,如Fe3+、Cu+、Ti3+、Cr2+、Co2+等,也具有Fenton试剂的氧化特性,被称为类Fenton试剂[14]。加入抗坏血酸能够将Fe3+还原为Fe2+,进而加快Fenton体系产生·OH的速率[15]。以往的研究主要集中在蛋白氧化后结构及功能特性的改变等方面,对Fenton体系主要成分的使用浓度的报道差异较大。目前文献中报道的Fenton体系多为Fe3+-H2O2-Asc体系,但其中各组分使用的浓度不同,Fe3+浓度范围在0.01~0.1 mmol/L间,Asc浓度在0.1~1 mmol/L间,H2O2浓度在0.5~20 mmol/L间,在这些条件下均可以导致乳清蛋白或肌动球蛋白的氧化交联[6,16-17]。也有报道采用Fe2+-H2O2体系,其中采用Fe2+浓度为40、80 μmol/L或2.5 mmol/L,H2O2浓度为0.8、50 mmol/L,它们均可导致色氨酸或牛血清白蛋白的氧化[18-19]。而对Fenton体系(Fe2+-H2O2-Asc)中Fe2+、H2O2、Asc的浓度对酪蛋白氧化的影响未见报道,因此Fenton体系中各组分浓度对酪蛋白氧化的影响研究不但可对蛋白氧化的实验研究提供参考,还对控制蛋白氧化的条件提供理论依据。
本实验首先对Fenton体系中影响酪蛋白氧化的主要因素进行了研究,包括Fenton体系中Fe2+浓度、Asc浓度、H2O2浓度,及体系的作用温度和时间、以及酪蛋白本身的浓度对酪蛋白氧化程度的影响;并进一步研究了氧化后化学及结构特性的变化,包括酪蛋白的溶解性、变性程度、总巯基含量及羰基含量的变化。
1 材料与方法
1.1 材料与试剂
酪蛋白(casein,CN)、5,5’-二硫代双(2-硝基苯甲酸)(5,5’-ddithiobis(2-nitrobenzoic acid),DTNB)美国Sigma公司;牛血清白蛋白(bovine serum albumin,BSA)第Ⅴ组分 美国Amresco公司;2,4-二硝基苯肼(2,4-dinitrophenylhydrazine,DNPH) 国药集团;L-抗坏血酸(L-ascorbic acid,Asc) 西陇化工股份有限公司;蛋白染色液(dye reagent concentrate,DRC)美国Bio-Rad公司;低分子质量标准蛋白Marker(含6 种标准蛋白,分子质量从大到小依次为:兔磷酸化酶B 97.4 ku、牛血清白蛋白66.2 ku、兔肌动蛋白43 ku、牛碳酸酐酶31 ku、人生长激素22 ku、鸡蛋清溶菌酶14.4 ku) 中国科学院上海生命科学研究院;其他试剂均为分析纯。
1.2 仪器与设备
pHS-3C+酸度计 成都世纪方舟科技有限公司;68 0型酶标仪 美国Bio-Rad公司;HY-2A数显调速多用振荡器、HJ-1磁力搅拌器 江苏省金坛市荣华仪器制造有限公司;DYY-8C型电泳仪 北京市六一仪器厂;CU-420型电热恒温水箱 上海一恒科学仪器有限公司;TGL-16B 台式离心机 上海安亭科学仪器厂;UV-1200型紫外-可见分光光度计 上海美谱达仪器有限公司。
1.3 方法
1.3.1 酪蛋白的氧化
参考程恒等[20]的方法,简述如下,用pH 6.0的磷酸盐缓冲溶液(phosphate buffered solution,PBS)(含NaCl、KCl、Na2HPO4、KH2PO4的浓度分别为137、2.7、10、2 mmol/L)配制各储备液,向50 mL离心管中依次加入0.05~0.5 mL 20 mmol/L的FeSO4溶液、0.5 mL 20 mmol/L的EDTANa2溶液、0.05~2 mL 100 mmol/L的 H2O2溶液、0.05~0.5 mL 20 mmol/L的Asc溶液,迅速加入0.8~8 mL 12.5 mg/mL的酪蛋白溶液,加PBS至体积为10 mL,彻底混匀(溶液体系共10 mL,其中酪蛋白质量浓度为1~10 mg/mL,FeSO4为0.1~1.0 mmol/L,EDTANa2为1 mmol/L,H2O2为0.5~20 mmol/L,Asc为0.1~1.0 mmol/L)。将样品迅速均匀分装到2 个15 mL离心管中,分别放入25、37 ℃水浴条件下进行氧化反应。分别在2、4、6 h时取出一组样品并将各溶液放入-20 ℃冰箱中冷冻,待测。同时以未氧化的酪蛋白溶液作空白对照。
1.3.2 十二烷基硫酸钠-聚丙烯酰胺凝胶电泳(sodium dodecyl sulfate-polyacrylamide gel electrophoresis,SDS-PAGE)
参考J i n g H a o等[21]的方法,简述如下,用SDS-PAGE对样品进行检测。依次在凝胶板中加入7 mL的15 g/100 mL分离胶和2 mL的5 g/100 mL浓缩胶,凝胶厚度1.5 mm。将蛋白样品溶液预先标准化为2 mg/mL,取20 øL样品溶液与20 øL上样缓冲液(含2 g/100 mL SDS和2%(V/V)β-巯基乙醇,40%(V/V)甘油,0.02 g/100 mL溴酚蓝的Tris-HCl缓冲溶液,pH 6.8)混匀,80 ℃水浴加热5 min,上样量为10 øL,用DYY-8C型电泳仪进行稳压电泳,起始电压为80 V,当样品进入分离胶与浓缩胶交界处时,将电压调到110 V,当溴酚蓝指示剂跑到距胶底部5 mm时(约1.5 h),停止电泳。剥下胶片后,用0.025 g/100 mL考马斯亮蓝R-250染色液(甲醇、乙酸、水体积比5∶1∶4)染色6 h,用脱色液(甲醇、乙酸、水体积比2∶1∶7)脱色至条带清晰可见,用凝胶成像仪拍照,分析。
非还原SDS-PAGE中上样缓冲液中不加β-巯基乙醇(β-mercaptoethanol,β-ME),其他同上。
1.3.3 蛋白溶解度的测定
参考Daimer等[22]的方法,简述如下,蛋白质溶解度用离心后样品上清液中蛋白质含量与样品总蛋白质含量的之比表示。测定前将样品用含有PBS缓冲溶液稀释至蛋白质含量为5 mg/mL,室温下缓慢搅动1 h,使体系充分平衡。先取部分悬浮液用于测定总蛋白质含量(total protein content,Pt),再将剩余的溶液在10 000×g条件下离心10 min。不溶物沉淀在管底,上清液中蛋白为可溶性蛋白,测定其含量(soluble protein content,Ps)。蛋白质含量用Bradford方法测定。溶解度计算见公式(1)。

1.3.4 蛋白变性程度的测定
参考Daimer等[23]的方法,简述如下,测定前将样品用PBS缓冲溶液稀释至蛋白质含量为5 mg/mL,室温下缓慢搅动1 h,使体系充分平衡。同时,用10 mol/L的HCl和1 mol/L的NaOH将酪蛋白溶液的pH值调至8.0。先取部分蛋白溶液用于测定总蛋白质含量(Pt),再将剩余的溶液在10 000×g条件下离心10 min。不溶物沉在管底,上清液包含可溶性物质用以测定蛋白含量(Ps),蛋白质含量用Bradford方法测定。变性程度计算见公式(2)。
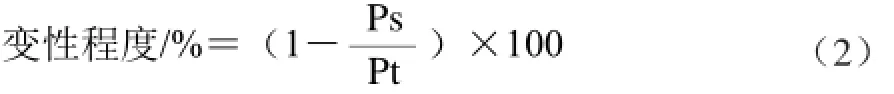
1.3.5 总巯基含量的测定
参考Aitken等[24]的方法,简述如下,所需储备液1)反应缓冲液:含1 mmol/L EDTA的0.1 mol/L PBS, pH 8.0;2)变性缓冲液:含6 mol/L 盐酸胍,1 mmol/L EDTA的0.1 mol/L Na2HPO4的缓冲溶液pH 8.0;3)Ellman’s溶液:用反应缓冲液配制10 mmol/L(4 mg/mL)的DTNB,新鲜配制。
用反应缓冲液配制浓度分别为0、0.25、0.5、0.75、1.0 mmol/L的半胱氨酸标准溶液,将样品溶液调pH值至8.0。准备一套离心管,分别加入20 μL的Ellman’s试剂溶液和1 mL的变性缓冲液,再依次加入100 μL的半胱氨酸标准溶液或样品溶液。混匀,室温下暗处放置15 min后,以反应缓冲液为参比,测定412 nm波长处的吸光度。以半胱氨酸标准溶液的浓度对其吸光度做标准曲线,进而得到样品溶液的总巯基含量。
1.3.6 羰基含量的测定
参考Wehr等[25]的方法,简述如下,取0.4 mL的蛋白样品溶液于1.5 mL离心管中,加入0.4 mL 0.2% DNPH溶液(含2 mol/L HCl),漩涡振荡,充分混匀,对照组加入0.4 mL 2 mol/L的HCl,其余操作相同;将混合液在室温下避光放置10 min,每2 min漩涡振荡1 次。加入0.2 mL 100 g/100 mL三氯乙酸(体系中最终含量为20 g/100 mL),2 000×g离心2 min,小心去除上清液;加入1 mL的乙醇-乙酸乙酯(1∶1,V/V)混合溶液,漩涡振荡,使蛋白分散,立即在5 000×g离心2 min,去除上清液,如此洗涤沉淀3 次以除去游离的DNPH;再将所得沉淀溶解在1 mL 6 mol/L的盐酸胍(含20 mmol/L K3P O4,pH 2.5)溶液中,37 ℃水浴15 min,使蛋白质完全溶解,6 000×g离心3 min。以6 mol/L的盐酸胍(含20 mmol/L K3PO4,pH 2.5)为空白,在370 nm波长处测上清液吸光度,并用Bradford法测上清液中的蛋白质的含量。羰基含量按朗伯比尔定律计算,见公式(3)。

式中:ΔA为样品A370nm-对照A370nm;ζ为产物腙的摩尔吸光系数,在此溶液中值为22 000 L/(mol•cm);b为比色皿光径/cm;c为羰基含量,羰基含量用nmol/mg pro表示。
1.4 数据处理
2 结果与分析
2.1 Fe2+浓度对酪蛋白氧化的影响
酪蛋白含4 个条带,从上到下依次为αs2-酪蛋白、αs1-酪蛋白、β-酪蛋白、κ-酪蛋白,由于αs2-酪蛋白和αs1-酪蛋白的分子质量比较接近,故这两个条带区分并不明显(图1A1)。氧化后,酪蛋白4 个组分的条带密度均减小,并在高分子区域出现新条带,且Fenton体系中Fe2+浓度在0.1~1.0 mmol/L范围时,随Fe2+浓度的增大、氧化温度的升高及氧化时间的延长,酪蛋白4 个组分条带的密度均逐渐减小,并在相应的高分子区域出现逐渐致密的新条带(图1)。在37 ℃条件下反应4 h后,Fe2+浓度为0.8 mmol/L时,高分子区域条带密度显著增加,在非还原电泳图谱中,相对应的条带有部分蛋白聚集在点样孔,而未进入浓缩胶(图1B2);而在还原电泳图谱中,点样孔处的蛋白含量增加不明显(图1A2)。图1B1、1B2与图1A1、1A2对比还可以看出,非还原电泳的电泳图谱要比还原电泳的电泳图谱少1 条分子质量较小的条带,即κ-酪蛋白缺失。
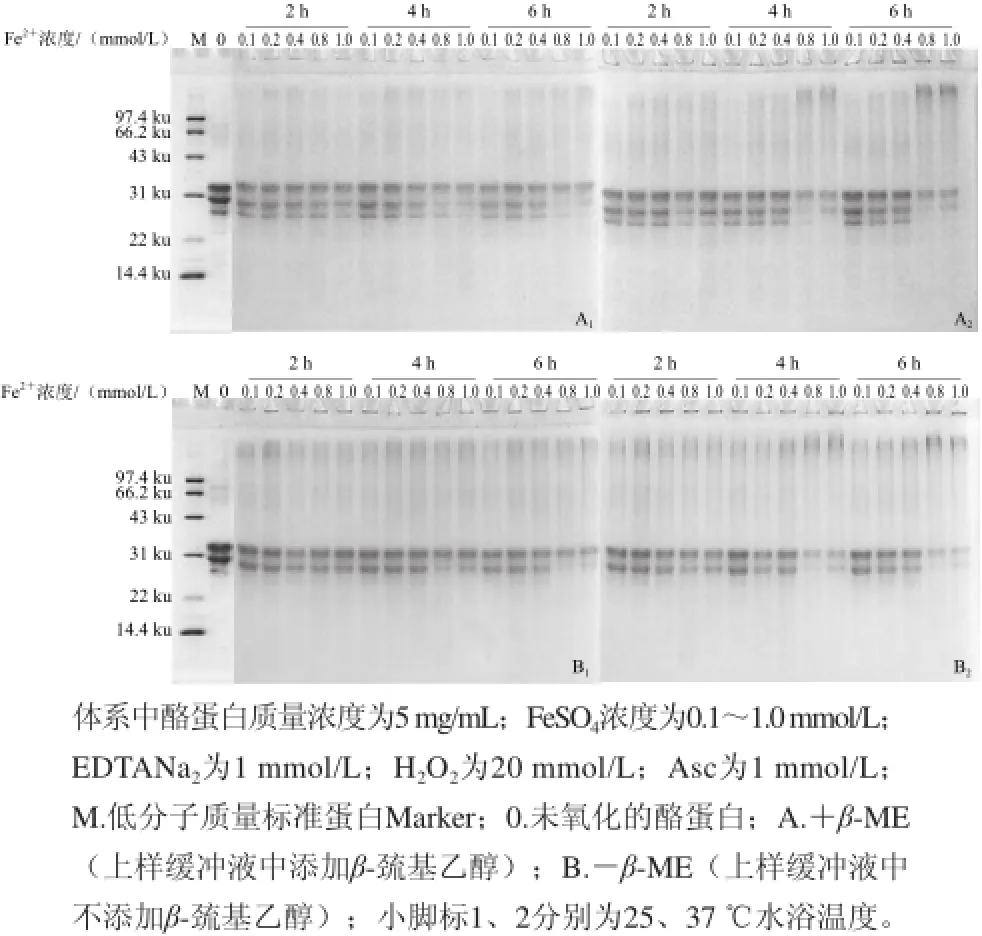
图1 Fe 1 Fe2+2+对酪蛋白氧化作用影响的SDS-PAGE电泳图谱EFig.1 SDS-PAGE patterns of casein in Fenton reaction system with different concentrations of Fe2+
酪蛋白的组成中αs2-酪蛋白和κ-酪蛋白各自含有两个—SH基团,由于两分子间的二硫键的作用,天然的αs2-酪蛋白大多以二聚体的形式存在,而天然的κ-酪蛋白则是以一系列由二硫键形成的多聚体的形式存在[26-27]。此外,αs1-和β-酪蛋白均可和κ-酪蛋白形成复合物[28]。酪蛋白的还原电泳图谱中多了1 个条带,是因为加入的β-巯基乙醇能将聚合状态的κ-酪蛋白中的二硫键断裂,形成κ-酪蛋白单体的缘故。酪蛋白氧化后发生交联或聚集,分子质量增大;但在还原电泳图谱中,点样孔处的蛋白含量增加不明显,是因为加入的β-巯基乙醇能将产生的交联蛋白中的二硫键还原,从而降低了其分子质量;而在还原电泳图谱中仍然存在较多的高分子区域新条带,可能是酪蛋白中的酪氨酸通过共价键结合形成二酪氨酸产生的交联蛋白[6,29],且有研究表明二酪氨酸主要是由α-酪蛋白和β-酪蛋白的氧化生成的[7,30]。Samagoto等[9]研究认为牛奶浓缩蛋白粉在紫外光氧化作用下产生的高分子质量蛋白聚合物主要是由于酪蛋白氧化产生的非二硫键共价交联;而Wang Yaosong等[16]认为乳清蛋白在Fenton体系中氧化后发生的交联主要是通过二硫键的形式产生的,本研究结果与前者更符。
2.2 H2O2对酪蛋白氧化的影响
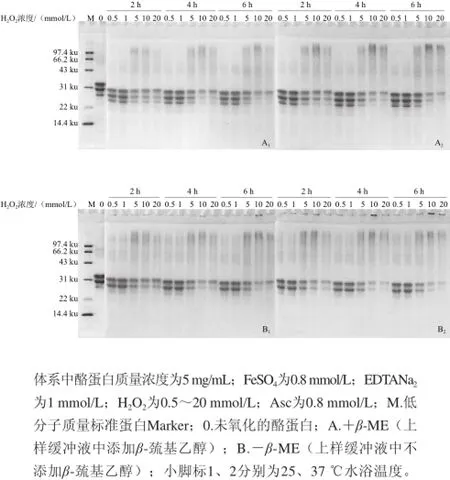
图 22 HH2O2对酪蛋白氧化作用影响的SDS-PAGE电泳图谱Fig.2 SDS-PAGE patterns of casein in Fenton reaction system with different concentrations of H2O2
根据Asc浓度的优化实验,在Asc 0.8 mmol/L的条件下研究了H2O2浓度在0.5~20 mmol/L时酪蛋白氧化程度的影响。结果表明,随H2O2浓度的增大、氧化温度的升高和氧化时间的延长,酪蛋白各条带密度逐渐减少,高分子区域条带密度逐渐增加(图2),且变化程度比不同浓度的Fe2+、Asc的影响更显著。当H2O2浓度小于1 mmol/L时,产生的羟自由基较少,对酪蛋白的氧化作用较小;当H2O2浓度大于5 mmol/L后,随H2O2浓度的增大,产生的羟自由基数量增加,对酪蛋白的氧化作用加大;其中在H2O2浓度为10 mmol/L时,氧化4 h后,酪蛋白的非还原电泳图谱中,有大量蛋白聚集在点样孔,而未进入浓缩胶(图2B1、2B2),表明酪蛋白发生了部分交联或聚集,分子质量增大;而当H2O2浓度为20 mmol/L时,酪蛋白溶液变得十分混浊,并产生部分沉淀,溶液中的蛋白含量急剧下降。
H2O2是Fenton体系产生羟自由基的直接来源,故其浓度对蛋白氧化的影响非常大。Cui Xuhai等[6]研究结果也表明H2O2浓度大于5 mmol/L时乳清蛋白氧化产生明显的交联,H2O2浓度为20 mmol/L时溶液混浊度(A600nm)最大,且蛋白含量急剧减少,本研究与其结果是一致的。
2.3 Asc对酪蛋白氧化的影响
图3 Asc对酪蛋白氧化作用影响的SDS-PAGE电泳图谱Fig.3 SDS-PAGE patterns of casein in Fenton reaction system with different concentrations of Asc
在Fenton体系中,研究了在H2O2为20 mmol/L 条件下,Asc浓度的变化(0.1~1.0 mmol/L)对酪蛋白氧化程度的影响。结果显示,Asc浓度在0.1~1.0 mmol/L范围内,随Asc浓度的增大、氧化温度的升高和氧化时间的延长,酪蛋白4 个组分的条带密度均逐渐减少,高分子区域条带密度逐渐增加(图3),表明酪蛋白的氧化程度逐渐加剧。在37 ℃条件下加热4 h后,当Asc浓度为0.8 mmol/L时,酪蛋白含量开始明显减少,且高分子区域条带密度增加(图3A2);但在非还原电泳图谱中,相对应的条带有部分蛋白聚集在点样孔,而未进入浓缩胶(图3B2),表明酪蛋白发生了部分交联或聚集,分子质量增大。氧化6 h后,酪蛋白4 个组分的含量均明显减少,高分子区域条带密度明显增加,且有大量的蛋白聚集在点样孔,氧化作用非常明显。
Nappi等[31]的研究证实Asc浓度在0.1~0.2 mmol/L时,能够促进金属离子的再生,进而使Fenton体系中H2O2能在Fe2+的催化作用下产生更多的羟自由基。此外,由于Asc在溶液中呈酸性,而Kremer[32]研究发现Fenton体系在较低pH值时O2的释放量减少,也就是说Asc浓度增大时,Fenton体系的pH值降低,H2O2分解产生的O2减少,从而有更多的H2O2参与产生羟自由基的反应,进而促进了酪蛋白的氧化。
2.4 酪蛋白质量浓度对酪蛋白氧化的影响
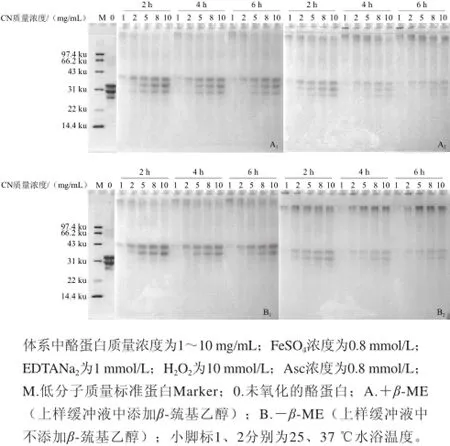
图4 酪蛋白质量浓度对酪蛋白氧化作用影响的SDS-PAGE电泳图谱Fig.4 SDS-PAGE patterns of casein in Fenton reaction system with different concentrations of casein
随酪蛋白质量浓度的增大,酪蛋白各条带密度逐渐增加,高分子区域条带密度逐渐减少(图4),表明酪蛋白的氧化程度逐渐减弱。当酪蛋白质量浓度低于5 mg/mL时,37 ℃氧化4 h后,酪蛋白的非还原电泳图谱中,均有大量蛋白聚集在点样孔,而未进入浓缩胶(图4B2);当酪蛋白质量浓度大于8 mg/mL时,氧化生成的高分子质量聚合物的含量开始减少,氧化作用有所减弱。表明酪蛋白在低质量浓度时更容易被氧化,且随氧化温度的升高和氧化时间的延长,氧化程度均逐渐加剧。
由于酪蛋白是牛奶各组分中起抗氧化作用的主要蛋白[33],在确定的体系中,Fenton体系产生羟自由基的数量是一定的,当体系中酪蛋白质量浓度增大时,能够清除部分自由基,从而减少羟自由基对酪蛋白本身的氧化损伤。
综合以上实验结果可以看出,Fenton体系中酪蛋白质量浓度为5 mg/mL,FeSO4浓度为0.8 mmol/L,EDTANa2浓度为1 mmol/L,H2O2浓度为10 mmol/L,Asc浓度为0.8 mmol/L,37 ℃条件下加热4 h对酪蛋白的氧化作用非常明显。
本研究采用Fe2+-H2O2-Asc体系,其中Fe2+浓度为0.8 mmol/L,H2O2浓度为10 mmol/L,比Utrera等[18]采用的Fe2+-H2O2体系(含40或80 μmol/L Fe2+,0.8 mmol/L H2O2)中的Fe2+和H2O2的浓度都要高;但比Bian Chunli等[19]研究的Fe2+-H2O2体系(含2.5 mmol/L Fe2+,50 mmol/L H2O2)中的Fe2+和H2O2的浓度都要低。本研究优化得到的Asc浓度为0.8 mmol/L,比Cui Xuhai等[6]采用的Fe3+-H2O2-Asc体系(含0.1 mmol/L Asc)中的Asc的浓度高,但比Wang Yaosong等[16]研究的Fe3+-H2O2-Asc体系(含1 mmol/L Asc)中的Asc浓度低。本研究的反应温度为37 ℃,比上述4 项研究中采用的室温条件也要高;本研究需要的酪蛋白质量浓度为5 mg/mL,比Cui Xuhai等[6]研究的乳清蛋白质量浓度为20 mg/mL低很多,这可能与酪蛋白具有较强的抗氧化作用有关。
乳与乳粉中均含有一定量的铁及抗坏血酸,但其含量较本实验中采用的浓度低,在H2O2存在下仍会发生Fenton反应,导致乳蛋白的氧化。因此在乳与乳粉的贮藏及加工过程中应尽量避免接触H2O2等氧化剂。
2.5 酪蛋白氧化对化学及结构特性的影响
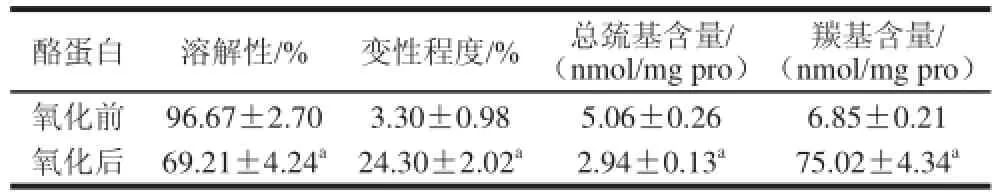
表1 酪蛋白氧化对化学及结构特性的影响Table 1 Changes in chemical and structural properties of casein after oxidattiioonn
由表1可知,酪蛋白氧化后溶解度下降了28.4%,变性程度增加了6.4 倍,总巯基含量下降了41.9%,羰基含量增加了近10 倍,进一步表明酪蛋白在Fenton体系中很容易被氧化。
本研究的结果与Cui Xuhai等[6]研究的乳清蛋白的各氧化指标的变化趋势一致,但本研究采用的Fenton体系对蛋白氧化更敏感。氧化后酪蛋白总巯基的含量减少,这是因为酪蛋白的组成中αs2-酪蛋白和κ-酪蛋白各自含有两个—SH基团[26-27],在Fenton体系中很容易被氧化发生交联,这与SDS-PAGE的结果是一致的。α-酪蛋白和β-酪蛋白是无规则卷曲蛋白,最容易被氧化形成羰基,其中色氨酸、组氨酸,蛋氨酸中的羰基含量增加明显[7]。此外,赖氨酸、精氨酸、脯氨酸、苏氨酸的氧化也可形成羰基[29-30]。
3 结 论
在Fenton体系中,增加Fe2+、H2O2及Asc浓度的均能促进酪蛋白的氧化;升高温度及延长氧化时间也能促进酪蛋白的氧化;但当酪蛋白质量浓度增高时,体系对酪蛋白的氧化作用减弱。酪蛋白氧化后发生交联生成蛋白聚合物;氧化还造成酪蛋白的氨基酸功能基团发生变化,如巯基含量减少,氨基酸残基氧化生成羰基,这些可导致酪蛋白的变性程度增大以及溶解度下降。本实验对影响酪蛋白氧化的因素的研究,为有效地控制乳蛋白在贮藏及加工过程中的氧化反应及减少产品品质劣变提供理论依据和研究基础。
[1] HARATIFAR S, CORREDIG M. Interactions between tea catechins and casein micelles and their impact on renneting functionality[J]. Food Chemistry, 2014, 143: 27-32.
[2] FARRELL H M, JIMENEZ-FLORES R, BLECK G T, et al. Nomenclature of the proteins of cows’ milk-sixth revision[J]. Journal of Dairy Science, 2004, 87(6): 1641-1674.
[3] FOX P F, BRODKORB A. The casein micelle: historical aspects, current concepts and significance[J]. International Dairy Journal, 2008, 18(7): 677-684.
[4] MODLER H W. Functional properties of nonfat dairy ingredients-a review. Modification of products containing casein[J]. Journal of Dairy Science, 1985, 68(9): 2195-2205.
[5] YONG Y H, FOEGEDING E A. Caseins: utilizing molecular chaperone properties to control protein aggregation in foods[J]. Journal of Agricultural and Food Chemistry, 2010, 58(2): 685-693.
[6] CUI Xuhai, XIONG Youling, KONG Baohua, et al. Hydroxyl radicalstressed whey protein isolate: chemical and structural properties[J]. Food and Bioprocess Technology, 2012, 5(6): 2454-2461.
[7] DALSGAARD T K, OTZEN D, NIELSEN J H, et al. Changes in structures of milk proteins upon photo-oxidation[J]. Journal of Agricultural and Food Chemistry, 2007, 55(26): 10968-10976.
[8] KRISTO E, HAZIZAJ A, CORREDIG M. Structural changes imposed on whey proteins by UV irradiation in a continuous UV light reactor[J]. Journal of Agricultural and Food Chemistry, 2012, 60(24): 6204-6209.
[9] SAMAGOTO H M, LIU Dasong, KOBOYATAU K, et al. Effects of UV induced photo-oxidation on the physicochemical properties of milk protein concentrate[J]. Food Research International, 2014, 62: 580-588.
[10] ØSTDAL H, BJERRUM M J, PEDERSEN J A, et al. Lactoperoxidaseinduced protein oxidation in milk[J]. Journal of Agricultural and Food Chemistry, 2000, 48(9): 3939-3944.
[11] MESTDAGH F, KERKAERT B, CUCU T, et al. Interaction between whey proteins and lipids during light-induced oxidation[J]. Food Chemistry, 2011, 126(3): 1190-1197.
[12] KONG Baohua, XIONG Youling, CUI Xuhai, et al. Hydroxyl radicalstressed whey protein isolate: functional and rheological properties[J]. Food and Bioprocess Technology, 2013, 6(1): 169-176.
[13] KOPPENOL W H. The centennial of the Fenton reaction[J]. Free Radical Biology and Medicine, 1993, 15(6): 645-651.
[14] GOLDSTEIN S, MEYERSTEIN D, CZAPSKI G. The fenton reagents[J]. Free Radical Biology and Medicine, 1993, 15(4): 435-445.
[15] ZHAO M J, JUNG L. Kinetics of the competitive degradation of deoxyribose and other molecules by hydroxyl radicals produced by the Fenton reaction in the presence of ascorbic acid[J]. Free Radical Research, 1995, 23(3): 229-243.
[16] WANG Yaosong, XIONG Youling, RENTFROW G K, et al. Oxidation promotes cross-linking but impairs film-forming properties of whey proteins[J]. Journal of Food Engineering, 2013, 115(1): 11-19.
[17] LIU Zelong, XIONG Youling. Oxidation desensitizes actomyosin to magnesium pyrophosphate-induced dissociation[J]. Food Chemistry, 2013, 141(2): 662-668.
[18] UTRERA M, ESTÉVEZ M. Analysis of tryptophan oxidation by fluorescence spectroscopy: effect of metal-catalyzed oxidation and selected phenolic compounds[J]. Food Chemistry, 2012, 135(1): 88-93.
[19] BIAN Chunli, XIONG Huayu, ZHANG Xiuhua, et al. Electrochemical detection of BSA damage induced by Fenton reagents in room temperature ionic liquid[J]. Sensors and Actuators B: Chemical, 2012, 169: 368-373.
[20] 程恒, 陈尚武, 景浩. 氧化反应所致3 种乳蛋白结构及功能变化的研究[J]. 食品科技, 2013, 38(9): 35-40.
[21] JING Hao, KITTS D D. Chemical characterization of different sugar-casein Maillard reaction products and protective effects on chemical-induced cytotoxicity of Caco-2 cells[J]. Food and Chemical Toxicology, 2004, 42(11): 1833-1844.
[22] DAIMER K, KULOZIK U. Oil-in-water emulsion properties of egg yolk: effect of enzymatic modification by phospholipase A2[J]. Food Hydrocolloids, 2009, 23(5): 1366-1373.
[23] DAIMER K, KULOZIK U. Impact of a thermal treatment at different pH on the adsorption behavior of untreated and enzyme-modified egg yolk at the oil-water interface[J]. Colloid and Surfaces B: Biointerfaces, 2010, 75(1): 19-24.
[24] AITKEN A, LEARMONTH M. Estimation of disulfide bonds using Ellman’s reagent[M]// WALKER J M. The protein protocols handbook. Clifton, New Jersey: Humana Press, 2002: 595-596.
[25] WEHR N B, LEVINE R L. Quantification of protein carbonylation[M]// GALLUZZI L, VITALE I, KEPP O, et al. Cell senescence. Clifton, New Jersey: Humana Press, 2013: 265-281.
[26] RASMUSSEN L K, JOHNSEN L B, TSIORA A, et al. Disulphidelinked caseins and casein micelles[J]. International Dairy Journal, 1999, 9(3): 215-218.
[27] HOLT C, CARVER J A, ECROYD H, et al. Invited review: caseins and the casein micelle: their biological functions, structures, and behavior in foods[J]. Journal of Dairy Science, 2013, 96(10): 6127-6146.
[28] 潘晓赟. 基于酪蛋白的纳米粒子制备及其应用的研究[D]. 上海: 复旦大学, 2008: 5.
[29] STADTMAN E R. Oxidation of free amino acids and amino acid residues in proteins by radiolysis and by metal-catalyzed reactions[J]. Annual Review of Biochemistry, 1993, 62(1): 797-821.
[30] MEYER B, BAUM F, VOLLMER G, et al. Distribution of protein oxidation products in the proteome of thermally processed milk[J]. Journal of Agricultural and Food Chemistry, 2012, 60(29): 7306-7311.
[31] NAPPI A J, VASS E. Comparative studies of enhanced iron-mediated production of hydroxyl radical by glutathione, cysteine, ascorbic acid, and selected catechols[J]. Biochimica et Biophysica Acta, 1997, 1336(2): 295-302.
[32] KREMER M L. The Fenton reaction. Dependence of the rate on pH[J]. The Journal of Physical Chemistry A, 2003, 107(11): 1734-1741.
[33] ZULUETA A, MAURIZI A, FR¸GOLA A, et al. Antioxidant capacity of cow milk, whey and deproteinized milk[J]. International Dairy Journal, 2009, 19(6): 380-385.
Optimization of Fenton Reaction System and Its Inductive Effect on Casein Oxidation
LIU Jian-lei, JING Hao*
(College of Food Science and Nutritional Engineering, China Agricultural University, Beijing 100083, China)
Casein consists of about 80% of the proteins of milk or milk powder, which is susceptible to oxidation during food processing and storage. Fenton reaction-induced casein oxidation and the associated chemical and structural changes were investigated. The effects of the main components in the Fenton reaction system as well as reaction temperature and time on casein oxidation were investigated by using sodium dodecyl sulfate-polyacrylamide gel electrophoresis (SDS-PAGE), and the conc entrations of Fe2+, ascorbic acid, and H2O2were optimized. Fenton reaction-induced casein oxidation and its chemical and structural changes were assessed by changes in solubility, degree of protein denaturation, and total sulfhydryl and carbonyl contents of casein. Results showed that casein was oxidized to a great degree in the Fenton system containing 0.8 mmol/L FeSO4, 1 mmol/L EDTANa2, 10 mmol/L H2O2, 0.8 mmol/L ascorbic acid, 5 mg/mL casein after incubation at 37 ℃ for 4 h. The electrophoretic patterns indicated decreases in band intensity of casein and increases in density of the high molecular weight (HMW) protein bands. These changes were greater with increasing concentrations of Fe2+, ascorbic acid, and H2O2in the Fenton reaction sy stem as well as temperature and time. Smaller changes in the casein bands were seen with increasing its concentration. Solubility and total sulfhydryl content were decreased, and degree of protein denaturation and carbonyl content were increased after oxidization of casein. In conclusion, casein oxidation leads to cross-linking into high molecular weight (HMW) substances and modification of functional groups of amino acid residues, which consequently results in decreased protein solubility and increased protein denaturation degree.
casein; Fenton reaction system; oxidation; optimization; chemical and structural properties
TS252.1
A
1002-6630(2014)13-0074-07
10.7506/spkx1002-6630-201413014
2014-06-15
“十二五”农村领域国家科技计划项目(2011BAD09B0302)
刘建垒(1987—),男,博士研究生,研究方向为乳蛋白的品质控制。E-mail:liujianlei@cau.edu.cn
*通信作者:景浩(1957—),男,教授,博士,研究方向为分子营养与食品安全。E-mail:haojing@cau.edu.cn

