发酵剂对兔肉脯游离脂肪酸变化的影响
陈 剑,蒋云升*,闫婷婷
(扬州大学食品科学与工程学院,江苏 扬州 225127)
发酵剂对兔肉脯游离脂肪酸变化的影响
陈 剑,蒋云升*,闫婷婷
(扬州大学食品科学与工程学院,江苏 扬州 225127)
将兔肉糜中接种植物乳杆菌(Lactobacillus plantarum)、木糖葡萄球菌(Staphylococcus xylosus)、汉逊氏德巴利酵母(Dabaryomyces hansenii),发酵及烘烤制成兔肉脯,研究3 种不同菌种接种发酵处理对兔肉脯中游离脂肪酸变化的影响,结果表明:总的游离脂肪酸含量均高于非接种菌组,其含量由高到低分别为葡萄球菌处理组>酵母菌处理组>植物乳杆菌处理组,说明添加的发酵剂促进了兔肉脯中脂肪的分解,而且它们在兔肉脯中分解产生游离脂肪酸的能力依次递减,各种脂肪酸的含量各有增减,说明不同的发酵剂对其作用不同。进一步研究3种菌复合发酵处理对兔肉脯中游离脂肪酸影响情况,结果表明其总的游离脂肪酸含量及各种脂肪酸含量均高于单一菌接种组,说明3种菌的复合发酵分解产生游离脂肪酸的能力较强。
兔肉脯食品;复合发酵;游离脂肪酸
我国是兔肉生产和出口大国,兔肉的产量和加工产品的种类都在逐年增加。《本草纲目》记载:兔肉性寒味甘,具有补中益气、止渴健脾、凉血解热、利大肠之功效。兔是食草动物,兔肉的蛋白质含量为20%,脂肪含量为8%,是人们理想的“绿色食品”[1]。兔肉加工产品的品种很多,市面上可见的发酵兔肉产品有腊兔、板兔、中国兔肉香肠等,未见有发酵兔肉脯。而市面上常见兔肉脯多为非发酵制品,有传统蒸制型兔肉脯、传统烧烤型兔肉脯等。
发酵肉制品在成熟过程中发生着复杂的化学变化,其中主要包括碳水化合物、蛋白质和脂肪的降解[2]。在对肉制品及肉制品原料风味的研究中,包括游离脂肪酸在内种类繁多的风味化合物已经得到了较好的分离与鉴定,然而,无论哪一种化合物都不能单独形成肉的风味,因为肉品风味是许多种化合物共同作用并在量上达到一定平衡才产生的,其中在风味的形成中起最重要作用的物质之一就是脂类物质[3]。Toldra等[4]研究发现发酵肉制品挥发性成分大部分是由脂质的自动氧化形成的。脂肪组分中,游离脂肪酸更容易发生氧化产生挥发性物质,是形成肉制品风味的重要前体物质。游离脂肪酸中的不饱和脂肪酸在肉类风味物质形成中起着非常重要的作用,肉中不饱和脂肪酸的含量越多,最终形成的风味就越浓。
脂类物质在发酵加工过程中一般会经过水解、氧化等途径,以形成它们的风味成分。有观点认为,肉制品在成熟过程中脂肪的水解主要是由微生物引起的,而不饱和脂肪酸的氧化、脂质过氧化物和羰基化合物的生成则被认为是化学反应,这与微生物的代谢活动密切有关[5]。虽然一些学者认为发酵过程中组织酶对脂肪水解发挥着重要作用,但更多的学者认为发酵肉制品中脂类酶主要源于微球菌科的微生物,葡萄球菌所起的作用最为重大[6]。当然酵母菌也能够产生脂肪酶,使游离脂肪酸释放出来,为肉脯的风味成分提供前体物质[7]。乳酸菌分解脂肪的能力却很低,在发酵肉制品中不起明显分解脂肪的作用,但是乳酸菌却可以改变发酵肉制品的酸度,进而影响其他微生物菌群,从而对发酵肉制品风味有重要意义的脂肪的分解构成重要的影响[8]。
本实验拟在兔肉脯加工过程中,将植物乳杆菌、木糖葡萄球菌、汉逊氏德巴利酵母三者作为发酵剂接种于其中,测定肉脯产品中游离脂肪酸种类和含量的变化,旨在探讨在兔肉脯发酵加工过程中3 种菌株对游离脂肪酸变化所起的作用,为利用复合发酵剂生产发酵兔肉脯提供理论依据。
1 材料与方法
1.1 菌种与材料
植物乳杆菌(Lactobacillus plantarum)、木糖葡萄球菌(Staphylococcus xylosus)、汉逊氏德巴利酵母(Dabaryomyces hansenii)由扬州大学食品科学与工程学院微生物实验室保藏。
新鲜兔肉购自扬州市农贸市场,调味料包括鱼露、绵白糖、味精、胡椒粉、混合香料均为市售优级品。1.2 试剂
三氯甲烷、三氟化硼、苯、甲醇、丙酮、NaCl、NaOH均为分析纯;正己烷为色谱纯;其余试剂包括Amberlyst(A-26)树脂、去CO2蒸馏水等。
1.3 仪器与设备
GC-14B气相色谱仪 日本岛津公司;RE-52D旋转蒸发仪 上海青浦沪西仪器厂;1-15 PK高速冷冻离心机 德国Sigma公司;HG101-2型电热鼓风干燥箱 南京实验仪器厂;HSX型控温控湿培养箱 上海福玛设备有限公司;SW-CJ-1F无菌操作台 苏州净化设备有限公司;YXO.SGH280型高压灭菌釜 上海医用核子仪器厂;BS224S型电子天平 赛多利斯中国有限公司;FJ-200型高速均质仪 上海标本模型厂;PYX-DHS隔水式恒温培养箱 上海跃进医疗器械厂。
1.4 方法
1.4.1 发酵兔肉脯工艺
新鲜兔后腿肉→洗净切块→绞碎拌馅腌制(白糖、鱼露等)→添加发酵剂一次混匀→低温发酵→加辛香料2 次混匀→成型干燥、高温烤制→冷却后真空包装
发酵剂制作与添加:30 ℃条件下液体培养基培养筛选菌株12 h后,置于4 ℃、4 000 r/min冷冻离心10 min,用无菌生理盐水洗涤1 次再离心,收集菌体并适量稀释,制作成指定的添加份量。
接种与拌料:向腌制好的肉糜中加入辛香料及发酵剂,搅拌均匀,整个过程中肉糜温度不得超过4 ℃。发酵过程中影响发酵的主要因素有接种量、发酵温度、相对湿度、接种比例[9]。本研究在采用预实验、单因素试验、正交优化试验等前期工作的基础上[10],确定发酵兔肉脯最佳工艺参数为:接种量1×107CFU/g,发酵温度16 ℃,相对湿度80%~85%,发酵时间54 h。
1.4.2 分组处理
根据发酵剂的使用情况,实验分为L、C、Y、S和CK 5个组别。L处理组单独接种植物乳杆菌;C组单独接种葡萄球菌;Y处理组单独接种酵母菌;S处理组接种复合菌种,其中接种菌种L、C、Y质量比为1∶4∶1;CK组不接种为空白对照。实验分别测定其成品中的游离脂肪酸含量。
1.4.3 树脂的处理、再生和保存
取A-26树脂10.00 g置于250 mL锥形瓶,加入0.5 mol/L NaOH溶液150 mL,振荡0.5 h后倾去NaOH溶液,用去CO2水洗3 次,每次振荡20 min弃洗液,再用甲醇40 mL分3 次洗涤,每次振荡20 min,重复1 次,保存于甲醇中。
1.4.4 游离脂肪酸的测定[11]
1.4.4.1 总脂提取
取10.00 g肉脯样品充分破碎后放置于250 mL锥形瓶中,加入CM液(V(三氯甲烷)∶V(甲醇)=2∶1)150 mL,振荡抽提2 h过滤,滤液中加入1% NaCl溶液(约为滤液体积的一半),静置分层后取下层氯仿液,40 ℃水浴下旋转蒸发浓缩后氮气吹干。
1.4.4.2 游离脂肪酸的分离
取总脂50~100 mg,加入丙酮-甲醇溶液(2∶1,V/V)15 mL,再加入A-26树脂100~200 mg,C15∶0内标0.2~0.5 mL,振荡30min,静止后弃去溶剂,再用丙酮-甲醇溶液15 mL分4 次洗涤树脂,将树脂洗入具塞试管中,倾去丙酮-甲醇液,氮气吹干树脂,加入3 mL甲酯化试剂(三氟化硼-甲醇溶液1 mL,苯1 mL,甲醇 1 mL),加塞煮沸45 min,取出冷却后开盖,加入正己烷2 mL,蒸馏水1 mL,振荡分层,取1 μL正己烷上机检测。
色谱条件:Supelco waxTM10石英毛细管柱(30 m×0.25 mm,0.35 μm),涂层为:polyethylene glycol。进样口温度250 ℃;检测器温度260 ℃;载气:高纯氮气;载气流速:1.2 mL/min;分流流速:22 mL/min;分流比:20∶1;尾吹气:氢气,32 mL/min;空气,430 mL/min;程序升温:初始温度80 ℃,以20 ℃/min升至210 ℃,再以3 ℃/min上升至225 ℃,225 ℃保持12 min。
1.4.4.3 游离脂肪酸定性依据与方法
各成分在一定的色谱条件下均有固定不变的保留值,数值取决于组分在两相中的分配系数,而与组分性质无关。各脂肪酸标准样品分别配制成一定体积分数的甲醇溶液,与样品相同前处理,相同的色谱条件下,通过与标准脂肪酸的保留时间进行比较,以确定样品中各脂肪酸组分。
1.4.4.4 游离脂肪酸定量依据与计算
一定操作条件下,组分的质量或其在载气中的浓度与色谱图上峰面积A或峰高H成正比例关系。采用内标法进行定量计算,内标物为C15∶0。数据用Microsoft Excel统计处理,利用SPSS 17.0软件分析差异显著性。
2 结果与分析
2.1 兔肉脯发酵处理游离脂肪酸的测定结果
发酵兔肉脯中一定游离脂肪酸的存在有利于产品良好风味的形成。通过几种不同的菌种发酵兔肉脯与空白对照组进行比较,考察微生物发酵剂对发酵兔肉脯中游离脂肪酸的影响。
植物乳杆菌发酵处理发酵兔肉脯游离脂肪酸变化结果如图1所示。L处理组未检测出十一碳酸(C11∶0),CK组未检测出癸酸(C10∶0)和亚油酸(C18∶2)。L处理组十一碳酸(C11∶0)、十四碳一烯酸(C14∶1)和硬脂酸(C18∶0)的含量低于CK组。L处理组棕榈酸(C16∶0)、十七碳酸(C17∶0)、油酸(C18∶1)、二十碳酸(C20∶0)的含量高于CK组,分别是CK组的4.9、6.0、2.9 倍和1.3 倍。

图1 L处理组兔肉脯游离脂肪酸含量变化Fig.1 FFA content in Lactobacillus plantarum treatment group
木糖葡萄球菌发酵兔肉脯游离脂肪酸变化结果如图2所示。C处理组未检测出棕榈酸(C16∶0)和二十碳酸(C20∶0),CK组未检测出癸酸(C10∶0)和亚油酸(C18∶2)。C处理组除了十一碳酸(C11∶0)的含量低于CK组,其余游离脂肪酸均高于CK组,其中十四碳一烯酸(C14∶1)、油酸(C18∶1)分别是对照组的6.3 倍和4.0 倍。
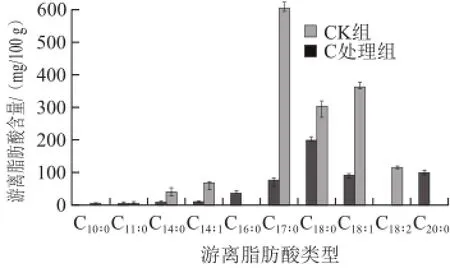
图2 C处理组兔肉脯游离脂肪酸含量变化Fig.2 FFA content in Staphylococcus xylosus treatment group
汉逊氏德巴利酵母发酵兔肉脯的游离脂肪酸变化结果如图3所示。Y处理组未检测出十一碳酸(C11∶0)、亚油酸(C18∶2),CK组未检测出癸酸(C10∶0)和亚油酸(C18∶2)。Y处理组除了硬脂酸(C18∶0)和二十碳酸(C20∶0)含量低于CK组,其余的游离脂肪酸均高于CK组,其中十四碳一烯酸(C14∶1)、油酸(C18∶1)分别是对照组的12.1 倍和1.5 倍。

图3 Y处理组兔肉脯游离脂肪酸含量变化Fig.3 FFA content in Debaryomyces hansenii treatment group

图4 S处理组兔肉脯游离脂肪酸含量变化Fig.4 FFA content in mixed-strain fermentation group
S处理组发酵兔肉脯游离脂肪酸变化结果如图4所示。S处理组未检测出二十碳酸(C20∶0),CK组未检测出癸酸(C10∶0)和亚油酸(C18∶2)。S处理组除了棕榈酸(C16∶0)、硬脂酸(C18∶0)和二十碳酸(C20∶0)含量低于CK组,其余的游离脂肪酸均高于CK组,其中十四碳一烯酸(C14∶1)、油酸(C18∶1)分别是对照组的7.7 倍和9.0 倍。
2.2 不同处理发酵兔肉脯游离脂肪酸种类的变化
游离脂肪酸在发酵过程中有一个动态变化的过程,脂类物质发生分解对于提高兔肉肉脯的营养价值有着重要的意义[12]。
2.2.1 植物乳杆菌发酵处理对兔肉脯游离脂肪酸种类的影响

表1 不同处理组游离脂肪酸的分类统计Table1 Comparison of free fatty composition and content among different groups
由表1可知,L处理组的SFA含量是CK组的2.0 倍,L处理组SFA总量百分比低于CK组。L处理组的MUFA含量及总量百分比均高于CK组,分别是CK组的2.7 倍和1.1 倍。L处理组的PUFA含量及总量百分比也均高于CK组。游离脂肪酸构成比例中,L处理组和CK组均为SFA>MUFA>PUFA,L处理组的SFA与UFA(MUFA+PUFA)之比小于CK组。
乳酸菌具有一般微生物所不具有的特殊酶系,如分解有机酸的酶系、分解脂肪酸的酶系、分解亚硝胺的酶系、控制内毒素的酶系等。这些酶系除了具有特殊生理功能,还可以改善肉品风味和促进发酵肉制品成熟[13]。分解有机酸的酶系代谢产生有机酸,降低了肉制品的酸度,影响其他细菌分解脂肪;分解脂肪酸的酶系可以分解肉制品中的脂肪酸,使之成为短链的挥发性脂肪酸和酯类,从而赋予产品特有的香味[14]。
植物乳杆菌试管中分解脂肪的活力已得到证实,但是当其添加到兔肉中时,它的脂肪分解活力却较低。从本实验情况来看,此组兔肉脯感官评价值是最差的,总的游离脂肪酸含量低,饱和脂肪酸和油酸(C18∶1)含量较高,发酵兔肉脯脂肪分解作用和游离脂肪酸生成作用不明显,说明植物乳杆菌的脂类物质分解能力不强,这与Larrouture等[15]的研究结果一致。
2.2.2 木糖葡萄球菌处理对发酵兔肉脯游离脂肪酸种类的影响
由表1可知,C处理组的SFA含量是CK组的2.6 倍,C处理组SFA总量百分比低于CK组。C处理组MUFA含量及其总量百分比均高于CK组,分别为CK组的4.2 倍和1.4 倍。C处理组的PUFA含量及其总量百分比均高于CK组。游离脂肪酸构成比例中,C处理组和CK组均为SFA>MUFA>PUFA,C处理组的SFA与UFA之比小于CK组。
微球菌科的微生物是肉制品中脂类酶的主要来源。许多微球菌和葡萄球菌分解脂肪的能力各不相同。Garcia-Varona等[16]学者从一种传统西班牙发酵香肠中分离了426 株葡萄球菌和微球菌,其中优势菌种是木糖葡萄球菌,这种菌具有中等的脂肪酶活性。Beck等[17]学者研究发现,葡萄球菌中的木糖葡萄球菌能够转换游离脂肪酸,对肉制品的脂类影响很大。
从本实验情况来看,此组兔肉脯感官评价值是较好的,十四碳一烯酸(C14∶1)、油酸(C18∶1)含量高,木糖葡萄球菌显示出较强的脂肪分解能力,尤其是分解多不饱和脂肪酸的能力。这与Hierro等[18]学者的研究结果相似。这可能与木糖葡萄球菌的脂肪酶系活性较大,易于把游离脂肪酸分解成小分子的挥发性物质有关。Lizaso等[19]研究显示,在发酵期间,由于葡萄球菌的作用,饱和脂肪酸与不饱和脂肪酸的比率增加,这是由于饱和脂肪酸增加,而不饱和脂肪酸减少,因而它们更易被进一步氧化成羰基化合物。本研究结果显示的饱和脂肪酸与不饱和脂肪酸的比率较低,可能与兔肉脯发酵时间还较短,不饱和脂肪酸还没有进一步氧化成羰基化合物有关。
2.2.3 汉逊氏德巴利酵母菌处理对发酵兔肉脯游离脂肪酸种类的影响
由表1可知,Y处理组的SFA含量是CK组的1.5 倍,Y处理组SFA总量百分比低于CK组。Y处理组的MUFA含量及其总量百分比均高于CK组,分别是CK组的2.6 倍和1.5 倍。Y处理组与CK组均未检测出PUFA。游离脂肪酸构成比例中,Y处理组和CK组均为SFA>MUFA,Y处理组的SFA与MUFA之比小于CK组。
从本实验情况分析,此组兔肉脯感官评价值较差,总的游离脂肪酸含量低。目前,关于酵母菌分解脂类物质的报道还较少。但是,王世宽等[20]学者现已证实酵母菌发酵过程中能够改善肉制品的风味。在肉制品中应用最普遍的是汉逊酵母菌属中的德巴利汉逊酵母。这种酵母能够抑制脂肪的氧化、促进酯类的形成,改善制品的风味。不过过量的接种时反而会产生一定量的酸,从而削弱其积极作用。酵母发挥作用的大小依赖于发酵肉制品中其他发酵剂的存在,与乳酸菌和葡萄球菌联合使用效果较好[20]。本研究中德巴利汉逊酵母显示出一定的分解脂类物质的能力,可能与加工原料、加工方法有关,其原因还有待于深入研究。
2.2.4 多菌复合发酵处理对发酵兔肉脯游离脂肪酸种类的影响
由表1可知,S处理组SFA含量是CK组的2.4 倍,S处理组SFA总量百分比低于CK组。S处理组MUFA含量及其总量百分比均高于CK组,分别是CK组的8.9 倍和2.1 倍。S处理组PUFA含量及总量百分比均高于CK组。游离脂肪酸构成比例中,S处理组和CK组均为SFA>MUFA>PUFA,S处理组的SFA与UFA之比小于CK组。
本实验研究发现,多菌复合发酵组游离脂肪酸含量明显高于空白对照组和其他单菌发酵组,此组兔肉脯感官评价也是最好的。这可能与所选菌株都具有脂肪酶活性,可以增加发酵兔肉脯游离脂肪酸含量有关。尽管采用3 种菌株混合的发酵,菌群有交替,但并不影响脂肪的分解,并且增加了多不饱和脂肪酸含量,这与Hierro等[18]的研究结果不同,他们采用植物乳杆菌和具有较高脂类分解活性的葡萄球菌共同做为干发酵香肠的发酵剂,与不加发酵剂的干香肠相对照,并未发现脂肪降解作用的增加。然而单独使用该葡萄球菌做发酵剂时,游离脂肪酸的含量是对照组的5 倍。这可能是由于乳酸菌的酸化作用,pH值降低,抑制了葡萄球菌水解脂肪的活性有关。而本实验由于发酵时间短,接种木糖葡萄球菌的比例又高,所以,植物乳杆菌不能很快的成为优势菌,从而保证了木糖葡萄球菌水解脂肪的活性。
3 结 论
植物乳杆菌处理组发酵兔肉脯总的游离脂肪酸含量低,饱和脂肪酸和油酸(C18∶1)含量较高,说明植物乳杆菌的单菌发酵,分解脂肪作用并不明显。木糖葡萄球菌处理组发酵兔肉脯总的游离脂肪酸含量较高,十四碳一烯酸(C14∶1)、油酸(C18∶1)含量高,说明木糖葡萄球菌的单菌发酵,分解脂类物质分解能力较强。汉逊氏德巴利酵母处理组发酵兔肉脯总的游离脂肪酸含量较低,十四碳一烯酸(C14∶1)、油酸(C18∶1)含量高,说明德巴利汉逊酵母的单菌发酵分解脂类物质能力较弱。以植物乳杆菌、木糖葡萄球菌、汉逊氏德巴利酵母3种菌质量比1∶4∶1接种兔肉糜发酵、烘干制成的兔肉脯总游离脂肪酸含量最高,十四碳一烯酸(C14∶1)、油酸(C18∶1)、亚油酸(C18∶2)含量均相当高,说明多菌复合发酵分解脂肪能力强,提示复合发酵是有利于改进兔肉脯加工品质的重要加工技术。
[1] 杨佳艺, 李洪军. 我国兔肉加工现状分析[J]. 食品科学, 2010, 31(17): 429-432.
[2] 李平兰, 沈清武, 孙成虎, 等. 微生物酶与肉组织酶对干发酵香肠中游离氨基酸的影响[J]. 食品与发酵工业, 2005, 31(5): 134-138.
[3] 邓文辉, 赵燕, 李建科, 等. 游离脂肪酸在几种常见食品风味形成中的作用[J]. 食品工业科技, 2012, 33(11): 422-425.
[4] TOLDRA F. Proteolysis and lipolysis in flavor development of drycured meat products[J]. Meat Science, 1998, 49(Suppl 1): 101-110.
[5] CASABURI A, MONACO R D, CAVELLA S, et al. Proteolytic and lipolytic starter cultures and their effect on traditional fermented sausages ripening and sensory traits[J]. Food Microbiology, 2008, 25: 335-347.
[6] CHASCO J, BERIAIN M J, BELLO J. A study of changes in the fat content of some varieties of dry sausage during the cure process[J]. Meat Science, 1993, 34(2): 191-204.
[7] COCOLIN L, DOLCI P, RANTSIOU K, et al. Lactic acid bacteria ecology of three traditional fermented sausages produced in the North of Italy as determined by molecular methods[J]. Meat Science, 2009, 82(1): 125-132.
[8] 张兰威, 王静, 郑冬梅. 接种乳酸菌风干香肠脂肪及游离脂肪酸变化规律[J]. 东北农业大学学报, 2001, 32(2): 105-110.
[9] CAGNO R D, LOPEZ C C, TOFALO R, et al. Copmarison of the compositional, microbiological, biochemical and volatile profile characteristics of three Italian PDO fermented sausages[J]. Meat Science, 2008, 79(2): 224-235.
[10] 蒋云升. 如式香肠用发酵剂多菌种混培养技术的研究[J]. 食品科学, 2008, 29(8): 410-413.
[11] 佘珠花. 气相色谱法中油脂脂肪酸衍生化方法及其选择[J]. 粮食加工, 2004(6): 64-66.
[12] VESTEGARD C S, SCHIVAZAPPA C, VIRGILI R. Lipolysis in dry cured ham maturation[J]. Meat Science, 2000, 55: 1-5.
[13] 焦兴弘. 乳酸菌在肉制品加工过程中的应用[J]. 畜牧兽医科技信息, 2008(2): 1-2.
[14] 于长青, 张丽娜. 发酵牛肉香肠中菌相变化和理化特性的研究[J].食品科学, 2009, 30(3): 58-61.
[15] LARROUTURE R, LEROY S, LEBERT I, et al. Safety improvement and preservation of typical sensory qualities of traditional dry fermented sausages using autochthonous starter cultures[J]. International Journal of Food Microbiology, 2008, 126: 227-234.
[16] GARCIA-VARONA M. Characterisation of Micrococcaceae isolated from different varietiesof chorizo[J]. International Journal of Food Microbiology, 2005, 54: 189-195.
[17] BECK H C, HANSEN A M, LAURITSEN F R. Catabolism of leucine to ranched-chain fatty acids in Staphylococcus xylosus[J]. Journal of Applied Microbiology, 2004, 96: 1185-1193.
[18] HIEIRRO E, de la HOZ L, ORDONEZ J A. Contribution of microbial and meat endogenous enzymes to the lipolysis of dry fermented sausages[J]. Journal of Agricultural and Food Chemistry, 1997, 45: 2989-2995.
[19] LIZASO G, CHASCO J. Microbiological and biochemical changes during ripening of salchichon, a Spanish dry cured sausage[J]. Food Microbiology, 1999, 16: 219-228.
[20] 王世宽, 许艳丽, 于海光, 等. 混合菌种用于发酵香肠中的研究[J].中国农学通报, 2010, 26(3): 77-80.
Effect of Starter Cultures on Changes in Free Fatty Acids in Dried Rabbit Meat Slice
CHEN Jian, JIANG Yun-sheng*, YAN Ting-ting
(College of Food Science and Engineering, Yangzhou University, Yangzhou 225127, China)
In this paper, Lactobacillus plantarum, Staphylococcus xylosus and Debaryomyces hansenii were separately inoculated into rabbit meat. Dried meat slice was prepared after fermentation and drying. The effect of these three strains on changes in free fatty acids in dried rabbit meat slice was investigated. Total free fatty acid content in fermented rabbit meat was higher than in the non-fermented one, and followed the decreasing order in three starter culture groups: Staphylococcus xylosus > Dabaryomyces hansenii > Lactobacillus plantarum. This finding implies that addition of three starter cultures facilitates fat decomposition in dried rabbit slice in this decreasing order to generate free fatty acids, resulting in increased or decreased contents of fatty acids. The contents of total free fatty acids and individual fatty acids were higher in rabbit meat fermented with a mixture of Lactobacillus plantarum, Staphylococcus xylosus and Debaryomyces hansenii at a mass ratio of 1:4:1 than in single-strain fermented and non-fermented rabbit meat, suggesting that mixed-strain fermentation has a stronger ability to decompose fats into free fatty acids.
dried rabbit meat slice; mixed-strain fermentation; free fatty acid
TS251.54
A
1002-6630(2014)11-0174-05
10.7506/spkx1002-6630-201411035
2013-06-16
江苏省科技厅科技支撑计划项目(BE2012139)
陈剑(1977—),男,讲师,硕士,研究方向为食品卫生与营养学。E-mail:lypr@yzu.edu.cn
*通信作者:蒋云升(1962—),男,教授,本科,研究方向为食品生物技术。E-mail:jysqd62@163.com

