分散固相萃取-气相色谱法快速测定茶叶中27 种常见含卤素农药残留
鲍治帆,官兴丽,谢吉林,吴晓刚,张 偎,肖海军
(大益集团勐海茶业有限责任公司技术中心实验室,云南 勐海 66 6200)
分散固相萃取-气相色谱法快速测定茶叶中27 种常见含卤素农药残留
鲍治帆,官兴丽,谢吉林,吴晓刚,张 偎,肖海军*
(大益集团勐海茶业有限责任公司技术中心实验室,云南 勐海 66 6200)
采用分散固相萃取-气相色谱法对茶叶中27 种含卤素农药残留量进行测定。经丙酮-正己烷(l:1,V/V)提取后,直接加入无水硫酸钠、硅镁型吸附剂及活性炭净化,使用DB-17毛细管气相色谱柱、微电子捕获检测器,对茶叶中27 种含卤素农药残留量进行测定。该方法样品平均加标回收率为82.2%~113.4%,相对标准偏差为1.2%~6.0%;茶叶中27 种含卤素农药多残留检出限为0.005~0.075 mg/kg。
茶叶;农药残留;分散固相萃取;气相色谱-电子捕获检测器
随着中国社会的快速发展,人民生活水平日益提高,食品安全问题也越来越多的受到了社会的关注。作为中国传统饮品的茶叶,农药残留问题无疑也成为食品安全中的焦点,直接影响我国茶叶的出口[1-2]。目前国内茶叶种植未能做到完全不施用农药,茶农在农药的使用上也存在不科学或滥用的情况,一定程度上会造成成品茶农药残留超标[3]。
农药按用途可分为杀虫剂、杀螨剂、杀软体动物剂、杀菌剂等,按来源可分为矿物源农药、生物源农药和化学合成农药等,化学合成的农药主要为有机磷、氨基甲酸酯、拟除虫菊酯和有机氯化合物等[4]。其中,茶叶中有机氯和拟除虫菊酯类农药残留的研究国内外均有报道[5-9]。农药残留检测技术一直都是国内外研究的热点,而样品前处理方法较为关键[10-12]。目前茶叶农残的提取方法有固相萃取法、超临界流体提取法、固相微提取法、微波辅助提取法、加速溶剂提取法、基质固相分散提取法,以及凝胶渗透层析等[10,13]。检测方法有气相色谱、气质联用、高效液相色谱、液质联用等[13]。由于国内多项茶叶农残检测标准方法需使用固相萃取小柱或填充柱对样品提取液进行净化,导致检测用时较长,成本较高,不适用于日常大批量检测[14-16]。本实验以固相萃取法(solid phase extraction,SPE)作为样品前处理方法,但净化过程未使用固相萃取小柱,着重从改善日常检测效率和降低检测成本入手,开发出一种快速准确检测茶叶农药残留的分散固相萃取-气相色谱法检测方法以满足茶叶品质控制批量检测的需要。
1 材料与方法
1.1 材料与试剂
晒青毛茶 市购;活性炭(粉状分析纯,用3.0 mol/L的盐酸浸置过夜,蒸馏水洗涤至中性,于90 ℃将水分蒸干,110 ℃恒温3 h,备用[17]);硅镁型吸附剂(60~100 目白色细分,分析纯,在600~650 ℃灼烧3 h。用前于130 ℃烘5 h,储存于干燥器内备用);无水硫酸钠(在700 ℃灼烧4 h,用前于130 ℃烘5 h,储存于干燥器内备用[18]);乙腈(色谱纯) 美国Tedia公司;丙酮、正己烷(色谱纯) 美国Fisher Scientific公司。
标准物质:除虫脲、氟铃脲、氟虫脲、α-六六六、β-六六六、γ-六六六、δ-六六六、三唑酮、氟菌唑、α-硫丹、β-硫丹、硫丹硫酸盐、p’p,-DDT、p’p,-DDE、o’p,-DDT、p’p,-DDD、戊唑醇、三氯杀螨醇、联苯菊酯、甲氰菊酯、氯氟氰菊酯、氯菊酯、氟氯氰菊酯、氟氰戊菊酯、氰戊菊酯、苯醚甲环唑、溴氰菊酯购自农业部环境质量监督检验测试中心,质量浓度均为100 μg/mL,以正己烷作溶剂把标准物质配制成10 μg/mL的混合标准储备液,存于0~4 ℃冰箱。
1.2 仪器与设备
7890A气相色谱仪附电子捕获检测器、DB-17毛细管柱 美国Agilent公司;回旋振荡器 国华电器有限公司;氮吹仪 北京帅恩科技有限责任公司;漩涡混合器海门麒麟贝尔仪器制造有限公司;低速离心机 安徽中科中佳科学仪器有限公司;高效粉碎机、茶叶筛分机上海嘉定粮油仪器有限公司。
1.3 方法
1.3.1 样品前处理
1.3.1.1 制备
选取具代表性茶叶样品200 g,用粉碎机粉碎并通过1.0 mm圆孔筛,混匀待检。
1.3.1.2 提取
称取已制备好的茶样1.000 g于10 mL塑料离心管中,加入5 mL丙酮-正己烷(l:1,V/V)振荡提取15 min后移入离心机,以4 500 r/min的转速离心5 min,将上清液移入另一根10 mL塑料离心管,残渣再用相同方法提取一次,合并上清液。
1.3.1.3 净化
在合并后的上清液中分别加入1 g弗洛里硅土粉末,1 g活性炭粉末和3 g无水硫酸钠,于涡旋混合器涡旋2 min,再以4 500 r/min的转速离心5 min,取上清液于试管中,残渣用10 mL丙酮清洗一次再次离心合并上清液,用氮吹仪吹干,加入正己烷至1 mL,供气相色谱分析。
1.3.2 色谱条件
色谱柱:DB-17(30 m×0.32 mm,0.25 μm);色谱柱温度:80 ℃保持1 min,然后以30 ℃/min升温至180℃,再以3 ℃/min升温至205 ℃保持4 min,再以20 ℃/min升温至290 ℃保持2 min;载气:氮气(纯度≥99. 999%),流速3 mL/min;进样口温度:260 ℃;进样量:1 μL;进样方式:无分流进样;检测器温度:320 ℃。
2 结果与分析
2.1 样品前处理条件
2.1.1 提取溶剂的选择
茶叶农药残留检测提取溶剂常有丙酮、乙腈、正己烷、乙酸乙酯、二氯甲烷、甲苯等,不同溶剂对农残的提取效率有很大区别,而有机氯和拟除虫菊酯类农药在乙腈、丙酮、正己烷中均有较高的溶解度[19-20]。为了提高提取效率,分别选择乙腈、丙酮、丙酮-正己烷(l:1,V/V)作为提取剂,进行回收率对比实验,结果见图1。使用丙酮提取的回收率要优于其他两种溶剂,均达82.89%以上,但是,由于丙酮极性较强,大量杂质也随之提出,会给净化带来一定困难。而乙腈提取的杂质等干扰物质较少,但实际提取效率较低,故选择丙酮-正己烷(l:1,V/V)作为前处理的提取溶剂。
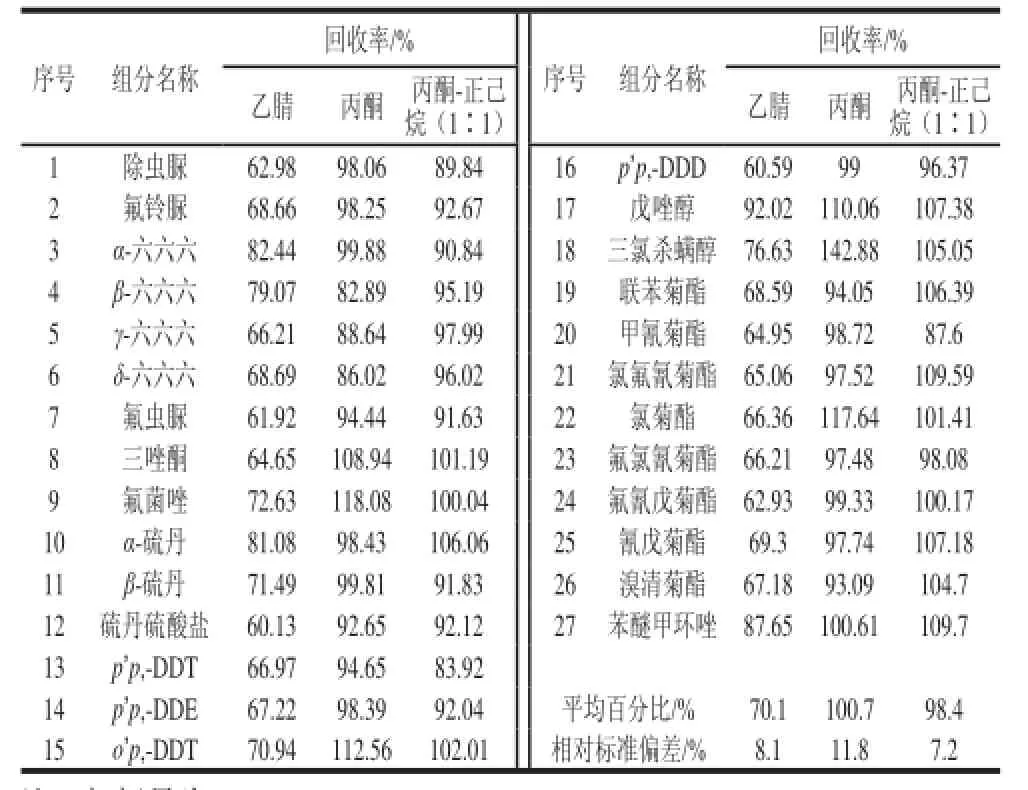
表1 提取溶剂的选择Table1 Effect of extract solvent type on the recoveries of organochlorine and pyrethroid pesticide residues
2.1.2 净化吸附剂及洗脱溶剂的选择
目前茶叶净化一般使用活性炭小柱、弗洛里硅土小柱以及TPT小柱等[19],实质上是运用了不同填充材料的吸附性不同。本实验使用无水硫酸钠除水分、活性炭及弗洛里硅土作为净化吸附剂,但并未填充到小柱中,而是直接添加到提取液中,除了能够有效的排除色素等杂质的干扰,还能节约成本提高检测效率。
溶剂对净化吸附剂的脱附效果是检测准确率的关键因素之一。本实验对乙腈、丙酮、丙酮-正己烷(l:1,V/V)3 种常用洗脱溶剂的脱附效果进行了对比,结果如表2所示。乙腈脱附后的回收率在43.75%~105.23%之间,氟虫脲等农残的回收率较低,丙酮-正己烷(l:1,V/V)及丙酮脱附后的回收率较高,分别为68.26%~109.58%和88.47%~116.71%。因此,选择丙酮作为脱附溶剂。
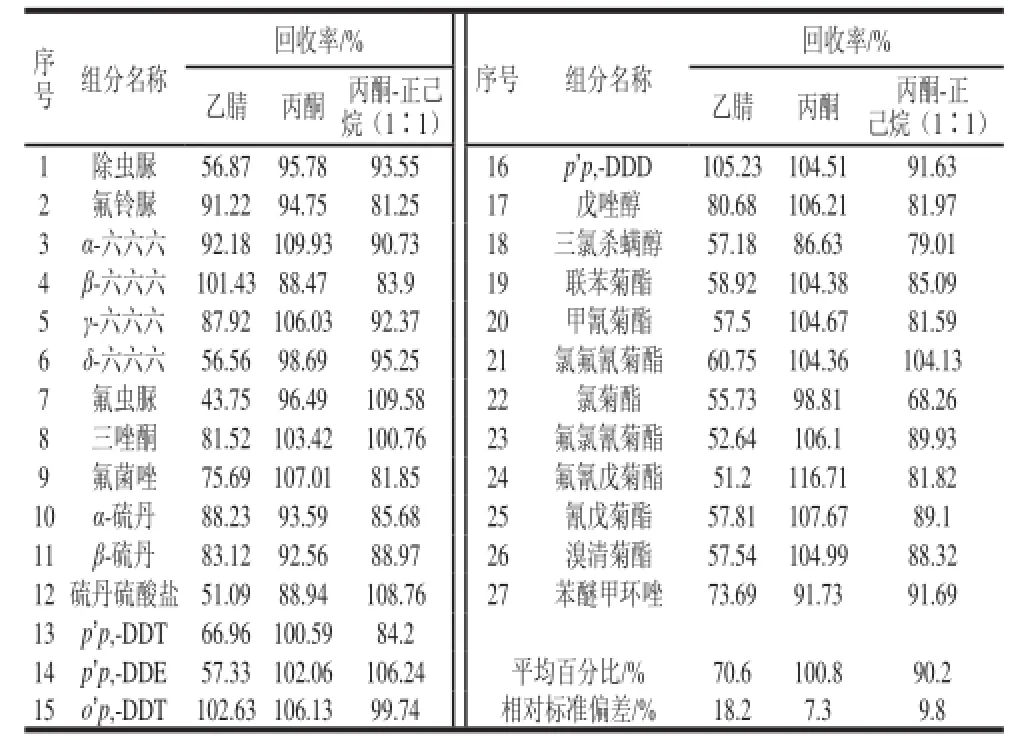
表2 脱附溶剂的选择Table2 Effect of desorption solvent type on the recoveries of organochlorine and pyrethroid pesticide residues
2.2 色谱图及色谱条件的确定
2.2.1 色谱图

图1 混合标准工作液气相色谱图Fig.1 GC chromatogram of mixed standards
用正己烷将上述混合标准储备液稀释成质量浓度为1.0 μg/mL的混合标准工作液,在1.3.2节色谱条件下进样,得到标准品色谱图如图1所示。本方法对所有检测项目的响应良好,分离度较高。
2.2.2 色谱条件的确定
使用不同升温程序对混合标准工作液的进样谱图进行对比,分别对一阶升温程序:80 ℃保持1 min,然后以20 ℃/min升温至290 ℃,保持11.5 min;二阶升温程序:80 ℃保持1 min,然后以30 ℃/min升温至205 ℃,保持4 min,再以20 ℃/min升温至290 ℃保持9.5 min;三阶升温程序:80 ℃保持1 min,然后以30 ℃/min升温至180 ℃,再以3 ℃/min升温至205 ℃保持4 min,再以20 ℃/min升温至290 ℃保持2 min进行对比。各条件下的混合标准工作液谱图经过比较后,发现采用三阶升温程序可以使各目标峰分离度相对于一阶和二阶较为理想,满足农残检测要求,所以本方法采用三阶升温进行检测。
2.3 标准曲线及方法检出限
为了使检测结果更为准确检测范围更广,本方法在建立标准曲线时采用了12 个质量浓度梯度(为排除茶叶基质效应干扰,使用茶叶空白基质配备标准溶液),分别为2.000、1.333、1.000、0.667、0.500、0.333、0.250、0.167、0.125、0.084、0.063、0.042 μg/mL。以峰面积和质量浓度为变量,经仪器制作标准曲线,27 种农药其线性范围、线性方程、相关系数和方法检出限(以3 倍信噪比计算得出)见表3。相关系数及检出限均达到了农药残留检测的要求。
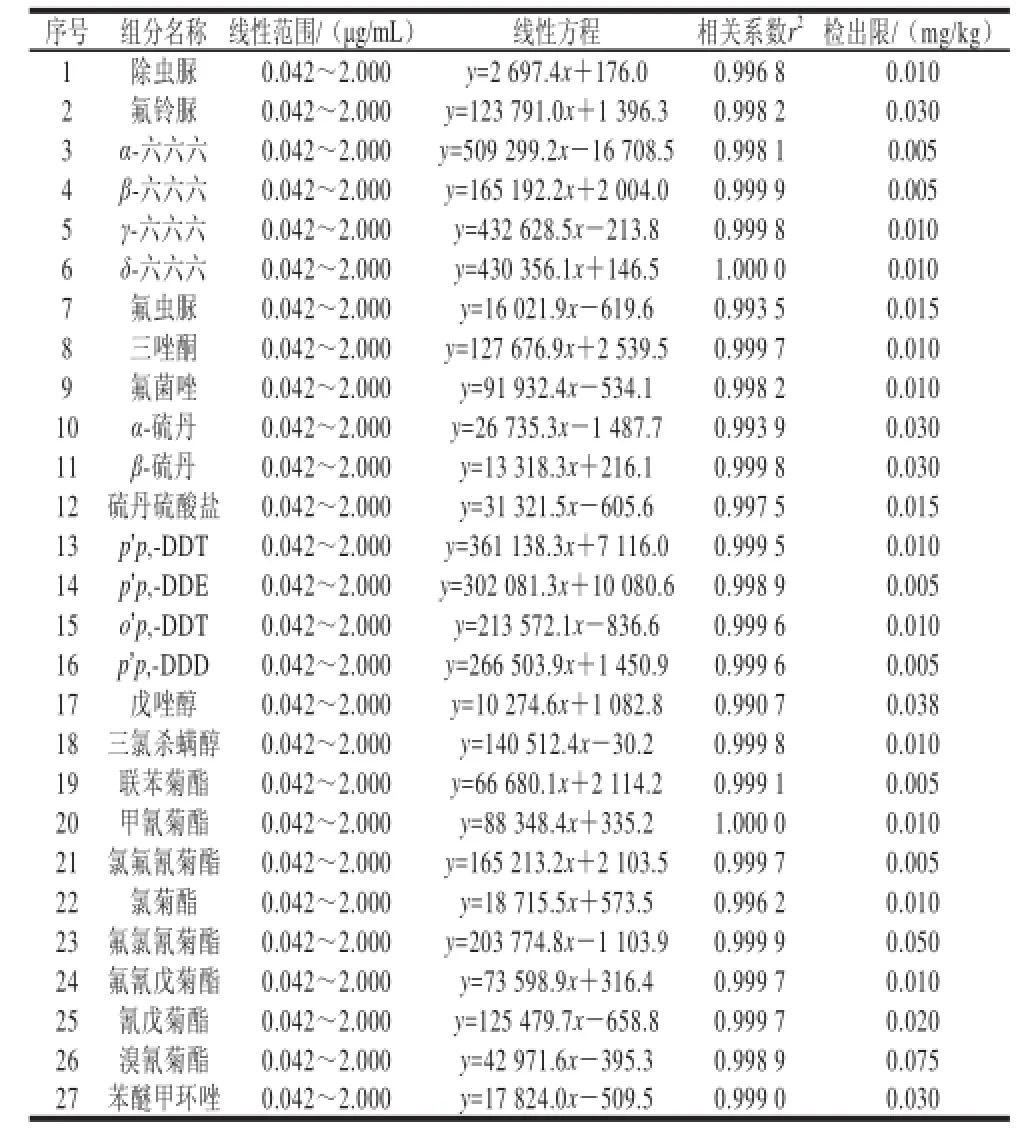
表3 线性方程、相关系数及检出限Table3 Linear equationwith and limit of detection for organochlorine and pyrethroid pesticides
2.4 加标回收率及精密度检测
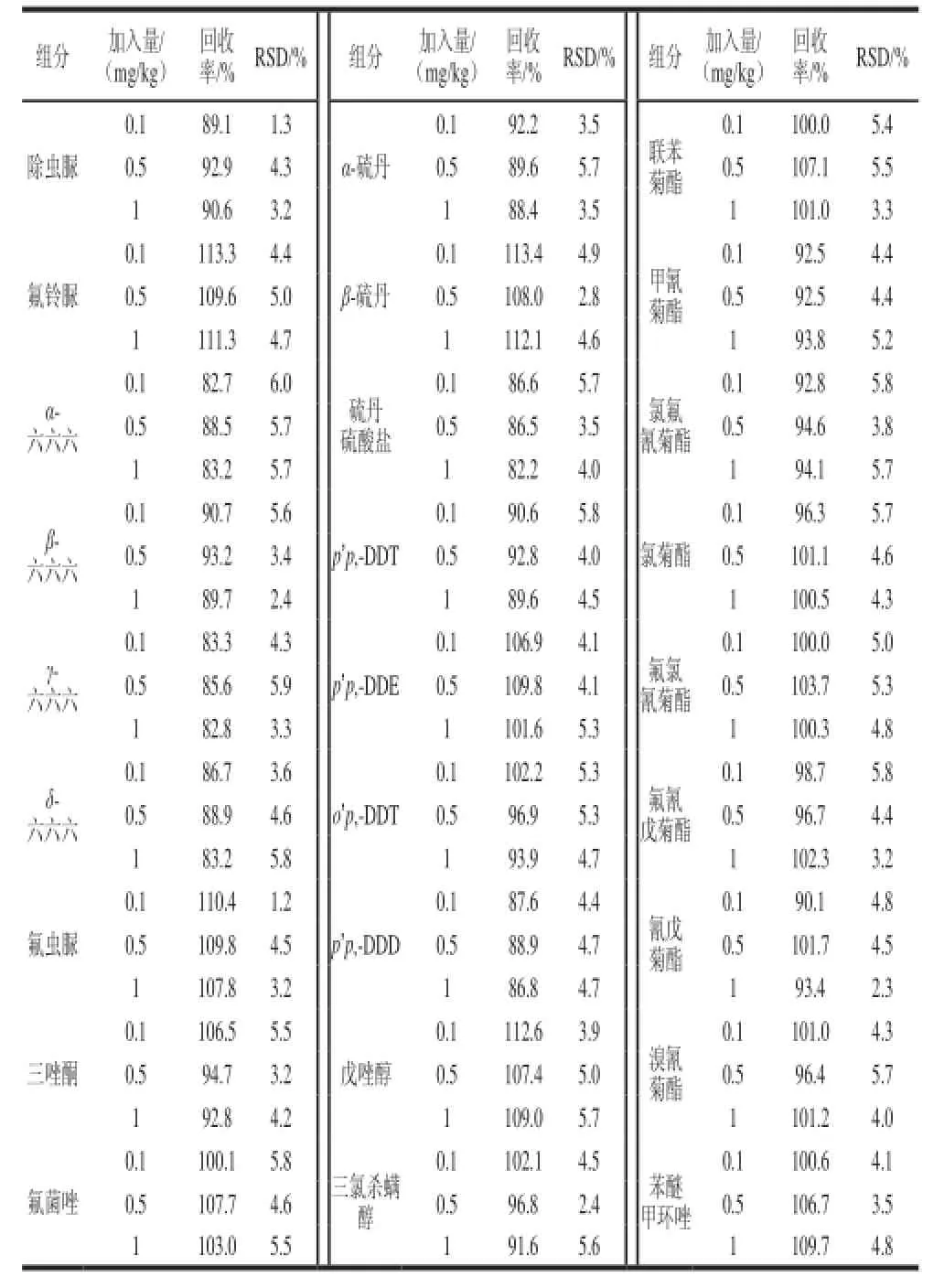
表4 加标回收率及精密度Table4 Recoveries and precision (RSDs) of organochlorine and pyrethroid pesticides
图2 空白茶样谱图Fig.2 Chromatogram of blank sample

图3 加标0.1 mg/kg茶样谱图Fig.3 Chromatogram of spiked sample (0.1 mg/kg)
称取相同的3份茶样作为基质,分别用移液枪添加质量浓度为0.10、0.50、1.00 μg/mL的混合标准工作液至茶样中,充分混匀后用上述方法进行检测,每个样品平行检测6次,结果如表4所示。该方法样品平均加标回收率为82.2%~113.4%,相对标准偏差为1.2%~6.0%加标回收率及精密度完全达到了农药残留检测的要求,空白茶样及加标0.1 mg/kg茶样色谱图见图2、3。
2.5 样品检测
为更好的验证方法的实用性,用此方法对3 个从市场上购买的晒青毛茶样品(分别编号为A、B、C)进行了农药残留检测,检测结果如表5所示,检测谱图选取了A样品的谱图如图4所示。
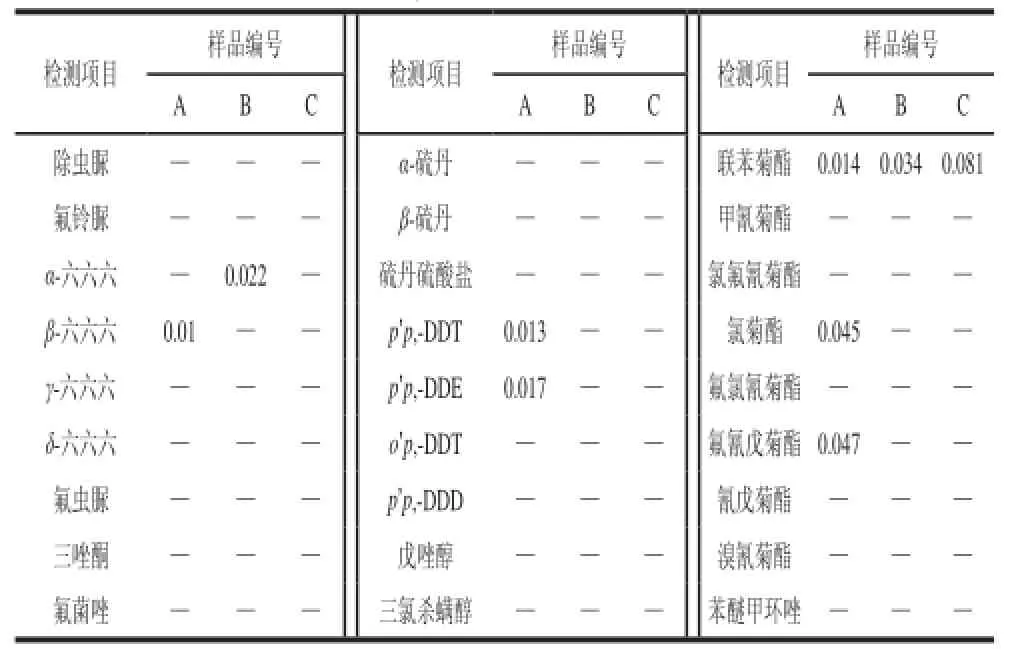
表5 样品检测结果Table5 Analytical results of real samples
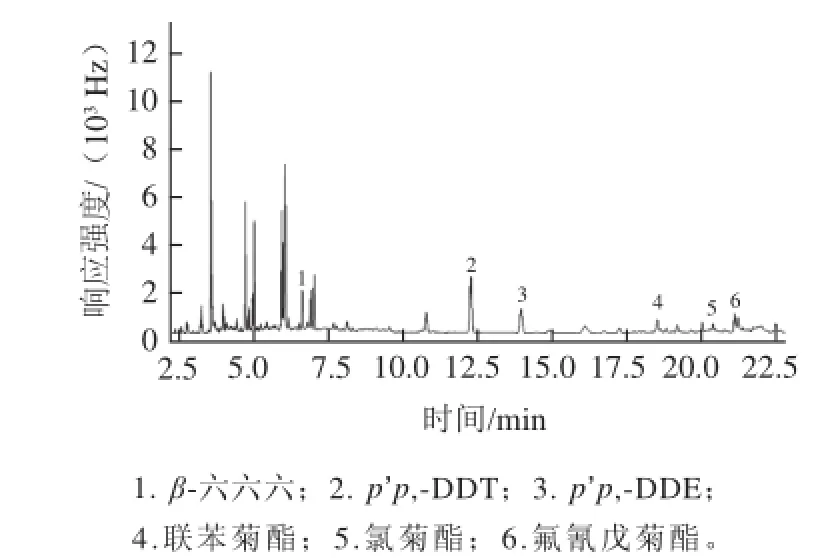
图4 A样品检测谱图Fig.4 Chromatogram of sample A
3 结 论
该方法样品平均加标回收率为82.2%~113.4%,相对标准偏差为1.2%~6.0%;茶叶中27 项含卤素农药多残留检出限为0.005~0.075 mg/kg。该方法检测茶叶中27 种常见含卤素农药残留分离度高、灵敏度好、回收率理想、操作简单快速、节约成本、同时检测的项目多,能够满足实验室日常批量检测的要求。
农药残留的检测方法发展至今已经有成千上万种,但是运用色谱或质谱检测农残的方法前处理一般都以提取净化为主,必要的时候还需要使用一些其他手段来达到检测目的,比如衍生等。检测成本或检测效率与前处理方法有着直接的联系。该固相萃取法的优点在于净化时无需使用固相萃取小柱或者填充净化柱,有效的节省了过柱子的时间和浓缩的时间,降低了购买固相萃取小柱的成本并提高了检测效率。
[1] 袁自春, 杨普, 彭邦发, 等. 中国茶叶品质危害因素分析及对对策研究进展[J]. 食品科学, 2013, 34(5): 297-302.
[2] 钱贵普. 欧盟再加强农残检测茶、柚出口或受影响[J]. 世界热带农业信息, 2013(4): 25.
[3] 王岳飞. 中国茶叶总体安全 消费者可放心饮用: 全面、客观、正确认识中国茶叶农残问题[J]. 中国茶叶, 2012(5): 1.
[4] 陈瑶. 茶叶中农药残留的检测[J]. 江苏调味副食品, 2010, 27(6): 7-10.
[5] BISHNU A, CHAKRABATI K, CHAKRABORTY A, et al. Pesticide residue level i n tea ecosystems of Hill and Dooars regions of West Bengal, India[J]. Environmental monitoring assessment, 2009, 149(1/4): 457-464.
[6] LIU D, MIN S. Rapid analysis of organochlorine and pyrethroid pesticides in tea samples by directly suspended droplet microextraction using a gas chromatography-electron capture detector[J]. Journal of ChromatographyA, 2012, 1235: 166-173.
[7] KOBAYASH M, OHTSUKA K, TAMURA Y, et al. Survey of pesticide residues in imported tea[J]. Shokuhin Eiseigaku Zasshi, 2013, 54(3): 224-231.
[8] 陈红平, 刘新, 汪庆华, 等. 气相色谱-质谱法同时测定茶叶中72 种农药残留量[J]. 食品科学, 2011, 32(6): 159-164.
[9] 董金斌, 王金花. 气相色谱-质谱法测定茶叶中32 种残留农药[J]. 食品科学, 2009, 30(12): 230-232.
[10] 郭防. 茶叶中农药残留检测的样品前处理研究进展[J]. 微量元素与健康研究, 2012, 29(1): 61-64.
[11] CHEN Z M, WANG Y H. Chromatographic methods for the determination of pyrethrin and pyrethroid pesticide residues in crops, foods and environmental samples[J]. Journal of Chromatography A, 1996, 754(1/2): 367-395.
[12] HUANG Z, LI Y, CHEN B, et al. Simultaneous determination of 102 pesticide residues in Chinese teas by gas chromatography-mass spectrometry[J]. Journal of Chromatography B, 2007, 853(1/2): 154-162.
[13] 朱旭君, 侯如燕. 茶叶农药残留分析的研究进展[C]//2007年全国茶业科技学术研讨会论文集. 浙江: 中国茶叶学会出版社, 2007: 414-425.
[14] 蒋俊树, 赵成仕, 舒勇, 等. GB/T 23376—2009 茶叶中农药多残留测定气相色谱/质谱法[S]. 北京: 中国标准出版社, 2009.
[15] The European Communitiesl. Commission Decision of 12 August 2002 implementing Council Directive 96/23/EC concerning the performance of analytical methods and the interpretation of results[J]. Official Journal of the European Communities, 2002, L221: 8-36.
[16] 丁慧瑛, 谢文, 蒋晓英, 等. SN/T 1117—2008 进出口食品中多种菊酯类农药残留测定方法气相色谱法[S]. 北京: 中国标准出版社, 2009.
[17] 叶江雷, 弓振斌, 沈爱斯. 茶叶中9 种农药 残留的毛细管气相色谱法测定[J]. 分析仪器, 2005(2): 20-23.
[18] 岳永德. 农药残留分析[M]. 北京: 中国农业出版社, 2004: 3-4.
[19] 刘先华, 陶玉贵, 魏胜华. 气相色谱法测定茶叶中有机磷农药残留量的研究[J]. 科技文汇, 2010(7): 130-131.
[20] 蒋俊树, 赵彬, 周莉. 气相色谱-质谱法测定茶叶中36 种农药残留量[J].食品科学, 2009, 30(14): 276-280.
Rapid Determination of 27 Kinds of Common Halogen-Containing Pesticide Residues in Tea by Dispersive Solid-Phase Extraction and Gas Chromatography
BAO Zhi-fan, GUAN Xing-li, XIE Ji-lin, WU Xiao-gang, ZHANG Wei, XIAO Hai-jun*
(Laboratory of Technology Center, Menghai Tea Industry Limited Liability Company, Menghai 666200, China)
Residues of 27 kinds of common halogen-containing pesticides in tea were determined by dispersive solidphase extraction and gas chromatography. Tea samples were extracted with acetone-hexane (l:1, V/V) and the extracts were purified by adding anhydrous sodium sulfate, florisil and activated carbon. The purified extracts were separated on a DB-17 capillary column, and detected with an electron capture detector (ECD). The average recovery of standard addition was 82.2%–113.4% with relative standard deviation of 1.2%–6.0% in tea samples by this method. The limit of detection for 27 kinds of common halogen-containing pesticide residues in tea was 0.005–0.075 mg/kg.
tea; pesticide residues; dispersive solid-phase extraction; gas chromatography-electron caputure detector
TS207.3
A
1002-6630(2014)10-0174-05
10.7506/spkx1002-6630-201410033
2013-08-05
云南省企业技术中心创新能力建设项目(2009D1037)
鲍治帆(1988—),男,助理工程师,学士,研究方向为普洱茶食品安全。E-mail:baozhifan@126.com
*通信作者:肖海军(1978—),男,工程师,硕士,研究方向为普洱茶发酵与保健功能。E-mail:xiaobing781218@163.com

