山梨酸纳米防腐颗粒的制备、表征及其缓释性能
武 陶,丁 武
(西北农林科技大学食品科学与工程学院,陕西 杨凌 712100)
山梨酸纳米防腐颗粒的制备、表征及其缓释性能
武 陶,丁 武*
(西北农林科技大学食品科学与工程学院,陕西 杨凌 712100)
为扩大山梨酸在肉品保鲜上的应用范围,克服其水溶性差的缺陷,采用离子凝胶法制备山梨酸壳聚糖纳米防腐颗粒。以颗粒粒径与包封率为参考指标,通过单因素及正交试验考察壳聚糖质量浓度、三聚磷酸钠质量浓度、交联时间、山梨酸质量浓度、搅拌时间等因素对颗粒粒径与包封率的影响,确定最优制备工艺。通过傅里叶变换红外光谱,透射电镜对颗粒进一步表征,并考察其体外释放性能。结果表明,制备山梨酸壳聚糖纳米粒的最佳工艺为壳聚糖质量浓度1 mg/mL、三聚磷酸钠质量浓度0.5 mg/mL、交联时间30 min、山梨酸质量浓度 1 mg/mL,该条件下山梨酸颗粒平均粒径为337.2 nm,包封率为74.3%;红外光谱表明壳聚糖与山梨酸静电吸附,山梨酸被包封;透射电镜图表明所制颗粒大小均匀,呈规则球形;缓释实验表明:24 h山梨酸的释放量为50%,纳米防腐颗粒具有一定的缓释特性。
山梨酸;纳米颗粒;优化;表征
纳米颗粒是运用纳米技术将物质制作成粒径大小在1~100 nm之间的粒子,具有表面效应、体积效应、量子尺寸效应等特性,目前,纳米技术应用广泛,它能够给农业以及食品业带来全新的思路与方法。将食品材料纳米化,可使一些宏观尺度特征发生改变,包括质构、风味、加工性能以及货架期的稳定性等[1]。因此纳米材料在生物技术、医药卫生、食品工业等领域大放异彩[2]。
壳聚糖是甲壳素脱乙酰化的产物,是一类由2-氨基-2-脱氧葡萄糖通过β-1,4糖苷键连接而成的带正电荷直链多糖。壳聚糖无毒、无刺激性,具有良好的生物相容性和生物可降解性。基于其微小的颗粒尺寸,壳聚糖纳米颗粒可以通过毛细血管而穿透组织,此特征为活性物质在体内的递送提供了保证[3-5]。因而壳聚糖纳米粒作为活性物质的载体受到了广泛的关注[6]。
壳聚糖纳米粒的主要制备方法包括共价交联、沉淀析出、大分子复合、自组装构筑和离子凝胶法等[3]。与其他方法相比,离子凝胶法能在温和条件下生成粒径几十至数百纳米的壳聚糖纳米粒,不需使用有机溶剂和醛类交联固化剂,反应过程简便迅速,极具实用价值[7]。该法首先由Bodmeier等[8]提出,后经Calvo等[9]改进。其基本原理为:壳聚糖(chitosan, CS)为聚阳离子电解质,当它与带相反电荷的三聚磷酸钠(sodium tripolyphosphate,TPP)作用时,通过CS的氨基和TPP的磷酸基团之间的静电吸引作用而产生CS/TPP纳米微粒。
山梨酸是国际粮农组织和卫生组织推荐的高效安全的防腐保鲜剂,是一种分子结构特殊的不饱和有机酸类,基于结构的共轭双键,山梨酸的化学反应活性高,易于进行加成、卤代、加氢、脱羧及共聚等多种反应。对于霉菌和酵母的生长有很好的抑制作用[10],但其水溶性较差,限制了其应用范围。目前应用较广的山梨酸类防腐剂为山梨酸钾,但山梨酸钾中的山梨酸根需在酸性环境中结合H+转变为山梨酸的形式才能发挥其防腐作用,在碱性或者中性条件下几乎无效。因此,制备山梨酸纳米防腐颗粒是改善山梨酸的分散性,使山梨酸直接发挥作用,扩大其应用范围的一种手段。
本实验选择山梨酸作为被包封活性物质,通过离子凝胶法形成山梨酸壳聚糖纳米粒,考察影响山梨酸颗粒形成的主要因素,通过正交试验优化制备工艺,检测其包封率,分析其体外释放性能,以期使山梨酸以纳米粒的形式直接发挥其抗菌防腐作用。
1 材料与方法
1.1 材料与试剂
壳聚糖(脱乙酰度≥95%) 上海阿拉丁试剂有限公司;TPP、山梨酸、HAc(均为分析纯);蒸馏水;超纯水。
1.2 仪器与设备
85-2恒温测速磁力搅拌器 金坛荣华仪器制造公司;LGJ-10D冷冻干燥机 北京四环科学仪器厂有限公司;UV-2500紫外分光光度计 日本岛津公司;Malvern Zetasizer Nano ZS90激光粒度分析仪 英国马尔文仪器有限公司;HT7700透射电子显微镜 日立高新技术公司;Vetex 70 FTIR傅里叶变换红外光谱仪 德国布鲁克公司。
1.3 方法
1.3.1 山梨酸纳米颗粒的制备
称取适量的CS粉末,室温下溶于1% HAc溶液,用NaOH调pH值为5,0.45 μm微孔滤膜过滤,后在室温下搅拌过夜,形成5 mg/mL的壳聚糖溶液。根据试验设计,将CS溶液用超纯水稀释到不同质量浓度,交联剂TPP溶于超纯水,用0.45 μm微孔滤膜过滤。配成0.5 mg/mL TPP溶液。量取一定量的CS溶液加入三角瓶中,放入转子,置于恒温磁力搅拌器上,逐滴滴加TPP溶液,滴加速率为2~3滴/s,室温下搅拌30 min(600 r/min),溶液经阴阳离子静电作用交联成CS/TPP微粒,作为空白对照。
称取适量山梨酸粉末,溶于乙醇,按照实验设计配成不同质量浓度梯度的溶液,缓慢逐滴将其加入CS溶液中,室温下温和搅拌30 min(600 r/min),后逐滴加入TPP溶液,同前温和搅拌30 min,CS与TPP的质量比为5:1,形成山梨酸壳聚糖纳米颗粒[11]。
1.3.2 单因素试验
搅拌速率600 r/min、CS质量浓度2 mg/mL、TPP质量浓度1.5 mg/mL、CS与TPP质量比5:1、CS与TPP交联时间30 min、 山梨酸质量浓度0.3 mg/mL,固定以上条件,考察单一因素影响,分别考察CS质量浓度(1.0、1.5、2.0、2.5、3.0、3.5 mg/mL)、TPP质量浓度(0.5、1.0、1.5、2.0、2.5、3.0 mg/mL)、搅拌速率(400、500、600、700、800 r/min)、交联时间(10、20、30、40、50、60 min)山梨酸质量浓度(0.3、0.5、1.0、1.5、2.0 mg/mL)对山梨酸壳聚糖纳米颗粒粒径及包封率的影响。
1.3.3 正交试验
根据山梨酸壳聚糖纳米颗粒的制备条件,选取CS质量浓度、TPP质量浓度、交联时间和山梨酸质量浓度,进行四因素三水平正交试验,每个重复3 次,取均值,考察因素水平见表1。

表1 正交试验因素与水平Table1 Factors and levels used in orthogonal array design
1.3.4 山梨酸壳聚糖纳米粒平均粒径及表面外观的测定
平均粒径的测定:将交联一定时间的胶体溶液通过超声波分散仪在25 ℃条件下分散60 min,冷却后用电位分析仪测定其水力学半径以及分散度[12]。
表面外观测定:通过透射电子显微镜观察纳米粒的形态:取一滴悬浮液,用2%的磷钨酸复染1.5~2 min,后将其置于铺有碳支持膜的铜网上,使其自然风干。待完全干燥后,置于样品台上,观察其形态[13]。
1.3.5 纳米颗粒的红外光谱分析
利用傅里叶变换红外光谱检测CS、CS/TPP以及山梨酸壳聚糖纳米颗粒化学结构的变化。
取适量CS粉末,以及冻干的CS/TPP与山梨酸壳聚糖纳米颗粒粉末,分别与KBr混合压片,测定其红外光谱[14]。
1.3.6 山梨酸壳聚糖纳米粒的包封率

采用膜分离方法测定游离山梨酸的含量[11],将山梨酸壳聚糖纳米悬浮液置于超滤离心管中,4 000×g离心40 min,游离山梨酸进入外层离心管中,在254 nm处测其吸光度,根据标准曲线确定游离山梨酸的含量。实验重复3 次,取平均值。
1.3.7 山梨酸壳聚糖纳米粒的体外释放性能
山梨酸壳聚糖纳米粒的体外释放实验在P B S(pH 7.4)缓冲溶液中进行[15]。称取一定质量的纳米颗粒(5~10 mg),用2.5~5 mL PBS(pH 7.4)溶液将其重新分散,将分散好的溶液置于经过预处理的截留分子质量为12 kD的透析袋中,封口后,将透析袋置于50 mL PBS溶液中,整个体系保持在37 ℃条件下,100 r/min振摇。每隔一段时间取出4 mL液体,并向体系中补充4 mL新鲜的PBS溶液,保持体系的总体积不变。在254 nm条件下测定其吸光度,通过标准曲线确定释放出的山梨酸含量。实验重复3 次,取平均值。
2 结果与分析
2.1 山梨酸壳聚糖纳米粒制备单因素试验
2.1.1 CS质量浓度对于粒径及包封率的影响
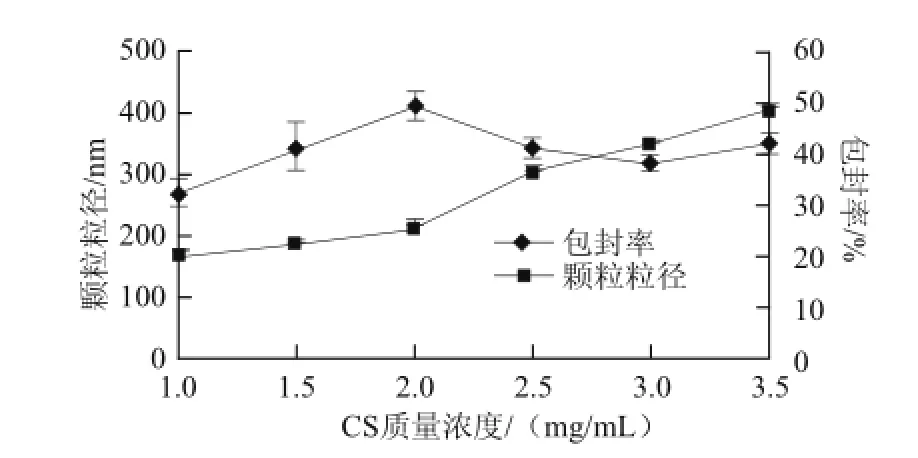
图1 CS质量浓度对颗粒粒径及包封率的影响Fig.1 Effect of CS concentration on particle size and EE
如图1所示,颗粒粒径随CS质量浓度的增加而增大。这是由于随着CS溶液的质量浓度增大,当TPP溶液加入到其中时,过量的CS分子与少量的TPP分子互相交联,单个TPP分子交联多个CS分子,从而增大了颗粒的粒径[16]。同时,随着CS质量浓度的升高,质子化的CS增多,其表面所带正电荷量增多,CS与TPP交联的机会增多,形成的颗粒量增大,而山梨酸在酸性溶液中带负电,因而包封率会有所增大,且在CS质量浓度为2 mg/mL时,有最大包封率48%。
2.1.2 TPP质量浓度对于颗粒粒径及包封率的影响
由图2可得知,当TPP质量浓度较低时,据CS与TPP的质量比,加入TPP的量会增加,TPP的局部质量浓度过高,纳米悬浮液的乳光加重,形成的纳米粒粒径增大。当TPP质量浓度为1.5 mg/mL时,CS与TPP比例搭配合适,形成颗粒粒径最小,且山梨酸能很好的与CS/TPP体系结合,包封率也较高。当TPP质量浓度大于1.5 mg/mL时,颗粒粒径逐渐增大,这可能由于过量TPP分子与少量的CS分子相互交联,使得两者的比例不均,增大了粒径。
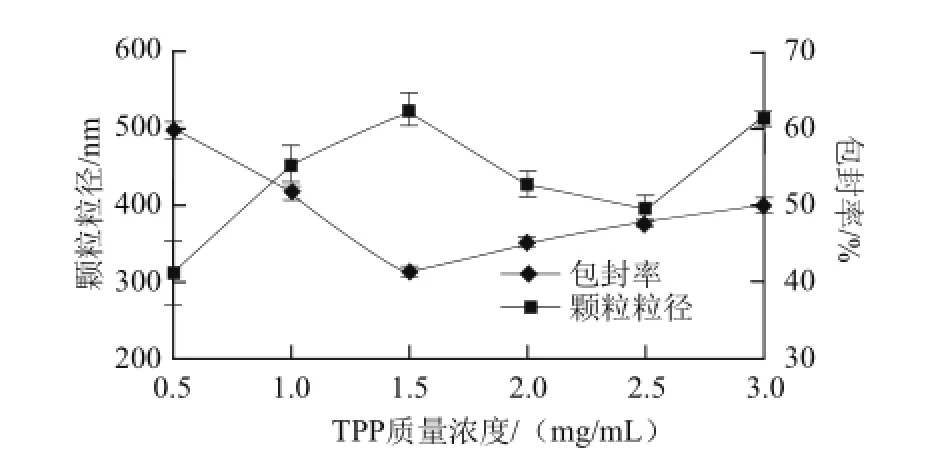
图2 TPP质量浓度对颗粒粒径及包封率的影响Fig.2 Effect of TPP concentration on particle size and EE
2.1.3 搅拌速率对于颗粒粒径的影响
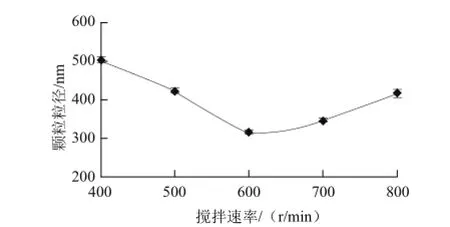
图3 搅拌速率对颗粒粒径的影响Fig.3 Effect of stirring speed on particle size
由图3可得知,当搅拌速率很低时,由于TPP滴加到CS溶液中后,转速不能使其充分分散,造成TPP局部质量浓度过高,颗粒粒径较大。随着搅拌速率的增加,颗粒粒径降低,说明适宜的速率可使滴加到CS中的TPP溶液分散均匀,两者的基团交联更加充分,不会引起过多的凝聚现象,降低了粒径的范围。当搅拌速率为600 r/min时,粒径达到最小值,当转速大于600 r/min时,粒径增大,这可能是高转速所形成的高剪切力使一部分CS、TPP分子的结构破坏,使部分分子不能进行正常的交联,造成分子之间的凝聚而增大了颗粒粒径。
2.1.4 CS与TPP交联时间对颗粒粒径的影响
由图4可知,当交联时间较短时,由于TPP分子没有充分分散,部分凝聚,导致粒径增大。当交联时间为30 min 时,其粒径最小,交联状态达到一个最佳时间状态。当时间大于30 min时,其粒径开始增大,可能是由于随着时间的延长,CS溶液的黏度降低,搅拌状态下,降解速率也会加快,不能与TPP正常交联,导致TPP部分凝聚,粒径增大。
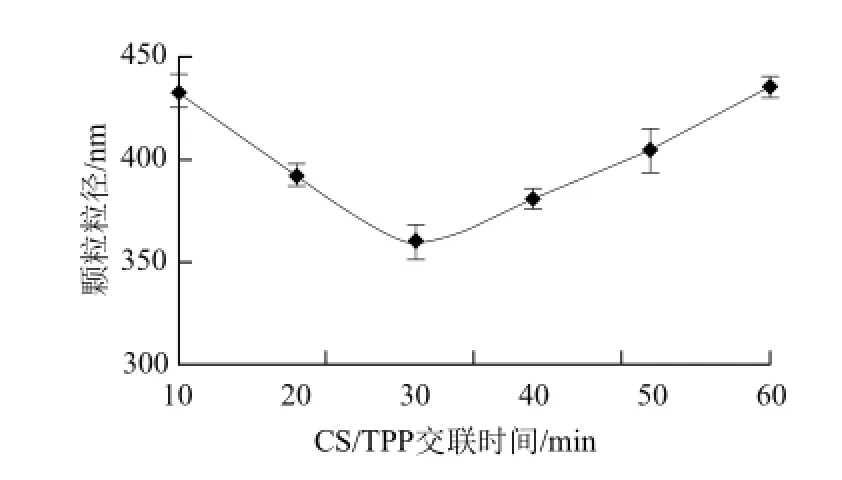
图4 CS/TPP交联时间对颗粒粒径的影响Fig.4 Effect of CS/TPP cross-linking time on particle size
2.1.5 山梨酸质量浓度对颗粒粒径及包封率的影响

图5 山梨酸质量浓度对颗粒粒径及包封率的影响Fig.5 Effect of sorbic acid concentration on particle size and EE
如图5所示,随着山梨酸质量浓度的增大,颗粒粒径呈下降趋势。山梨酸质量浓度增大,则体系中的负电荷会增多,带有负电荷的山梨酸分子与壳聚糖静电吸附作用,促进了山梨酸壳聚糖纳米粒的形成。山梨酸壳聚糖纳米粒的包封率随山梨酸质量浓度的升高而降低,可能的原因是,当山梨酸质量浓度升高时,大量的山梨酸分子仅仅是吸附在了壳聚糖表面,而没有与其形成包附作用,可以通过离心使其与壳聚糖纳米粒分离开,因此,包封率会有所下降。
2.2 正交试验
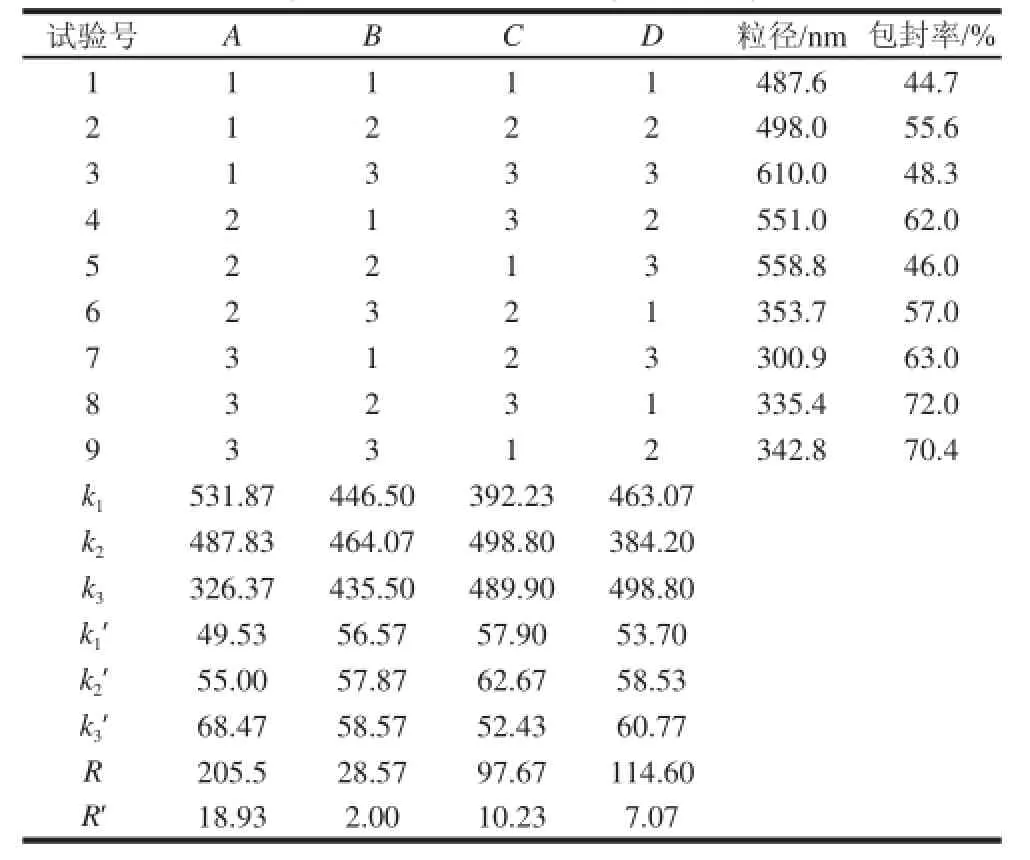
表2 正交试验设计及结果Table2 Design and results of orthogonal array experiments
根据表2可得,各因素对颗粒粒径作用的主次顺序为CS质量浓度>山梨酸质量浓度>交联时间>TPP质量浓度,对包封率作用的主次顺序为CS质量浓度>交联时间>山梨酸质量浓度>TPP质量浓度,按照颗粒粒径越小越好的原则,最优组合为A3B3C1D2,即CS质量浓度1 mg/mL、TPP质量浓度0.5 mg/mL、交联时间20 min、山梨酸质量浓度 0.3 mg/mL,制得的山梨酸颗粒粒径342.8 nm。包封率的最优组合为A3B3C2D3,包封率为74.3%;最终确定最优工艺条件为CS质量浓度1 mg/mL、TPP质量浓度0.5 mg/mL、交联时间30 min、山梨酸质量浓度1 mg/mL,该条件下山梨酸颗粒平均粒径为337.2 nm,包封率为74.3%。
2.3 山梨酸壳聚糖纳米粒的表征
2.3.1 最优条件下制得颗粒的粒径分布

图6 山梨酸壳聚糖纳米粒粒径分布Fig.6 Particle size distribution of sorbic acid-loaded CS/TPP nanoparticles
从图6可看出,颗粒的平均粒径为327.4 nm,多分散系数为0.255,小于0.3,表明颗粒的分散性良好,图形的峰度较窄,没有拖尾现象,说明在最优条件下制得的山梨酸纳米防腐颗粒粒径分布较为均匀,效果较好,适于实验后期进行颗粒的应用研究。
2.3.2 纳米颗粒的透射电镜图
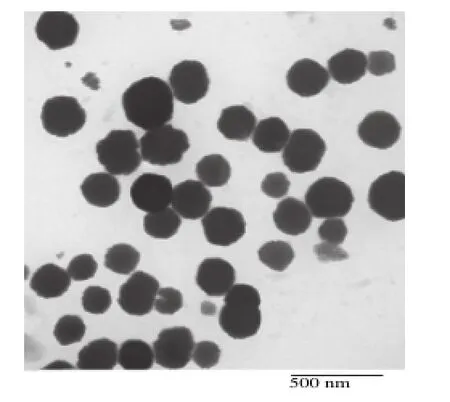
图7 山梨酸壳聚糖纳米颗粒透射电镜图Fig.7 TEM of sorbic acid-loaded CS/TPP nanoparticles
由图7可见,形成的纳米颗粒接近球形,分布均匀,基本无团聚现象,粒径在150~250 nm,这与激光粒度分析仪测得的结果一致。
2.3.3 红外光谱结果
由图8可见,CS有6 个特征峰,3 435 cm-1出现—OH的振动吸收峰;1 656 cm-1出现C=O的吸收峰;1 597 cm-1出现N—H的弯曲振动吸收峰,1 432 cm-1为C—N伸缩振动吸收峰,1 376 cm-1为—CH2的弯曲振动吸收峰,1 078 cm-1出现—CH3的对称变形振动以及C—O的骨架振动吸收峰。在CS/TPP纳米颗粒中,—OH吸收峰变的更为平坦,由3 435 cm-1转移到3 401 cm-1,表明CS与TPP之间的氢键作用加强。基于TPP中的磷酸基团与CS中氨基的静电作用,伯氨基、仲氨基的吸收峰分别转移至1 581 cm-1及1 422 cm-1,文献[11,14]也有相似报道。在山梨酸壳聚糖纳米颗粒(图8C)中,伯氨基,仲氨基的吸收峰分别转移至1 578 cm-1及1 419 cm-1,这是山梨酸与CS中氨基静电作用的结果,同时证明山梨酸颗粒已被包埋到CS与TPP形成的胶体体系中。
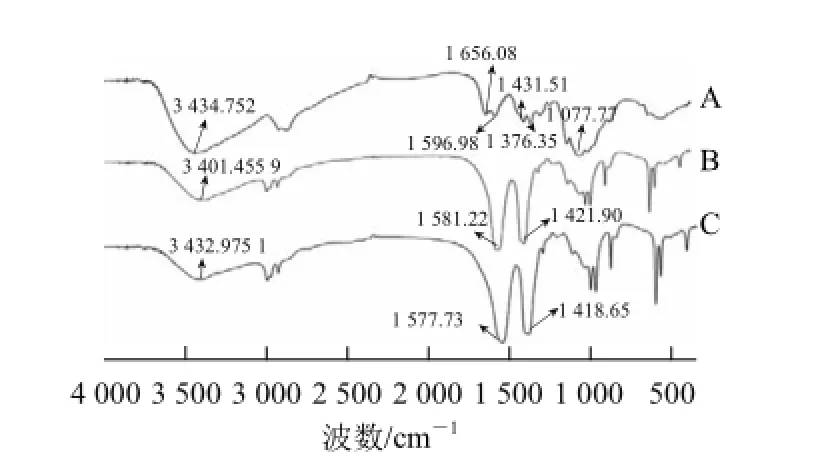
图8 CS(A)、CS/TPP(B)以及山梨酸壳聚糖纳米粒(C)红外光谱Fig.8 FTIR spectra of CS (A), CS/TPP nanoparticles (B) and sorbi c acid-loaded CS/TPP nanoparticles (C)
2.3.4 山梨酸壳聚糖纳米粒的体外缓释性能
缓释性是载活性纳米颗粒的一个重要指标[17],缓释性能可以保持活性物质在局部具有较高的浓度,通过活性物质的缓慢释放,可以使其更准确,更长期的发挥其作用。山梨酸壳聚糖纳米粒在PBS(pH 7.4)溶液中的缓释曲线见图9,其缓释阶段可分为初期暴释和暴释之后的缓慢释放期[18]。出现初期暴释,是由于CS/TPP纳米粒表面黏附有山梨酸,这部分山梨酸容易从体系中释放出来。24 h内山梨酸的体外释放量为50%。缓释阶段持续时间较长,这可能是由于分散于CS与TPP之间的山梨酸,其相互间存在有氢键作用,静电引力,因此解脱比较困难。
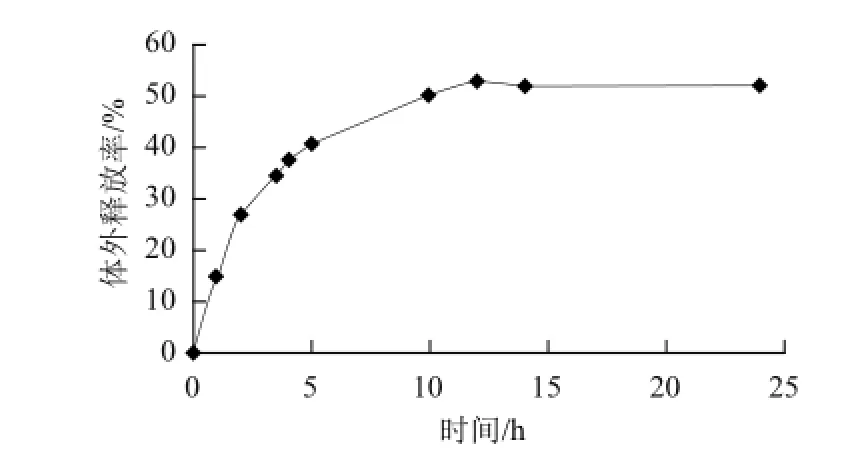
图9 山梨酸的体外释放性能Fig.9 Sorbic acid release profile from nanoparticles
3 结 论
本研究通过离子凝胶法成功制备了山梨酸纳米防腐颗粒,优化了山梨酸纳米防腐颗粒的制备工艺,得出山梨酸纳米防腐颗粒的最优制备工艺为CS质量浓度1 mg/mL、TPP质量浓度0.5 mg/mL、交联时间30 min、山梨酸质量浓度1 mg/mL,该条件下山梨酸颗粒平均粒径为337.2 nm,包封率为74.3%,此外,山梨酸壳聚糖纳米颗粒具有一定的缓释特性,24 h内山梨酸的体外释放量为50%。
[1] HUANG Qingrong, YU Hailong, RU Qiaomei. Bioavailability and delivery of nutraceuticals using nanotechnology[J]. Journal of Food Science, 2010, 75(1): 51-57.
[2] 何金岚, 罗理勇, 曾亮. 茶多酚纳米级微粒的制备技术其应用研究进展[J]. 食品科学, 2011, 32(15): 317-322.
[3] BOWAN K, LEONG K W. Chitosan nanoparticles for oral drug and gene delivery[J]. International Journal of Nanomedicine, 2006, 1(2): 117-128.
[4] AGNIHOTRI S A, MALLIKARJUNA, N N, AMINABHAVI T M. Recent advances on chitosan-based micro and nanoparticles in drug delivery[J]. Journal of Controlled Release, 2004, 100(1): 5-28.
[5] GAN Quan, WANG Tao, COCHRANE C, et al. Modulation of surface charge, particle size and morphological properties of chitosan-TPP nanoparticles intended for gene delivery[J]. Colloids Surfaces B: Biointerface, 2005, 44(2/3): 65-73.
[6] 王宇, 陈大为, 乔明曦, 等. 离子凝胶法制备水杨酸壳聚糖纳米粒[J].沈阳药科大学学报, 2007, 24(10): 607-610.
[7] WANG Qin, YIN Leilei, PADUA G W. Effect of hydrophilic and lipophilic com-pounds on zein microstructures[J]. Food Biophysics, 2008(3): 174-181.
[8] BODMEIER R, CHEN Huagang, PAERATAKUL O. A novel approach to the oral delivery of micro or nanoparticles[J]. Pharmaceutical Research, 1989, 6(5): 413-417.
[9] CALVO P, REMUNAN L C, VILA-JATO J L, et al. Novel hydrophilic chitosan-polyethylene oxide nanoparticles as protein carrier[J]. Journal of Applied Polymer Science, 1997, 63: 125-132.
[10] DONG Chunzhou, WANG Wenfang. He adspace solid-phase microextraction applied to the simultaneous determination of sorbic and benzoic acids in beverages[J]. Analytica Chimica Acta, 2006, 562(1): 23-29.
[11] LUO Yangchao, ZHANG Boce, WEN H, et al. Preparation, characterization and evaluation of selenite-loaded chitosan/TPP nanoparticles with or without zein coating[J]. Carbohydrate Polymers, 2010, 82(3): 942-951.
[12] 王薇薇, 何钢, 王琼. 壳聚糖纳米微粒制备条件的优化及其应用[J].中南林业科技大学学报, 2012, 32(2): 95-99.
[13] 刘海燕, 陈劲春, 陈兴田. 吲哚美辛聚氰基丙烯酸正丁酯纳米粒的制备[J]. 北京化工大学学报, 2008, 35(4): 73-76.
[14] HU Bing, PAN, Chengliang, SUN Yi, et al. Optimization of fabrication parameters to produce chitosan-tripolyphosphate nanoparticles for delivery of tea ca techins[J]. Journal of Agricultural and Food Chemistry, 2008, 56(16): 7451-7458.
[15] KIM J H, KIM Y S, KIM S, et al. Hydrophobically modified glycol chitos an nanoparticles as carriers for paclitaxel[J]. Control Release, 2006, 111(1/2): 228-234.
[16] 鲍士宝, 许时婴, 王璋. 茶多酚-壳聚糖纳米共悬液的制备及性质研究[J]. 食品与发酵工业, 2009, 35(3): 81-86.
[17] WU Yan, YAN G Wuli, WANG Changchun, et al. Chitosan nanoparticles as a novel delivery system for a mmonium glycyrrhizinate[J]. International Jounal of Pharmaceutics, 20 05, 295 (1/2): 235-245.
[18] 杨文静, 王婷, 何农跃. CS/TPP纳米微胶囊的制备及其载药性能[J].高等学校化学学报, 2009, 30(3): 625-628.
Preparation, Characterization and Release Profiles of Sorbic Acid Nanoparticles
WU Tao, DING Wu*
(College of Food Science and Engineering, Northwest A & F University, Yangling 712100, China)
Sorbic acid-loaded chitosan (CS) nanoparticles which may have a wider range of application in meat preservation due to the superior water solubility to sorbic acid were prepared using ionic gelation process. The particle size and encapsulation efficiency (EE) were investigated as a function of chitosan concentration, sodium tripolyphosphate (TPP) concentration, cross-linking time, sorbic acid concentration and stirring time by single-factor and orthogonal array designs. The CS nanoparticles were characterized by Fourier transform infrared spectroscopy (FTIR) and transmission electron microscopy (TEM) and evaluated for release profiles in vitro. The results demonstrated that the best conditions for preparing sorbic acid-loaded CS/TPP nanoparticles were 1 mg/mL CS concentration, 0.5 mg/mL TPP concentration, 1 mg/mL sorbic acid concentration, and cross-linking reaction for 30 min. The average particle size and EE of sorbic acidloaded nanoparticles were 337.2 nm and 74.3%, respectively. The FTIR spectrum confirmed the encapsulation of sorbic acid by electrostatic adsorption, and the TEM observation showed uniform particle size distribution and regular spherical morphology. The release experiments indicated an average release of sorbic acid of 50% in 24 h, confirming its sustained release profiles.
sorbic acid; nanoparticles; optimization; characterization
TS201
A
1002-6630(2014)10-0057-05
10.7506/spkx1002-6630-201410011
2013-07-12
陕西省自然科学基金项目(K33202096)
武陶(1988—),女,硕士研究生,研究方向为畜产食品深加工与安全控制。E-mail:wut126@163.com
*通信作者:丁武(1971—),男,教授,博士,研究方向为畜产食品深加工与安全控制。E-mail: dingwu10142000@hotmail.com

