响应面法优化提高发酵桑叶茶中1-脱氧野尻霉素含量工艺
肖 洪,黄先智,沈以红,丁晓雯,,秦樱瑞,曾艺涛,杨 娟,丁顺杰,商 桑
(1.西南大学食品科学学院,重庆市农产品加工重点实验室,重庆 400715;2.家蚕基因组生物学国家重点实验室,重庆 400715)
响应面法优化提高发酵桑叶茶中1-脱氧野尻霉素含量工艺
肖 洪1,黄先智2,沈以红2,丁晓雯1,*,秦樱瑞1,曾艺涛1,杨 娟1,丁顺杰1,商 桑1
(1.西南大学食品科学学院,重庆市农产品加工重点实验室,重庆 400715;2.家蚕基因组生物学国家重点实验室,重庆 400715)
为优化提高发酵桑叶茶中1-脱氧野尻霉素含量工艺,采用响应面分析法,以发酵温度、发酵时间及接种量为自变量,1-脱氧野尻霉素含量为响应值,设计三因素三水平响应面回归分析。结果表明:提高发酵桑叶茶中1-脱氧野尻霉素含量工艺的最佳工艺条件为发酵温度30 ℃、发酵时间5.6 h、黑曲霉:日本根霉:绿色木霉=2:1:2菌液接种量3.75×107CFU/100 g,在此条件下发酵桑叶茶中1-脱氧野尻霉素含量为133.882 mg/100 g。
发酵;桑叶茶;1-脱氧野尻霉素;响应面分析
桑叶茶是由桑叶加工制作而成的新型茶品,目前一般采用直接烘干或自然发酵的方式生产。桑叶绿茶甘醇香甜;桑叶乌龙茶爽口醇和,有淡淡的花香;桑红茶甘甜醇厚,有近似香蕉的果香味[1]。但桑叶绿茶普遍存在汤色发黑,豆腥味重,感官品质不佳的问题,为此,人们尝试开发桑叶乌龙茶、红茶等产品。桑叶茶的主要功能成分包括γ-氨基丁酸[2-3]、褪黑激素[4]、黄酮苷[5-6]、α-葡萄糖苷酶和酪氨酸酶抑制剂[7],以及生物碱、茶多酚、花青素、绿原酸、白藜芦醇、氧化芪三酚、β-胡萝卜素等生物活性成分[8-9]。黄酮类物质具有降血压、抗氧化、防癌、抗炎、抗过敏、利尿、解痉、镇咳、降血脂等生理作用[10]。桑叶中含有的多糖具有显著的降血糖作用[11],可以抑制α-葡萄糖苷酶和猪胰液α-淀粉酶的活性[12]等作用。桑叶茶的矿物元素含量比茶叶高出3~6 倍;总糖、酚类物质、氨基酸含量都较高;同时桑叶叶面较薄,比茶叶易溶解出更多的有效成分,有利于人体的吸收[13]。
1-脱氧野尻霉素(1-deoxynojirimycin,1-DNJ)是一种极性含N化合物,其化学名称为3,4,5-三羟基-2-羟甲基四氢吡啶,分子式为C6H13NO4,相对分子质量为163[14-15],是一种α-葡萄糖苷酶抑制剂,具有降血糖[16-17]、降血脂[18-19]、抗肿瘤[20]、抑制变形链球菌生长[21]、抗病毒[22]等功效。桑叶是植物中1-DNJ含量比较高的,但不同叶位、加工工艺等诸多因素都可能影响到桑叶茶中1-DNJ的含量[23-24]。
前期实验研究发现黑曲霉、日本根酶、绿色木霉复合发酵得到的桑叶茶综合品质好,且菌种比例为黑曲霉:日本根霉:绿色木霉=2:1:2时发酵桑叶茶品质最优。本实验旨在研究不同发酵条件对发酵桑叶茶中1-DNJ含量的影响,并用响应曲面优化提高发酵桑叶茶中1-DNJ的工艺条件,为桑叶的深度开发利用提供数据。
1 材料与方法
1.1 材料
1.1.1 实验菌种
黑曲霉(Aspergillus niger,GSICC 60108) 甘肃省微生物菌种保藏中心;日本根霉(Rhizopus japonicus Vuillemin,GIM3.119)、绿色木霉(Trichoderma viride,GIM3.443) 广东省微生物研究所微生物菌种保藏中心;以上3 种菌种的安全等级均高,其生物危害程度为4 类,在通常情况下不会引起人类或者动物疾病。
1.1.2 实验样本
采摘的桑品种为湖桑,种植与于西南大学桑园;人工发酵桑叶茶由本实验室自制。
1.2 试剂与仪器
1-DNJ标准品 北京德威钠生物技术有限公司;甘氨酸(Gly)、9-芴基氯甲酸甲酯(9-fluorenylmethyl chloroformate,FMOC) 美国Sigma公司;乙腈(色谱纯) 天津市四友精细化学品有限公司;其他常用试剂均为分析纯。
1525高效液相色谱仪 美国Waters公司;5810型台式高速离心机 德国Eppendorf公司;旋涡混合器 上海精科实业有限公司。
1.3 方法
1.3.1 发酵桑叶茶的制备
采摘从顶芽往下数4~10 片的新鲜桑叶,去柄,切为4 cm×4 cm的小叶片,混匀后称取100 g叶片用微波杀青90 s,揉捻,研究发酵条件(发酵温度、发酵时间、菌接种量)对黑曲霉+日本根酶+绿色木霉菌液10 mL,复揉,不同温度条件下发酵不同时间,微波干燥,制得桑叶茶。
本实验开始的时间为2012年11月上旬,因为桑叶的季节性,在每年11月底需要对桑树进行剪枝,且桑叶在4 ℃保存时间较短,在-18 ℃保存解冻后会造成大量的汁液流失,导致单因素试验中所用原料湖桑桑叶采摘时间为2012年11月初,而工艺优化所用原料湖桑桑叶采摘时间为2013年5月初。
1.3.2 1-DNJ的HPLC法测定
准确称取20 mg 1-DNJ标准品,将其在烧杯中溶于少量水中,移入25 mL容量瓶,冲洗烧杯和玻璃棒5 次并移入容量瓶,加超纯水定容至25 mL,即得0.8 mg/mL的1-DNJ标准溶液。用时将1-DNJ标准液配制成质量浓度为60、120、180、240、300、480 μg/mL备用。
1-DNJ的提取:精确称取待测样品0.5 g,加入35 mL超纯水,80 ℃水浴浸提2 h(每20 min摇匀一次),抽滤后,用超纯水定容至50 mL,即得样品提取液。
1-DNJ衍生化:取1-DNJ提取液(或1-DNJ标准液)300 μL于5.0 mL的离心管,加入0.4 mol/L硼酸钾缓冲液(pH 8.5)300 μL,再加入5 mmol/L的FMOC-Cl(溶解于乙腈中)600 μL,混匀后,25 ℃水浴20 min。加入1 mol/L的甘氨酸300 μL中和剩余的FMOC-Cl以终止反应,加入体积分数1%的醋酸液300 μL及超纯水1 200 μL稀释,8 000 r/min离心20 min,以0.45 μm微孔滤膜过滤器过滤,收集滤过液备测。
空白实验:以蒸馏水代替样品,空白对照衍生化反应以蒸馏水代替进行衍生化反应。
色谱条件:色谱柱:C18柱(150 mm×4.6 mm,5 μm);紫外检测器;检测波长:254 nm;流动相:乙腈-0.1%醋酸(50:50,V/V);流速:1.0 mL/min;柱温:25 ℃;进样量:10 μL。
1.3.3 响应面试验
提高发酵桑叶茶中1-DNJ工艺优化响应面分析试验因素与水平设计见表1。

表1 响应面试验因素水平表Table1 Independent variables and their coded values tested in response surface analysis
1.4 数据统计与分析
各实验至少重复3 次以上,实验数据用Excel和Design Expert 8.05b进行统计处理。
2 结果与分析
2.1 1-DNJ标准曲线线性回归方程、相关系数及色谱图
按照1.3.2节的实验方法,对不同质量浓度1-DNJ标准溶液进行测定,以峰面积y为纵坐标,1-DNJ质量浓度x(μg/mL)为横坐标,得到1-DNJ的标准曲线线性回归方程为y=15 776x-70 392,相关系数r=0.999 6。
将空白、1-DNJ标准品、桑叶茶样品经衍生化后上高效液相色谱仪进行测定,分别得到如图1所示色谱图。
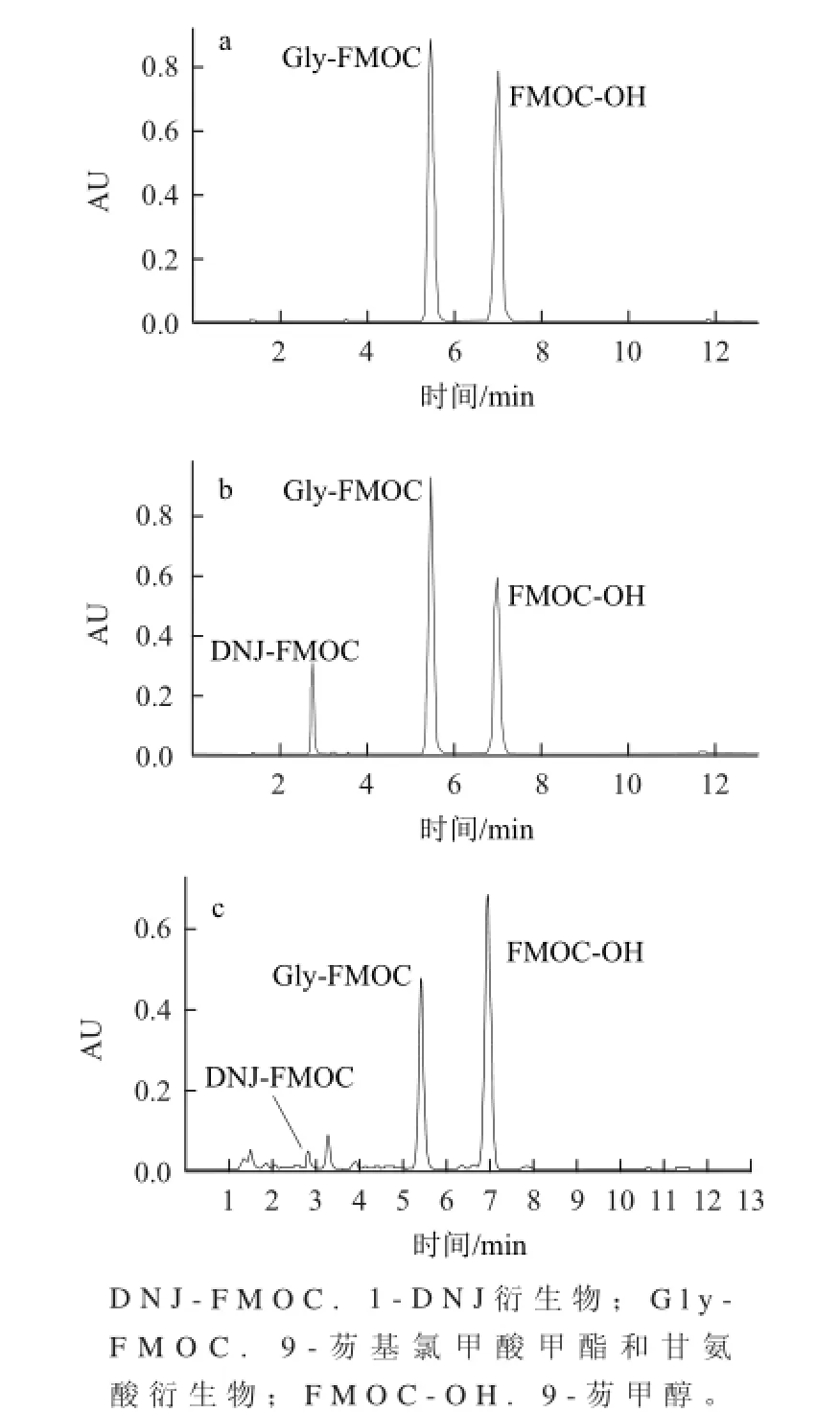
图1 空白(a)、1--DNJ标准品(b)和桑叶茶样品(c)色谱图Fig.1 Chromatograms of blank sample (a), 1-DNJ standard(b) and mulberry leaf tea sample (c)
由色谱图1可知,在本实验条件下,1-DNJ衍生物DNJ-FMOC的保留时间为2.731 min,与Gly-FMOC和FMOC-OH的峰间距分别相差2.719 min和4.243 min,表明这两种物质均不干扰1-DNJ的测定。
2.2 1-DNJ的检测分析
对实验中所用的3 种菌种单一和复合接种于不添加桑叶的马铃薯培养基,在培养基中未检测到1-DNJ。2013年5月初做响应面优化试验时测得桑叶中1-DNJ含量为119.986 mg/100 g。
2.3 单因素对发酵桑叶茶中1-DNJ含量的影响
2.3.1 发酵温度
取100 g桑叶分别在25、30、35、40、45、50 ℃条件下加入107CFU的黑曲霉:日本根霉:绿色木霉=2:1:2的菌液10 mL发酵5 h生产桑叶茶,探究发酵桑叶茶中1-DNJ含量的变化。
由图2可知,随着发酵温度的升高,发酵桑叶茶中的1-DNJ含量先增加后降低,然后又略有增加,在25~50 ℃条件下,随着温度的变化,1-DNJ含量没有规律性的变化,可能与使用3 种菌种进行复合发酵有关,因为不同菌种的最适生长温度略有差别。桑叶茶发酵的一种可能是以酶为催化剂的生物转化反应过程,合适的发酵温度才能确保酶促反应的顺利进行,温度过低会降低酶的活性,温度过高会使酶失活。温度为30 ℃时发酵桑叶茶中1-DNJ含量最高,这可能是因为30 ℃为3 种复合菌种的最适生长和产酶温度,更利于1-DNJ的产生;但在发酵温度为40 ℃以后1-DNJ含量略有增加,但没有0 ℃时得到的1-DNJ含量高,这可能是高温一定程度的抑制了菌种的生长和酶活,另外可能是桑叶为微生物生长提供所需的碳源或氮源。由此确定发酵温度为30 ℃最佳。
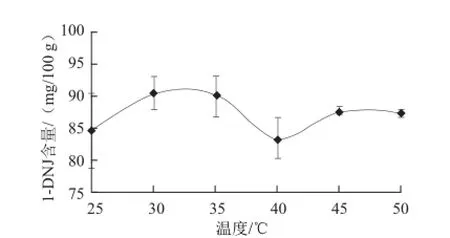
图2 不同发酵温度条件下发酵桑叶茶中1--DNJ含量Fig.2 Effect of fermentation temperature on the 1-DNJ content of fermented mulberry leaf tea
2.3.2 发酵时间
取100 g桑叶分别在25 ℃条件下加入107CFU的黑曲霉:日本根霉:绿色木霉=2:1:2的菌液10 mL发酵1、2、3、4、5、6、7 h、生产桑叶茶,探究其1-DNJ含量的变化。
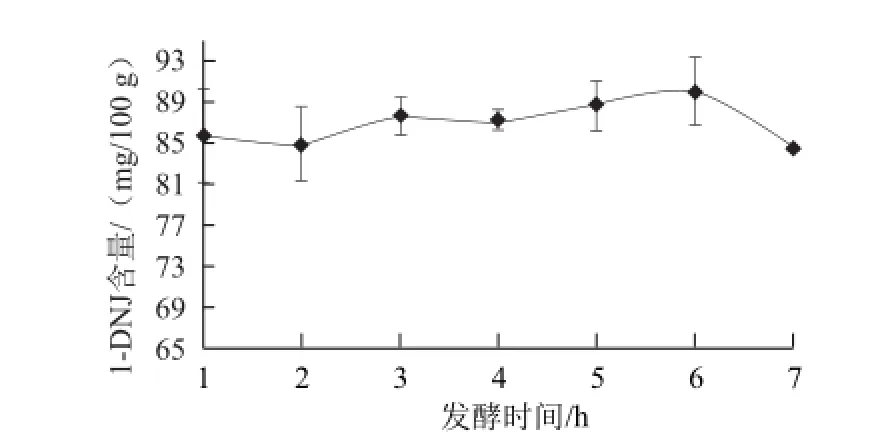
图3 不同发酵时间条件下发酵桑叶茶中1--DNJ含量Fig.3 Effect of fermentation time on the 1-DNJ content of fermented mulberry leaf tea
由图3可知,随着发酵时间的延长,发酵桑叶茶中的1-DNJ呈现出先缓慢增加然后降低的趋势,在发酵6 h时发酵桑叶茶中的1-DNJ含量最高,之后1-DNJ含量又逐渐降低,所以选择发酵时间为6 h较为合适。
2.3.3 菌接种量
取100 g桑叶分别在25 ℃条件下加入0.5×107、1×107、2×107、4×107、6×107、8×107、10×107CFU的黑曲霉:日本根霉:绿色木霉=2:1:2的菌液10 mL发酵5 h生产桑叶茶,探究其1-DNJ含量的变化。
由图4可知,适宜的接种量以4×107CFU/100 g为宜。在接种量低于4×107CFU/100 g时,发酵桑叶茶中的1-DNJ含量随接种量的增加呈上升的趋势,接种量超过4×107CFU/100 g时,发酵桑叶茶中的1-DNJ含量明显降低。这可能是由于在接种量较低时,菌种自身繁殖代谢慢,发酵不彻底,发酵桑叶茶中的1-DNJ含量低;但当接种量大于6×107CFU/100 g时,随着接种量的增大,发酵桑叶茶中的1-DNJ含量又略有增加,这可能与使用3 种菌种进行复合发酵有关,具体原因需要进一步的探究。所以选择接种量为4×107CFU/100 g。
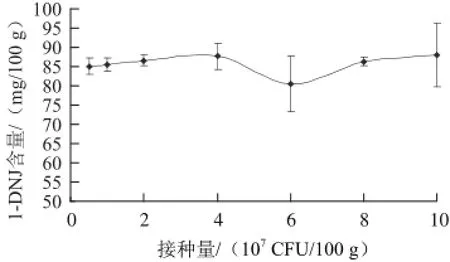
图4 不同菌接种量下发酵桑叶茶中活性成分含量Fig.4 Effect of inoculum amount on the 1-DNJ content of fermented mulberry leaf tea
2.4 回归模型的建立及显著性检验
按照表1试验方案进行三因素三水平试验,结果见表2。将所得的试验数据采用Design Expert 8.05b软件进行多元回归拟合,得到以1-DNJ含量为目标函数的二次回归方程。1-DNJ含量对发酵温度X1、发酵时间X2、接种量X3二次多项回归方程为:
Y=-100.947 10+12.583 29X1+16.005 43X2+2.579 05X3+0.358 10X1X2+0.370 93X1X3-0.768 38X2X3-0.271 50-2.116 40-1.229 54
为检验方程的有效性,对1-DNJ含量的数学模型进行方差分析,结果见表3。由表3可知,一次项X1、X2、X3中X2、X3极显著(P<0.01),说明发酵时间、接种量对发酵桑叶茶中1-DNJ含量有极显著影响。交互项X1X2、X1X3、X2X3均显著(P<0.05)说明发酵温度和发酵时间、发酵温度和接种量、发酵时间和接种量对发酵桑叶茶中1-DNJ含量有显著影响。二次项、、X均具有极显著差异(P<0.01)。二次回归模型的F值为44.57,P<0.01,说明该模型极显著,失拟项P值大于0.05,表明失拟不显著,模型的修正相关系数平方0.960 8,说明该模型能反映96.08% 响应值的变化,因而该模型拟合程度较好,试验误差小,较好地反映了1-DNJ含量与发酵温度、发酵时间、接种量的关系,因此可以用此模型对发酵桑叶茶中1-DNJ含量进行分析和预测。
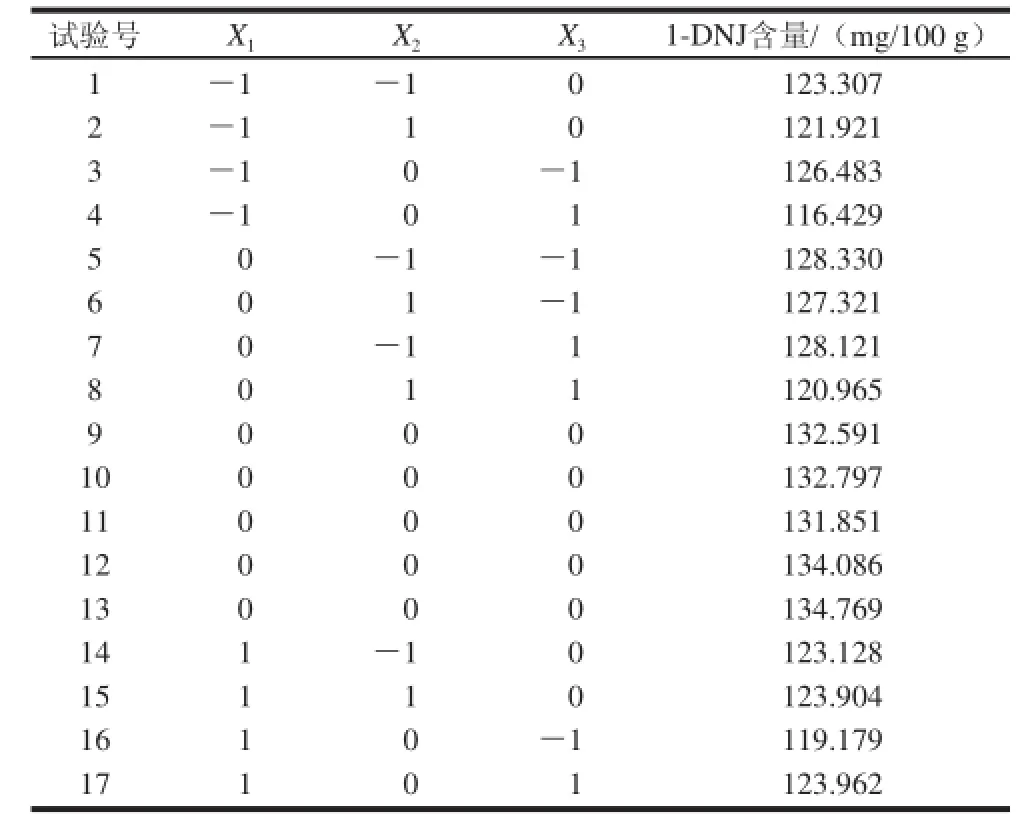
表2 1-DNJ工艺优化响应面分析试验设计及结果Table2 Experimental design and corresponding results for response surface analysis
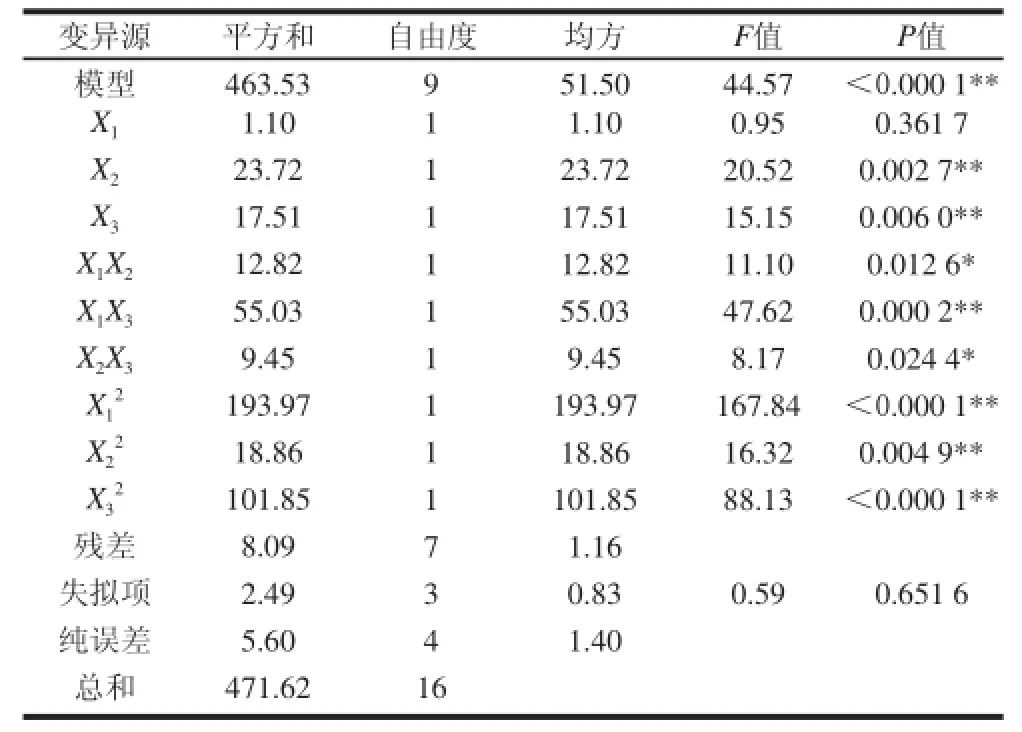
表3 1-DNJ含量回归方程方差分析表Table3 Analysis of variance for the regression model for 1-DNJ content
2.5 各因素交互作用响应面分析
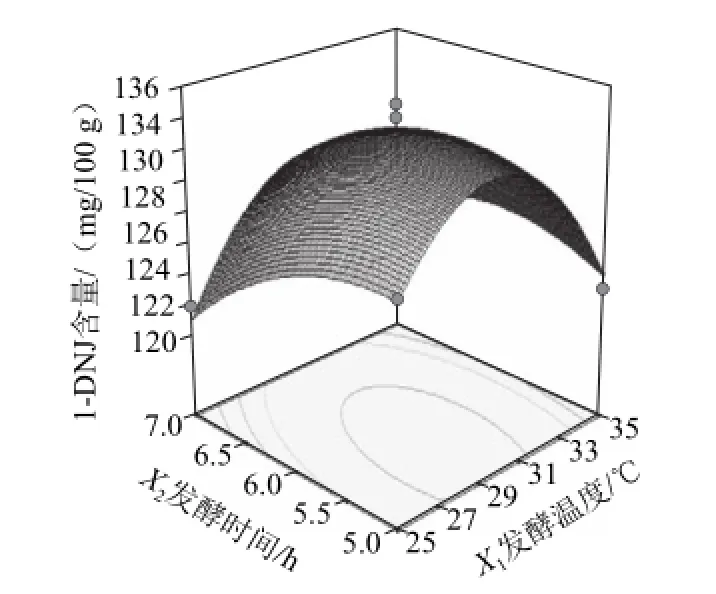
图5 发酵时间与发酵温度交互作用对1-DNJ含量影响Fig.5 Interactive effects of fermentation time and temperature on the 1-DNJ content of fermented mulberry leaf tea
从图5可以看出,当接种量为4×107CFU/100 g时,发酵温度和发酵时间的交互作用显著影响发酵桑叶茶中1-DNJ含量。在发酵时间一定的情况下,随着发酵温度的升高,发酵桑叶茶中1-DNJ含量均呈现出先增加后降低的趋势。发酵温度大于30 ℃时,随着发酵温度的升高发酵桑叶茶中1-DNJ含量降低,可能30 ℃是3 种复合菌种的最适生长和产酶温度。
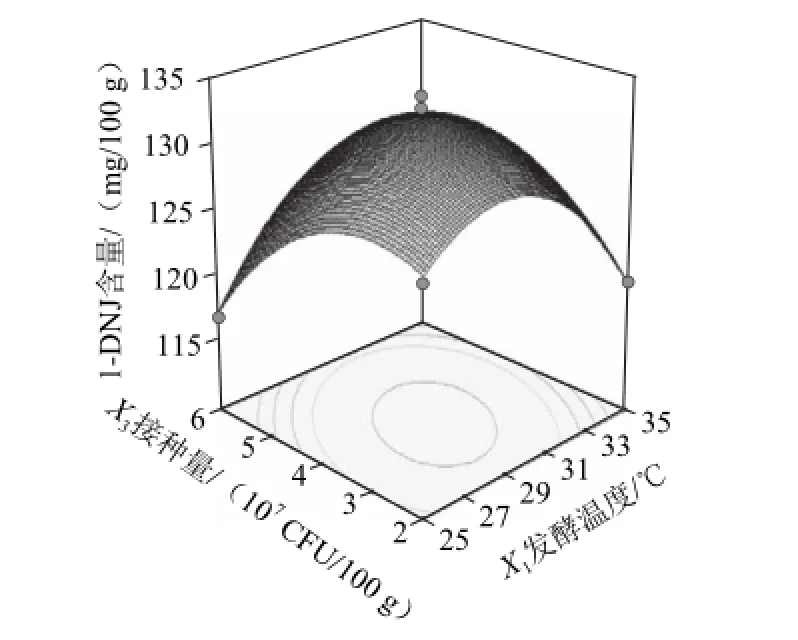
图6 接种量与发酵温度交互作用对1--DNJ含量影响Fig.6 Interactive effects of inoculum amount and fermentation temperature on the 1-DNJ content of fermented mulberry leaf tea
从图6可知,当发酵时间为6 h时,发酵温度和接种量的交互作用显著影响发酵桑叶茶中1-DNJ含量。在发酵温度一定的情况下,随着菌接种量的提高,发酵桑叶茶中1-DNJ含量均呈现出先增加后降低的趋势。菌接种量大于4×107CFU/100 g时,随着菌接种量的增加发酵桑叶茶中1-DNJ含量降低,这可能是接种量过大时,菌种繁殖旺盛,需要消耗大量桑叶中的营养成分和生物活性物质分来完成自身代谢。
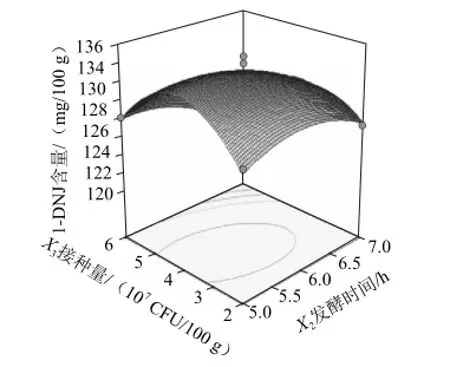
图7 接种量与发酵时间交互作用对1--DNJ含量影响Fig.7 Interactive effects of inoculum amount and fermentation time on the 1-DNJ content of fermented mulberry leaf tea
从图7可以看出,当发酵温度为30 ℃时,发酵时间和菌接种量的交互作用显著影响发酵桑叶茶中1-DNJ含量。当发酵时间大于6 h时,随着发酵时间的增加发酵桑叶茶中1-DNJ含量降低。
2.6 最佳工艺条件的确定和实验验证
通过对二次回归模型的分析,可以确定提高发酵桑叶茶中1-DNJ含量的最佳工艺条件为发酵温度29.41 ℃、发酵时间5.59 h、接种量3.74×107CFU/100 g,在该工艺条件下,模型预测的发酵桑叶茶中1-DNJ含量为133.689 mg/100 g。为便于实际应用,取发酵温度30 ℃、发酵时间5.6 h、接种量3.75×107CFU/100 g,在此条件下进行验证实验,得发酵桑叶茶中1-DNJ含量为133. 882 mg/100 g,此数值与模型预测值的相对误差为1.443%,预测精度较高,说明此模型可靠。
3 结 论
响应面法获得的提高发酵桑叶茶中1-DNJ含量的最佳工艺参数为发酵温度30 ℃、发酵时间5.6 h、接种量3.75×107CFU/100 g,发酵桑叶茶中1-DNJ含量为133.882 mg/100 g,与桑叶中1-DNJ含量(119.986 mg/100 g)比较,经发酵后桑叶茶中的1-DNJ含量有一定的提高,发酵所得的桑叶茶营养丰富,开发前景广阔。
由于桑叶的季节性,对本实验结果造成了一些误差;其次,与桑叶对比可知经发酵后桑叶茶中1-DNJ含量增加不是特别显著,在今后的研究中本课题组会用更多的菌种进行实验,以期能得到提高发酵桑叶茶中1-DNJ含量的优势菌种。
[1] 王忠华, 吴月燕, 张燕忠. 不同加工工艺制成桑叶茶的感观品质及营养活性成分分析[J]. 蚕业科学, 2011, 37(2): 272-277.
[2] YANG N C, JHOU K Y, TSENG C Y. Antihypertensive effect of mulberry leaf aqueous extract containing γ-aminobutyric acid in spontaneously hypertensive rats[J]. Food Chemistry, 2012, 132(4): 1796-1801.
[3] 夏玉玲, 徐立, 杨翠凤. 桑叶中γ-氨基丁酸含量的测定[J]. 中国农学通报, 2009, 25(20): 209-212.
[4] POTHINUCH P, TONGCHITPAKDEE S. Melatonin contents in mulberry (Morus spp.) leaves: effects of sample preparation, cultivar, leaf age and tea processing[J]. Food Chemistry, 2011, 128(2): 415-419.
[5] KATSUBE T, YAMASAKI M, SHIWAKU K, et al. Effect of flavonol glycoside in mulberry (Morus alba L.) leaf on glucose metabolism and oxidative stress in liver in diet-induced obese mice[J]. Journal of the Science of Food and Agriculture, 2010, 90(14): 2386-2392.
[6] KIM G N, JANG H D. Flavonol content in the water extract of the mulberry (Morus alba L.) leaf and their antioxidant capacities[J]. Journal of Food Science, 2011, 76(6): 869-873.
[7] KATSUBE T, IMAWAKA N, KAWANO Y, et al. Antioxidant flavonolglycosides in mulberry (Morusalba L.) leaves isolated based on LDL antioxidant activity[J]. Food Chemistry, 2006, 97(1): 25-31.
[8] 王芳, 励建荣. 桑叶的化学成分、生理功能及应用研究进展[J]. 食品科学, 2005, 26(增刊1): 111-117.
[9] 薛长勇, 腾俊英, 邱继红, 等. 桑叶多糖-肽复合物的降血糖、血脂作用[J]. 营养学报, 2005, 27(2): 167-168.
[10] 寇秀颖, 杜阳吉, 徐勇. 桑叶黄酮类和多糖类化合物的提取及其降血糖作用研究[J]. 食品工程, 2010(4): 39-41.
[11] KIM D C, IN M J, CHAE H J. Preparation of mulberry leaves tea and its quality characteristics[J]. Journal of Applied Biological Chemistry, 2010, 53(1): 56-59.
[12] SONG Wei, WANG Hanjing, BUCHELI P, et al. Phytochemical profiles of different mulberry (Morus sp.) species from China[J]. Journal of Agricultural and Food Chemistry, 2009, 57(19): 9133-9140.
[13] 李旭玫, 傅水玉. 桑叶茶中营养成分的测定与研究[J]. 杭州师范学院学报: 自然科学版, 2006, 5(1): 58-60.
[14] KOJI D, YOSHIHIKO I, TSUNEMATSU T. Studies on the constituents of the water extract of the root of mulberry tree (Morus bombycis Koidz)[J]. Chemical and Pharmaceutical Bulletin, 1986, 34(5): 2243- 2246.
[15] MARUO S, YAMASHITA H, MIYAZAKI K, et al. A novel and efficient method for enzymatic synthes is of high purity maltose using moranoline (1-deoxynojirimyein)[J]. Bioscience, Biotechnology and Biochemistry, 1992, 56(9): 1406-1409.
[16] CHALUNTORN V, KIYOTAKA N, PHUMON S, et al. Development of high 1-deoxynojirimycin (DNJ) content mulberry tea and use of response surface methodology to optimize tea-making conditions for highest DNJ extraction[J]. Food Science and Technology, 2012, 45(2): 226-232.
[17] KIMURA T, NAKAGAWA K, KUBOTA H, et al. Food-grade mulberry powder enriched with 1-deoxynojirimycin suppresses the elevation of postprandial blood glucose in humans[J]. Journal of Agricultural and Food Chemistry, 2007, 55(14): 5869-5874.
[18] KOJIMA Y, KIMURA T, NAKAGAWA K, et al. Effects of mulberry leaf extract rich in 1-deoxynojirimycin on blood lipid profiles in humans[J]. Journal of Clinical Biochemistry and Nutrition, 2010, 47(2): 155-161.
[19] TSUDUKI T, NAKAMURA Y, HONMA T, et al. Intake of 1-deoxynojirimycin suppresses lipid accumulation through activation of the beta-oxidation system in rat liver[J]. Journal of Agriculture and Food Chemistry, 2009, 57(22): 11024-11029.
[20] WANG R J, YANG C H, HU M L. 1-Deoxynojirimycin inhibits metastasis of B16F10 melanoma cells by attenuating the activity and expression of matrix metalloproteinases-2 and-9 and altering cell surface glycosylation[J]. Journal of Agriculture and Food Chemistry, 2010, 58(16): 8988-8993.
[21] ISLAM B, KHAN S N, HAQUE I, et al. Novel anti-adherence activity of mulberry leaves: inhibition of Streptococcus mutans biofilm by 1-deoxynojirimycin isolated from Morus alba[J]. Journal of Antimicrobial Chemotherapy, 2008, 62(4): 751-757.
[22] JACOB J R, MANSFIELD K, YOU J E, et al. Natural iminosugar derivatives of 1-deoxynojirimycin inhibit glycosylation of hepatitis viral envelope proteins[J]. Journal of Microbiology, 2007, 45(3): 431-440.
[23] 杨清, 徐立, 王俊, 等. 桑红茶发酵工艺条件优化及活性成分含量的动力学研究[J]. 蚕业科学, 2010, 36(2): 221-228.
[24] 孙国霞, 王俊, 龚敏, 等. 不同叶位桑叶及发酵温度对桑红茶中活性成分含量的影响[J]. 蚕业科学, 2011, 37(6): 1061-1066.
Optimization of Fermentation Conditions for Enhanced 1-Deoxynojirimycin Content in Fermented Mulberry Leaf Tea by Response Surface Methodology
XIAO Hong1, HUANG Xian-zhi2, SHEN Yi-hong2, DING Xiao-wen1,*, QIN Ying-rui1, ZENG Yi-tao1, YANG Juan1, DING Shun-jie1, SHANG Sang1
(1. Chongqing Key Laboratory of Agricultural Product Processing, College of Food Science, Southwest University, Chongqing 400715, China; 2. State Key Laboratory of Silkworm Genome Biology, Chongqing 400715, China)
Response surface methodology was used to optimize the fermentation conditions for producing fermented mulberry leaf tea with higher 1-deoxynojirimycin (1-DNJ) content. The 1-DNJ content was investigated with respect to fermentation temperature, fermentation time and inoculum amount by response surface regression analysis. The optimum fermentation conditions that provided a 1-DNJ content of 133.882 mg/100 g dry weight of fermented mulberry leaf tea were determined as 30 ℃, 5.6 h, a ratio of Aspergillus niger to Rhizopus japonicus Vuillemin to Trichoderma viride of 2:1:2, and an inoculum amount of 3.75×107CFU/100 g.
fermentation; mulberry leaves; 1-deoxynojirimycin (1-DNJ); response surface analysis
S886.9
A
1002-6630(2014)10-0046-06
10.7506/spkx1002-6630-201410009
2013-07-03
国家现代农业(蚕业)产业技术体系建设专项(CARS-22-ZJ0503);重庆市科委应用技术项目(cstc,2012gg-yyjs80022)
肖洪(1989—),男,硕士研究生,研究方向为食品安全与质量控制。E-mail:xiaohong463108359@163.com
*通信作者:丁晓雯(1963—),女,教授,博士,研究方向为食品安全与功能食品。E-mail:xiaowend@sina.com

