蜂胶乙酸乙酯提取物 的反相高效液相色谱-质谱分离鉴定
王 冰,陈 洋,李宝丽,朱宇轩,唐翠娥,黄艳春,张 缔,刘 睿,*
(1.华中农业大学 环境食品学教育部重点实验室,武汉 430070;2.武汉市蜂产品质量控制工程技术研究中心,武汉 430070)
蜂胶乙酸乙酯提取物 的反相高效液相色谱-质谱分离鉴定
王 冰1,2,陈 洋1,李宝丽1,朱宇轩1,2,唐翠娥1,2,黄艳春1,张 缔1,刘 睿1,2,*
(1.华中农业大学 环境食品学教育部重点实验室,武汉 430070;2.武汉市蜂产品质量控制工程技术研究中心,武汉 430070)
以河南南阳蜂胶为原料,采用反相高效液相色谱-二极管阵列检测器-电喷射串联质谱对蜂胶乙酸乙酯提取物进行分离鉴定。以10种黄酮对照品为分析对象建立分析方法,10种黄酮对照品的线性相关系数为0.998 2~0.999 9,加标回收率为93.40%~103.69%,且精密度、稳定性和加标回收率的相对标准偏差均小于5%。采用该法对蜂胶乙酸乙酯提取物进行分析,河南蜂胶中可能含有槲皮素、芹菜素、山奈酚、异鼠李素、白杨素、松属素、高良姜素、短叶松素、短叶松素-3-乙酸酯、短叶松素-3-丙酸酯和短叶松素-3-丁酸酯11种黄酮类化合物以及对甲氧基肉桂酸肉桂酯和咖啡酸苯乙酯2种酚酸及其酯类化合物。
蜂胶;反相高效液相色谱-质谱;黄酮;酚酸及其酯类
蜂胶是蜜蜂从植物芽胞或树干采集的树胶,混入蜜蜂的上额腺、蜂蜡而形成的芳香性树脂状固体物质[1]。蜂胶含有丰富的多酚化合物,报道较多的酚酸及其酯类物质有咖啡酸、p-香豆酸、阿魏酸、3,4-二甲氧基肉桂酸、亚桂皮乙酸、咖啡酸苯乙酯、咖啡酸肉桂酯,黄酮有5-甲氧基短叶松素、短叶松素、山奈酚、芹菜素、松属素、短叶松素-3-乙酸酯、柯因、高良姜素、柚木柯因[2-6],具有抗肿瘤、抗菌、抗病毒、提高机体免疫功能、保护肝脏以及抗氧化等多种生理功能[7-11],这些功能与蜂胶的成分密切相关[1]。
目前大多数研究皆关注蜂胶醇提物或水提物[12-15],但是近期国内外的研究表明蜂胶乙酸乙酯提取物具有与醇提物不同的生物活性成分和功效。如中国蜂胶乙酸乙酯提取物对霉菌的抑制效果高于乙醇提取物的抑制效果[16],土耳其蜂胶乙酸乙酯提取物对变形链球菌的生长和黏附的抑制率皆好于70%乙醇提取物[17]。在蜂胶对人体中性白细胞弹性蛋白酶的抑制作用的研究中也有类似发现:蜂胶的丙酮、二氯甲烷、乙酸乙酯、40%乙醇、60%乙醇、70%乙醇、80%乙醇、96%乙醇等溶剂提取物中,蜂胶乙酸乙酯提取物的半最大效应浓度(concentration for 50% of maximal effect,EC50)值最小,抑制效果最好[18]。但是导致蜂胶乙酸乙酯提取物与醇提物活性差异的原因并不是很清楚,文献报道也少见。
我国是蜂胶生产大国,河南省是我国的主要蜂胶产地和集散地,蜂胶产量超过全国蜂胶产量的30%,对其活性成分进行分析鉴定,对于蜂胶的精深加工具有重要的指导意义。用于分析天然产物及其相关产品中活性成分的方法有很多,比较常用的是高效液相色谱(high performance liquid chromatography,HPLC)法[19-20]。本研究旨在建立蜂胶乙酸乙酯提取物的反相高效液相色谱-质谱联用(reverse phase-HPLC-mass spectrometry,RP-HPLCMS)分析方法,对蜂胶活性成分进行鉴定,为进一步研究蜂胶乙酸乙酯提取物的组成成分与生物活性之间的关系提供方法。
1 材料与方法
1.1 材料与试剂
蜂胶样品由河南南阳蜂农提供,样品采集后置于-18 ℃冰箱保存。
石油醚、乙酸乙酯(均为分析纯) 国药集团化学试剂有限公司;对照品:杨梅黄酮、桑色素、芹菜素、芦丁、槲皮素、松属素、山奈酚、异鼠李素、白杨素、高良姜素(纯度≥98%) 芜湖甙尔塔医药科技有限公司;甲醇、乙腈(均为色谱纯) 美国Thermo-Fisher公司;甲酸(色谱纯) 天津市光复精细化工研究所。
1.2 仪器与设备
KQ-100DE型数控超声清洗器 昆山市超声仪器有限公司;e2695高效液相色谱仪(配有可变波长紫外检测器和Empower色谱工作站) 美国Water公司;1100 Series LC-MSD Trap-SL质谱仪 美国Agilent公司;0.22 μm微孔滤膜 大连依利特分析仪器有限公司。
1.3 方法
1.3.1 乙酸乙酯提取蜂胶中活性成分
称取80 g河南南阳蜂胶原料,粉碎后用石油醚除去蜂蜡,按料液比1∶11(g/mL)用乙酸乙酯超声萃取3次,萃取条件:超声波功率100 W、温度30 ℃、时间30 min。3次提取液合并离心后,取上清液,于40 ℃真空浓缩,冷冻干燥成粉末。
1.3.2 供试品溶液的制备
精确称取河南南阳蜂胶乙酸乙酯提取物10.00 mg,置于5 mL容量瓶中,加甲醇溶解,超声处理5 min,静置至室温后,用甲醇定容,摇匀,取适量溶液用0.22 μm微孔滤膜滤过,即得供试品溶液。
1.3.3 对照品标准溶液的制备
将10种黄酮对照品配成一系列质量浓度范围为0.5~5 mg/mL的对照品标准溶液。
将对照品标准溶液各吸取150 øL配成混和对照品溶液,用0.22 μm微孔滤膜滤过,作为储备液,4 ℃保存。
1.3.4 对照品及样品RP-HPLC分析条件优化
比较甲醇-水、乙腈-水以及不同甲酸含量的乙腈-甲酸溶液作为流动相的等度洗脱以及各种梯度洗脱效果;在梯度洗脱条件下比较流速分别为0.4、0.7、1 mL/min和1.2 mL/min的洗脱效果,确定色谱条件。
色谱柱:T h e r m o H y p e r s i l G O L D C18柱(250 mm×4.6 mm,5.0 μm);流动相为乙腈-0.3%甲酸;梯度洗脱:0~10 min,15%~20%;20~35 min,30%~35%;65~75 min,50%~95%;80~85 min,15%~15%;流速1 mL/min;柱温30 ℃;二极管阵列(diode array detector,DAD)检测器;检测波长280 nm。
1.3.5 南阳蜂胶乙酸乙酯提取物的质谱条件
电喷雾离子化(electronspray ionization,ESI)离子源;负离子模式检测;离子源喷射电压3.5 kV;毛细管加热温度350 ℃;喷雾电压40 psi;雾化气(N2)流速80 kPa;干燥气(N2)流速10L/ min;碰撞气体为氦气;全离子扫描方式;扫描范围m/z 50~1 000。
1.3.6 南阳蜂胶乙酸乙酯提取物的分析鉴定
将南阳蜂胶乙酸乙酯提取物中待测物质的紫外图谱、分子离子、碎片离子峰质荷比与对照品和相关文献进行比较,进行定性分析与鉴定。
2 结果与分析
2.1 RP-HPLC-DAD色谱条件的建立与优化
RP-HPLC-DAD流动相一般选用甲醇、乙腈和水。用甲醇-水作流动相,多酚类化合物出峰时间较晚,且不能获得很好的分离,色 谱峰拖尾严重。用乙腈-水作流动相时能有效改善出峰时间晚的问题,色谱峰分布较均匀,但仍然有拖尾现象,这是由于酚羟基的解离,使其在固定相表面有双重保留机制。在流动相中加入酸性抑制剂(如甲酸、乙酸)可使酚羟基的解离被抑制,在RP-HPLC条件下,成为中性疏水缔合物,使分离效果和峰形得到改善。考虑到色谱柱的耐酸范围,选定乙腈-0.3%甲酸溶液体系作为流动相,在梯度洗脱条件下,发现当流动相流速为0.4 mL/min和0.7 mL/min时,色谱峰出峰时间晚的现象仍然不能得到有效改善;而当流动相流速为1 mL/min和1.2 mL/min时,皆能得到理想的分离效果,考虑到延长色谱柱寿命、降低泵运作时的压力,最终选择流动相的洗脱流速为1 mL/min,通过优化得出最优RP-HPLC-DAD的分析条件为:流动相乙腈-0.3%甲酸;梯度洗脱:0~10 min,15%~20%;20~35 min,30%~35%;65~75 min,50%~95%;80~85 min,15%~15%;流速1 mL/min。在最佳色谱分离条件下,10种黄酮对照品达到基线分离,结果见图1。

图1 对照品的HPLC图Fig.1 HPLC chromatogram of flavonoid reference standards
2.2 线性关系考察
将10种黄酮对照品的混和储备液分别稀释0、2、4、8、16、32倍,配成一系列对照品溶液,采用上述优化好的色谱条件进样10 øL分析,以标准样品质量浓度为横坐标(x)、相应的峰面积为纵坐标(y),绘制标准曲线,得到线性回归方程;以信噪比(RSN)为3确定各黄酮类化合物的检出限。结果见表1。10种黄酮对照品在各自的线形范围内相关系数满足实验要求。

表1 10种黄酮对照品的线性范围、回归方程、相关系数、检出限Table1 Linear ranges, regression equations, correlation coefficients and detection limits for 10 flavonoids
2.3 精密度
使用优化后的色谱条件检测,10种混和黄酮对照品溶液平行连续测定6次,计算相对标准偏差,以考察精密度。10种黄酮对照品的保留时间和峰面积积分的相对标准偏差均小于2%,精密度良好。结果见表2。

表2 10种黄酮对照品的精密度Table2 Precision of the method
2.4 稳定性
将10种黄酮混和对照品溶液分别放置0、4、8、12、18、24 h后进样考察。在24 h内测定其峰面积变化,结果见表3。10种黄酮类物质的保留时间和峰面积积分的相对标准偏差均小于5%,说明稳定性良好。

表3 10种黄酮对照品的稳定性Table3 Stability of the method
2.5 加标回收率
取10 mg蜂胶乙酸乙酯提取物定容至5 mL容量瓶,配制2份平行样品,1份单独进样,1份取1 mL并加入0.2 mL混合对照品溶液进样。每份样品平行测定3次,计算回收率和相对标准偏差。结果见表4。黄酮的回收率为93.40%~103.69%,且相对标准偏差均小于2%,满足蜂胶样品中黄酮类化合物分析的要求。
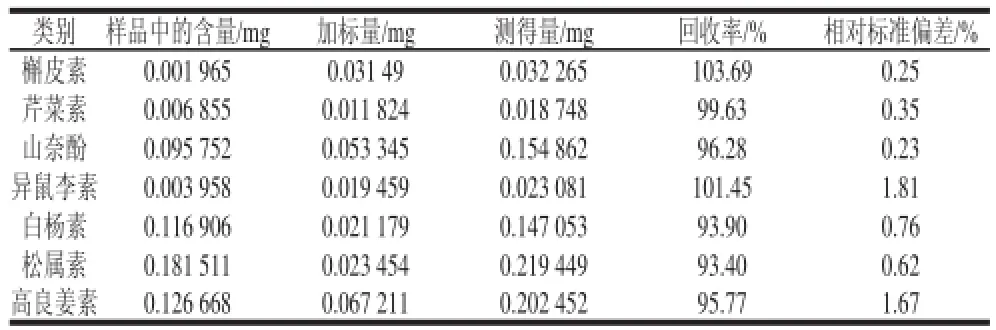
表4 7种黄酮对照品的回收率Table4 Recovery of the method for 7 flavonoids
2.6 南阳蜂胶乙酸乙酯提取物的分析与鉴定
根据优化好的色谱条件并结合给定的ESI-MS-MS条件进样分析河南南阳蜂胶乙酸乙酯提取物样品,其分离鉴定的结果如图2、3所示。

图2 南阳蜂胶乙酸乙酯提取物的HPLC图Fig.2 HPLC chromatogram of ethyl acetate extract of Nanyang propolis
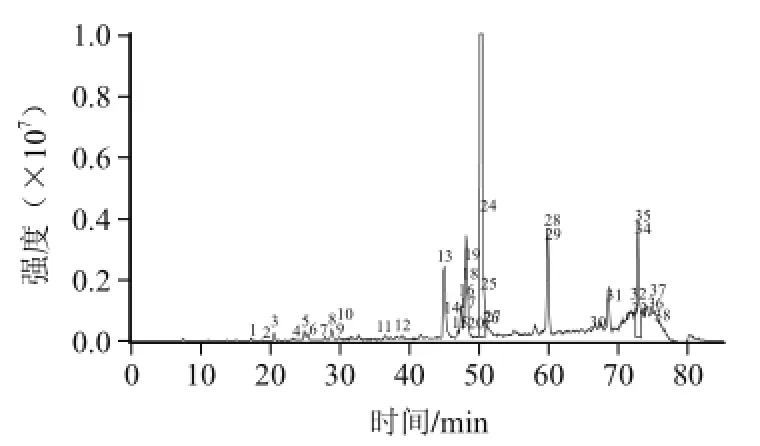
图3 南阳蜂胶乙酸乙酯提取物的总离子流图Fig.3 Total ion chromatogram of ethyl acetate extract of Nanyang propolis
分析色谱峰对应的紫外图谱、分子离子、碎片离子峰质荷比,通过与对照品相比较并结合参考相关文献[4,21-22]发现:南阳蜂胶乙酸乙酯提取物样品中含有选定的10种黄酮对照品中的7种黄酮,分别是槲皮素、芹菜素、山奈酚、异鼠李素、白杨素、松属素和高良姜素,此外,样品中可能还含有另外6种其他物质,结果见表5。

表5 蜂胶乙酸乙酯提取物中色谱峰的紫外光谱和碎片离子鉴定参数Table5 UV absorption wavelengths and ion fragment parameters of propolis chromatogram peaks
另外,比较图1、2可知,对照品溶液和南阳蜂胶乙酸乙酯提取物样品中的成分基本达到基线分离,结合方法学的考察结果可知,所建立的分析方法可以用于蜂胶乙酸乙酯提取物中成分的分离;通过与对照品图谱比较,发现南阳蜂胶乙酸乙酯提取物中不含有芦丁、杨梅黄酮、桑色素,而且槲皮素、异鼠李素含量很少。而GB/T 19427—2003《蜂胶中芦丁、杨梅酮、槲皮素等含量的测定》规定芦丁、杨梅酮、槲皮素、莰菲醇(山奈酚)、芹菜素、松属素、柯因(白杨素)、高良姜素这8种黄酮是蜂胶中主要存在的黄酮,本研究结果与该规定的差异性还需进一步分析,加以确认。但是在中国蜂胶中黄酮类化合物的部分研究中也没有检测到芦丁、杨梅酮、桑色素[3-4,6,23-25]。
由表5可知,除槲皮素、芹菜素、山奈酚、异鼠李素、白杨素、松属素和高良姜素7种黄酮外,在南阳蜂胶乙酸乙酯提取物中可能还含有了短叶松素、短叶松素-3-乙酸酯、短叶松素-3-丙酸酯、短叶松素-3-丁酸酯4种黄酮类化合物以及对甲氧基肉桂酸肉桂酯、咖啡酸苯乙酯2种酚酸酯类化合物。
3 结 论
本研究建立了分析蜂胶乙酸乙酯提取物的RP-HPLC条件:Thermo Hypersil GOLD C18色谱柱(250 mm×4.6 mm,5.0 μm);流动相为乙腈-0.3%甲酸;梯度洗脱:0~10 min,15%~20%;20~35 min,30%~35%;65~75 min,50%~95%;80~85 min,15%~15%;流速1 mL/min;柱温30 ℃;DAD检测器;检测波长280 nm。所建立的RP-HPLC-DAD分析方法使蜂胶乙酸乙酯提取物中大多数组分得到了基线分离,10种对照品黄酮的线性相关系数为0.998 2~0.999 9,加标回收率为93.40%~103.69%,且精密度、稳定性和加标回收率的RSD值均小于5%,方法具有准确、稳定、重复性好、加样回收率高等特点,可以用来分析蜂胶乙酸乙酯提取物中的黄酮及酚酸类化合物。
通过RP-HPLC-DAD-ESI-MS-MS分析并与对照品及文献对比,南阳蜂胶中可能存在有11种黄酮类化合物,分别为槲皮素、芹菜素、山奈酚、异鼠李素、白杨素、松属素、高良姜素、短叶松素、短叶松素-3-乙酸酯、短叶松素-3-丙酸酯和短叶松素-3-丁酸酯,而没有检测到芦丁和杨梅黄酮和桑色素;存在2种酚酸酯类化合物,分别为对甲氧基肉桂酸肉桂酯和咖啡酸苯乙酯。
[1] 董捷, 张红城, 尹策, 等. 蜂胶研究的最新进展[J]. 食品科学, 2007, 28(9): 639-642.
[2] SHI Hai ming, YANG Haisha, ZHANG Xiaowei, et al. Identification and quantification of phytochemical composition and anti-inflammatory and radical scavenging properties of methanolic extracts of Chinese propolis[J]. Journal of Agricultural and Food Chemistry, 60(50): 12403-12410.
[3] YANG Haisha, DONG Yuqong, DU Huijing, et a1. Antioxidant compounds from propolis collected in Anhui China[J]. Molecules, 2011, 16(4): 3444-3455.
[4] 符军放. 中国蜂胶中酚类化合物的色谱分析方法研究[D]. 西安: 西北大学, 2006: 29-66.
[5] 杨理, 闫清华, 邓月娥, 等. 高效液相色谱法检测蜂胶中黄酮类物质的研究[J]. 食品工业科技, 2010, 31(6): 353-355.
[6] 罗照明, 张红城. 中国蜂胶化学成分及其生物活性的研究[J]. 中国蜂业, 2012, 63(增刊2): 55-62.
[7] USIA T, BANSKOTA A H, TEZUKA Y, et al. Constituents of Chinese propolis and their antiproliferative activities[J]. Journal of Natural Products, 2002, 65(7): 673-676.
[8] SUN F, HAYAMI S, HARUNA S, et al. In vivo antioxidative activity of propolis evaluated by the interaction with vitamins C and E and the level of lipid hydroperoxides in rats[J]. Journal of Agricultural and Food Chemistry, 2000, 48(5): 1462-1465.
[9] RAMANAUSKIEN K, KALVENIEN Z, KASPARAVICIEN G, et al. Assay of correlation between antioxidantactivity of propolis extracts and their chemical components[J]. European Journal of Pharmaceutical Sciences, 2007, 96(5): 52-54.
[10] ONOENA Y, TAMERB C, OKSUZB H, et al. Comparative trial of different anti-bacterial combinations with propolis and ciprofloxacin on pseudomonas keratitis in rabbits[J]. Microbiological Research, 2007, 162(6): 62-68.
[11] OZGUNER F, OKTEM F, AYATA A, et al. A novel antioxidant agent caffeic acid phenethyl ester prevents long-term mobile phone exposureinduced renal impairment in rat[J]. Molecular and Cellular Biochemistry, 2005, 277(7): 73-80.
[12] 杨更森, 侯晓薇, 冯玲淑, 等. 蜂胶对主要致龋菌的体外抑菌实验报告[J]. 现代口腔医学杂志, 1998, 12(3): 176-177.
[13] 谢小梅, 陈和利, 王建红. 蜂胶、茶叶、丁香组方对变形链球菌抑制作用的实验研究[J]. 江西中医学院学报, 2002, 14(3): 20-22.
[14] DUARTE S, KOO H, BOWEN W H, et al. Effect of a novel type of propolis and its chemical fractions on glucosyl transferases and on growth and adherence of mutans streptococci[J]. Biological & Pharmaceutical Bulletin, 2003, 26(4): 527-531.
[15] 王贻节. 蜜蜂产品学[M]. 北京: 农业出版社, 1994: 227.
[16] 杨书珍, 彭丽桃, 潘思轶, 等. 蜂胶乙酸乙酯提取物对意大利青霉菌的抑制作用及稳定性研究[J]. 食品科学, 2009, 30(11): 87-90.
[17] SOLEY A, SIBEL S, DUYGU P, et al. Antimicrobial activity of poplar propolis on mutans streptococci and caries development in rats[J]. Turkish Journal of Biology, 2012, 36(3): 65-73.
[18] GABY B, MATTHIAS F M. Effects of propolis on hypoxanthinexanthine oxidase-induced toxicity in cultivated human cells and on neutrophil elastase activity[J]. Biological & Pharmaceutical Bulletin, 2005, 28(7): 1183-1186.
[19] ZHANG Yu, BAO Bili, LU Boyi, et al. Determination of flavone C-glucosides in antioxidant of bamboo leaves (AOB) fortified foods by reversed-phase high-performance liquid chromatography with ultraviolet diode array detection[J]. Journal of Chromatography A, 2005, 1065(5): 177-185.
[20] BOUE S M, CARTER-WIENTJES C H, SHIH B Y, et al. Identification of flavone aglycones and glycosides in soybean pods by liquid chromatography-tandem mass spectrometry[J]. Journal of Chromatography A, 2003, 991(1): 61-68.
[21] PELLATI F, ORLANDINI G, PINETTI D, et al. HPLC-DAD and HPLC-ESI-MS/MS methods for metabolite pro ling of propolis extracts[J]. Journal of Pharmaceutical and Biomedical Analysis, 2011, 55(4): 934-948.
[22] GARDANA C, SCAGLIANTI M, PIETTA P, et al. Analysis of the polyphenolic fraction of propolis from different sources by liquid chromatography-tandem mass spectrometry[J]. Journal of Pharmaceutical and Biomedical Analysis, 2007, 45(5): 390-399.
[23] 丽艳. 中国不同地区蜂胶醇提物化学组成及抗氧化活性[D]. 南昌:南昌大学, 2008: 46-69.
[24] 陈滨. 中国不同地区蜂胶水提物化学组成及生物活性[D]. 南昌: 南昌大学, 2010: 33-52.
[25] 罗照明, 董捷, 赵亮亮, 等. 河南蜂胶中多酚类物质成分分析[J]. 食品科学, 2013, 34(10): 139-143.
Separation and Identification of Ethyl Acetate Extract of Propolis by Reverse Phase-High Performance Liquid Chromatography-Mass Spectrometry
WANG Bing1,2, CHEN Yang1, LI Bao-li1, ZHU Yu-xuan1,2, TANG Cui-e1,2, HUANG Yan-chun1, ZHANG Di1, LIU Rui1,2,*
(1. Key Laboratory of Environment Correlative Dietology, Ministery of Education, Huazhong Agricultural University, Wuhan 430070, China; 2. Wuhan Research Center on Quality Control Engineering of Bee Products, Wuhan 430070, China)
The purpose of this study is to separate and identify ethyl acetate extract of propoils from Nanyang, central China’s Henan province by reverse phase-high performance liquid chromatography-diode array detector compled with electro spracy ionization-tandem mass spectrometry (RP-HPLC-DAD-ESI-MS-MS). A method for detecting 10 flavonoid reference standards was established using RP-HPLC-DAD. The linear correlation coefficients for the ten flavonoids were 0.998 2–0.999 9 and the recoveries were 93.40%–103.69%. The RSDs of precision, stability, and spiked recovery were all less than 5%. The ethyl acetate extract of Henan propolis was analysed by RP-HPLC-DAD-ESI-MS-MS. Totally 11 flavonoids were identified including quercetin, apigenin, kaempferol, isorhamnetin, chrysin, pinocembrin, galangin, pinobanksin, pinobanksin-3-O-acetate, pinobanksin-3-O-propionate, pinobanksin-3-O-butyrate and two phenolic acids and their esters.
propolis; reverse phase-high performance liquid chromatography-mass spectrometry (RP-HPLC-MS); flavonoids; phenolic acids and esters
TS201.2
A
1002-6630(2014)02-0186-05
10.7506/spkx1002-6630-201402035
2013-07-19
中央高校基本科研业务费专项(2013PY100);武汉市工程技术研究中心项目(200920137007)
王冰(1988—),女,硕士研究生,研究方向为农产品加工及贮藏工程。E-mail:hnwangbingforever@126.com
*通信作者:刘睿(1969—),男,副教授,博士,研究方向为蜂产品深加工及质量安全。E-mail:liurui@mail.hzau.edu.cn

