超声辅助提取香蕉皮多酚工艺优化及其抗氧化性的分析
陈 晨,胡文忠*,田沛源,姜爱丽
(大连民族学院生命科学学院,生物化学工程国家民委-教育部重点实验室,辽宁省食源性病原微生物快速检测与控制工程技术研究中心,辽宁 大连 116600)
超声辅助提取香蕉皮多酚工艺优化及其抗氧化性的分析
陈 晨,胡文忠*,田沛源,姜爱丽
(大连民族学院生命科学学院,生物化学工程国家民委-教育部重点实验室,辽宁省食源性病原微生物快速检测与控制工程技术研究中心,辽宁 大连 116600)
采用超声辅助技术从香蕉皮中提取多酚类物质,利用响应曲面法建立多酚提取率与液料比、乙醇体积分数、超声温度、超声时间之间的数学模型,确定香蕉皮多酚的适宜提取工艺参数;通过体外实验评价香蕉皮多酚的抗氧化能力。结果表明:多酚提取率模型拟合度良好,超声辅助提取香蕉皮多酚的适宜工艺参数为液料比9∶1(mL/g)、乙醇体积分数54%、超声温度53 ℃、超声时间43 min,在此条件下多酚提取率为2.931%,提取的香蕉皮多酚具有较强的清除DPPH自由基、超氧阴离子自由基和羟自由基的能力,半抑制质量浓度分别为0.422 8、0.255 2 mg/mL和0.243 9 mg/mL。
香蕉皮;多酚;超声辅助提取;响应曲面;抗氧化
香蕉皮是香蕉加工产业的主要副产物,约占香蕉全果质量的30%,2011年我国香蕉种植面积超过36.67万公顷,产量约为950万t[1],意味着2011年我国约产生了300万t的香蕉皮,而目前香蕉皮除少数做动物饲料应用外,大多被废弃。香蕉皮中主要含有多酚、果胶、纤维素、有机酸、蛋白质和糖类,还有多种维生素和无机盐等营养成分[2-3]。多酚是广泛存在于植物体内的一类多元酚类化合物,大量研究[4-6]结果表明,多酚具有抗癌、抗菌、抗氧化和预防心脑血管疾病等多种生物活性。以香蕉皮为原料提取多酚,不仅能减轻环境污染,还可以创造经济效益。
超声辅助提取是一项新型的天然产物辅助溶剂提取技术,超声波产生的热效应、机械作用和空化效应可以使原料细胞壁快速破碎,促进提取剂进入细胞内与目标提取成分充分混合,加速胞内物质溶出、扩散和释放,有助于提取效率的提高[7-9]。超声波技术现已广泛应用于植物多酚物质的提取[10-13]。本实验通过超声辅助提取香蕉皮多酚,采用响应曲面法优化香蕉皮多酚的适宜提取工艺,并通过体外实验探讨了香蕉皮多酚的抗氧化活性,目的是进一步挖掘香蕉皮的可利用程度,为开发香蕉皮多酚抗氧化类产品提供技术依据。
1 材料与方法
1.1 材料与试剂
香蕉皮:菲律宾产成熟鲜香蕉,购于大连新玛特超市,取皮用于实验。
没食子酸、1,1-二苯基-2-三硝基苯肼(1,1-diphenyl-2-picrylhydrazyl radical 2,2-diphenyl-1-(2,4,6-trinitrophenyl)hydrazyl,DPPH)、三羟甲基氨基甲烷(Tris) 美国Sigma公司;福林试剂、碳酸钠、硫酸亚铁、邻苯三酚、乙醇、盐酸、碳酸钠等均为分析纯。
1.2 仪器与设备
KQ5200DB型数控超声波清洗器 昆山市超声仪器有限公司;OKS-型电热恒温水浴锅 上海中新医疗仪器有限公司;电子天平 梅特勒-托利多仪器上海有限公司;UV-2550型紫外-可见分光光度计 日本岛津公司;X-30R超速冷冻离心机 美国贝克曼库尔特有限公司;LD85箱式冷冻干燥仪 美国Millrock科技公司。
1.3 方法
1.3.1 香蕉皮多酚的提取
准确称取一定量香蕉皮,切片、沸水中热烫5 min以钝化多酚氧化酶的活性。冷却后破碎均质转移到100 mL丝扣瓶中,加入浸提剂(乙醇溶液)。放入功率200 W频率40 kHz超声清洗器或50 ℃水浴锅中,在不同的条件下浸提香蕉皮多酚。浸提后,用冷冻高速离心机对萃取液以低温(控制在5 ℃以下)10 000 r/min离心15 min。取上清液于40 ℃条件下真空旋转蒸发回收乙醇,所得浓缩液真空冷冻干燥,得香蕉皮多酚提取物,用于抗氧化活性的测定。
1.3.2 多酚含量的测定
采用福林酚法[14]进行测定。吸取1 mL香蕉皮多酚提取液(适当的稀释),加入福林试剂0.2 mL,混匀,在0.5~8 min内加入1 mL 20%的Na2CO3溶液,充分混合,30 ℃避光放置0.5 h后,在波长760 nm处测吸光度。以没食子酸为标样,制作标准曲线,所得标准曲线方程为:y=0.442 4x+0.002 3(R2=0.999 8)。多酚提取率(以干质量计)按公式(1)计算:

1.3.3 香蕉皮多酚提取工艺优化
1.3.3.1 单因素试验
分别考察液料比(5∶1、7∶1、10∶1、12∶1、15∶1、18∶1,mL/g)、超声温度(30、40、50、60、70、80 ℃)、乙醇体积分数(30%、40%、50%、60%、70%、80%)和超声时间(20、30、40、50、60、70 min)对香蕉皮多酚提取率的影响。
1.3.3.2 响应曲面试验
在单因素试验基础上,根据Box-Behnken试验设计原理,以X1(液料比)、X2(乙醇体积分数)、X3(超声温度)、X4(超声时间)为自变量,以香蕉皮多酚提取率Y为响应值,设计四因素三水平的响应面分析试验。试验因素和水平的取值见表1。对响应面试验结果所得数据采用Design-Expert 8.05软件进行分析和作图。

表1 响应面优化试验因素水平编码表Table1 Codes and levels of factors for RSM experiments
1.3.4 DPPH自由基清除能力的测定
根据Monica等[15]的方法稍作修改。取样品溶液2.00 mL,加入2.00 mL 0.1 mmol/L DPPH乙醇溶液混匀,避光放置30 min,在517 nm波长处测定吸光度At;同法取2.00 mL蒸馏水加入2.00 mL 0.1 mmol/L DPPH溶液混匀,测定吸光度A0;取2.00 mL待测样品加入2.00 mL乙醇混匀,测定吸光度Ab。DPPH自由基清除能力可用公式(2)表示:

1.3.5 羟自由基清除能力的测定
采用水杨酸法[16]测定。取2 mL样品于具塞试管中,依次加入2 mL 6 mmol/L FeSO4、2 mL 6 mmol/L水杨酸-乙醇溶液、2 mL 6 mmol/L H2O2溶液,在37 ℃反应30 min后,在波长510 nm处测定吸光度AX,未加入H2O2的溶液的吸光度AX0,按相同方法测定未加入样品的溶液吸光度A0,均以蒸馏水为参比溶液。羟自由基清除能力可用公式(3)表示:

1.3.6 超氧阴离子自由基清除能力的测定
采用邻苯三酚自氧化法[17]测定。将待测样品溶液1.0 mL加入1.8 mL 0.05 mol/L的Tris-HCl缓冲液(pH 8.2),空白组加入同体积蒸馏水,于25 ℃保温10 min,再加入100 øL 25 ℃预热的0.01 mol/L邻苯三酚溶液,(空白以等量10 mmol/L的HCl溶液代替),迅速摇匀,在320 nm波长处,每隔0.5 min测定1次吸光度,线性时间为4 min,吸光度的斜率表示邻苯三酚自氧化速率,邻苯三酚自氧化速率记为’A0,加入香蕉皮多酚后邻苯三酚氧化速率记为’A1。超氧阴离子自由基清除能力可用公式(4)表示:

2 结果与分析
2.1 香蕉皮多酚提取率的比较
首先比较未使用超声波与使用超声波辅助提取香蕉皮多酚的提取率。在相同的实验条件下(液料比10∶1、乙醇体积分数50%、超声温度50 ℃、超声时间30 min),超声辅助提取香蕉皮多酚的提取率为2.681%,显著高于未使用超声辅助的多酚提取率1.206%(P<0.05),说明超声辅助有助于香蕉皮多酚的提取。马亚琴等[18]利用100 kHz的超声波辅助提取温州蜜柑皮中的多酚类物质,结果表明超声辅助提取能显著提高总酚的提取率并增强抗氧化能力。D’Alessandro等[12]研究表明采用超声辅助能使黑果腺肋花楸多酚的提取率增加85%。
2.2 香蕉皮多酚提取的单因素试验
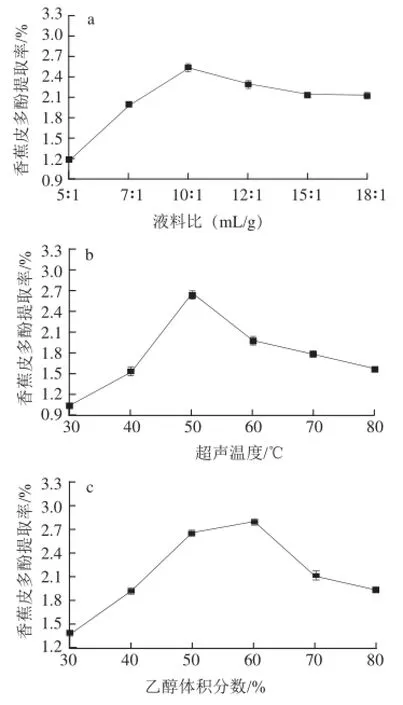

图1 液料比(a)、超声温度(b)、乙醇体积分数(c)和超声时间(d)对香蕉皮多酚提取率的影响Fig.1 Effects of liquid-to-material ratio, ultrasonic temperature, ethanol concentration, ultrasonic radiation time on polyphenol yield
在超声温度50 ℃、乙醇体积分数50%、超声温度30 min的条件下,研究液料比对香蕉皮多酚提取率的影响。结果如图1a所示,随着液料比增大,多酚提取率逐渐上升,当达到10∶1后提取率开始缓慢下降,说明多酚的溶出量已达饱和,从节约溶剂的角度考虑,液料比的考察范围定为12∶1~8∶1。
图1b显示了在液料比10∶1、乙醇体积分数50%、超声时间30 min的条件下,不同超声温度对香蕉皮多酚提取率的影响,可以看出香蕉皮多酚的提取率随着温度的升高先增大后减小,当温度为50 ℃时提取率最大。一般来说温度越高越有利于植物多酚物质的提取[19],但随着温度升高使能量消耗增大、成本增加,同时较高的温度使多酚的化学结构遭到破坏,此外在高温条件下也会导致乙醇挥发,使液料比改变,从而影响多酚的提取率[20-21]。
多酚是一类极性范围很广的化合物,当提取溶剂的极性与多酚的极性接近时,有利于多酚的提取。因此本研究在液料比10∶1、超声温度50 ℃、超声时间30 min的条件下,研究不同乙醇体积分数对多酚提取率的影响。结果如图1c所示,香蕉皮多酚的提取率随着乙醇体积分数增加而逐渐增大,乙醇体积分数为60%时,多酚提取率最大,当体积分数大于60%后,多酚提取率逐渐降低。这主要是因为在植物体内多酚一部分以游离的形式存在液泡中,一部分以与蛋白质、多糖通过氢键或疏水健结合的形式存在于细胞壁中,当乙醇体积分数过高时,高体积分数的乙醇使蛋白质变性,影响与之结合多酚的溶出,从而导致多酚提取率的下降[22]。
固定液料比10∶1、乙醇体积分数60%、超声温度50 ℃,研究超声时间对香蕉皮多酚提取率的影响。结果如图1d所示,随着超声时间的延长,超声波对物料作用更加充分,多酚的溶出量也逐渐增大,40 min时达到最大量,延长超声时间使提取率逐渐下降,这可能是因为长时间超声振动导致多酚结构破坏[11],此外超声时间延长也会增加能耗,因此将超声时间的考察范围定为30~50 min。
2.3 回归方程的建立与分析

表2 响应面优化试验的方案设计及结果Table2 Experimental design and results for optimization of extraction parameters by RSM
采用Design-Expert 8.05软件对表2的响应面试验结果进行分析,得到试验条件与响应值间的回归模型:
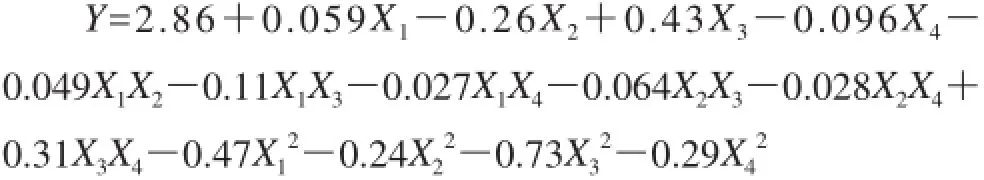
对回归模型进行方差分析(表3)发现,得到的回归模型极显著,失拟检验不显著,决定系数(= 0.992 1,模型的拟合程度高,试验误差小,说明该回归模型能较好地描述各因素与响应值间的关系,利用此方程模型确定超声辅助提取香蕉皮多酚的工艺参数是可行的。
对回归模型进行显著性检验可知,X1、X2、X3、X4、X1X3、X2X3、X3X4、X12、X22、X23、X24对多酚的提取率有显著影响,其他因素影响不显著。对回归模型进行中心标准化处理,可以直接从回归系数绝对值的大小来分析各个因素的变化对多酚提取率的影响,依次为超声温度、乙醇体积分数、超声时间和液料比。

表3 回归模型方差分析Table3 Analysis of variance for the fitted regression equation
分别将模型中的2个因素固定在0水平上,得到另外两个因素交互作用对多酚提取率的子模型,用Design-Expert 8.05软件的Model Graph程序做响应曲面图,见图2。


图2 各因素对香蕉皮多酚提取率影响的响应面图Fig.2 Response surface plots for the effects of liquid-to-material ratio, ethanol concentration, temperature and ultrasonic radiation time on polyphenol yield
通过观察图2中响应曲面的变化情况和等高线的疏密程度可知,超声温度与液料比、超声时间、乙醇体积分数的交互作用对香蕉皮多酚提取率的影响比较强烈,图2a和图2e中的响应面变化趋势平缓,表明乙醇体积分数与超声时间、液料比的交互作用对多酚提取率的影响较小。从图2可以看出,Y值随着4个因素的变化均为开口向下的抛物线,即随着4个因素值的单独增加,多酚提取率的变化趋势都是先增加后降低的,当液料比8.7~9.4(mL/g)、乙醇体积分数52%~57%、超声温度51~58 ℃、超声时间35~44 min的范围内时,多酚提取率保持在较高值。
2.4 适宜条件和回归模型的验证
采用Design-Expert 8.05软件对得到的回归模型进行优化处理,得到超声辅助提取香蕉皮多酚的适宜工艺条件为液料比9∶1(mL/g)、乙醇体积分数54%、超声温度53 ℃、超声时间43 min,预测香蕉皮多酚的提取率为2.956%,在此条件下,多酚提取率的实验验证值为2.931%,验证值与预测值误差在±1%以内,说明本研究优化得到的提取香蕉皮多酚工艺参数是可靠的,具有实用价值。
2.5 香蕉皮多酚的抗氧化性分析
自由基是一类含有未配对电子的分子、原子或原子基团,正常情况下人体内自由基的产生和清除处于动态平衡,然而衰老及一些环境不利因子会引起体内的自由基代谢失衡,导致自由基累积,过量的自由基会给机体造成不可逆转的氧化损伤,从而加快衰老,诱发心血管疾病、癌症、糖尿病等诸多疾病[23]。多酚是一类活性较强的抗氧化物质,多酚具有供氢能力因而可有效清除自由基,同时还可与过氧化自由基结合使其成为稳定的化合物,另外多酚还可以通过抑制氧化酶和络合金属离子等起到抗氧化作用[24]。本实验研究了香蕉皮多酚对DPPH自由基、超氧阴离子自由基和羟自由基的清除能力,测定了香蕉皮多酚对3种自由基的半抑制质量浓度(half maximal (50%) inhibitory concentration,IC50)。半抑制质量浓度是指清除率为50%时抗氧化剂的质量浓度,IC50越小,抗氧化剂清除自由基的能力越强[25]。从表4可以看出,香蕉皮多酚对羟自由基、DPPH自由基和超氧阴离子自由基均有一定的清除能力,且对3种自由基的清除能力存在一定的差异。香蕉皮多酚提取物的羟自由基清除能力高于同质量浓度的抗坏血酸,而超氧阴离子自由基和DPPH自由基清除率均小于同质量浓度的抗坏血酸,这可能与香蕉皮多酚粗提物中主要活性物质的纯度有关。今后仍需进一步测定香蕉皮多酚种类和含量,并对香蕉皮多酚粗提取物中的主要活性物质进行分离纯化。

表4 香蕉皮多酚和抗坏血酸对3种自由基的半抑制质量浓度Table4 IC50 values of banana peel polyphenols and ascorbic acidagainst three free radicals
3 结 论
在相同的提取条件下,使用超声波辅助提取香蕉皮多酚的提取率(2.681%)显著高于未使用超声技术提取多酚的提取率(1.206%)。超声辅助提取香蕉皮多酚的提取条件优化数学回归模型是:超声辅助提取香蕉皮多酚的适宜工艺条件为液料比9∶1(mL/g)、乙醇体积分数54%、超声温度53 ℃、超声时间43 min,在此条件下多酚提取率为2.931%。香蕉皮多酚具有较强的清除DPPH自由基、超氧阴离子自由基和羟自由基的能力,IC50分别为0.422 8、0.255 2 mg/mL和0.243 9 mg/mL。
参考文献:
[1] 柯佑鹏, 过建春, 张锡炎, 等. 2012年我国香蕉产业发展趋势与建议[J]. 中国果业信息, 2012(5): 29-31.
[2] EMAGA T H, ANDRIANAIVO R H, WATHELET B, et al. Effects of the stage of maturation and varieties on the chemical composition of banana and plantain peels[J]. Food Chemistry, 2007, 103(2): 590-600.
[3] 王娜. 香蕉皮中多酚物质的提取分离及含量测定[D]. 西安: 西安理工大学, 2010.
[4] GONZ˘LEZ-MONTELONGO R, LOBO G M, MÓNICA G. Antioxidant activity in banana peel extracts: testing extraction conditions and related bioactive compounds[J]. Food Chemistry, 2010, 119: 1030-1039.
[5] LEE J H, PARK K H, LEE M H, et al. Identification, characterisation, and quantification of phenolic compounds in the antioxidant activitycontaining fraction from the seeds of Korean perilla (Perilla frutescens) cultivars[J]. Food Chemistry, 2013, 136: 843-852.
[6] 柯春林, 王娣, 谢海伟. 等. 多酚化合物抗菌活性的最新进展[J]. 食品工业科技, 2012, 33(17): 405-408.
[7] 徐怀德, 闫宁环, 陈伟, 等. 黑莓原花青素超声波辅助提取优化及抗氧化性研究[J]. 农业工程学报, 2008, 24(2): 264-269.
[8] VILKHU K, MAWSON R, SIMONS L, et al. Applications and opportunities for ultrasound-assisted extraction in the food industry: a review[J]. Innovative Food Science and Emerging Technologies, 2008, 9: 161-169.
[9] CHEMAT F, HUMA Z, KHAN M K. Applications of ultrasound in food technology: processing, preservation and extraction[J]. Ultrasonics Sonochemistry, 2011, 18: 813-835.
[10] KHAN MK, ABERT-VIAN M, FABIANO-TIXIER A S. Ultrasoundassisted extraction of polyphenols (flavanone glycosides) from orange (Citrus sinensis L.) peel[J]. Food Chemistry, 2010, 119: 851-858.
[11] CARRERA C, RUIZ-RODR¸GUEZ A, PALMA M. Ultrasound assisted extraction of phenolic compounds from grapes[J]. Analytica Chimica Acta, 2012, 732: 100-104.
[12] D’ALESSANDRO L G, KRIAA K, NIKOV I, et al. Ultrasound assisted extraction of polyphenols from black chokeberry[J]. Separation and Purification Technology, 2012, 93: 42-47.
[13] 赵萍, 林樱姬, 金征宇, 等. 超声辅助提取花生红衣中多酚物质及其抗氧化活性的研究[J]. 食品科学, 2010, 31(12): 53-57.
[14] LIU Jun, JIA Liang, KAN Juan, et al. In vitro and in vivo antioxidant activity of ethanolic extract of white button mushroom (Agaricus bisporus)[J]. Food and Chemical Toxicology, 2013, 51: 310-316.
[15] MONICA L, ROBERTO G, FABIANO T, et al. Study of the DPPH scavenging activity: development of a free software for the correct interpretation of data[J]. Food Chemistry, 2009, 114: 889-897.
[16] 田成. 桂花果实多酚的超声波提取及抗氧化活性研究[J]. 食品科学, 2011, 32(24): 106-110.
[17] 苏晓雨, 王振宇. 红松种子壳多酚物质的提取及抗氧化特性[J]. 农业工程学报, 2009, 21(增刊1): 198-203.
[18] 马亚琴, 叶兴乾, 吴厚玖. 温州蜜柑皮多酚物质的超声提取及抗氧化特性[J]. 食品科学, 2011, 32(22): 100-104.
[19] HARBOURNE N, JACQUIER J C, O’RIORDAN D. Optimisation of the aqueous extraction conditions of phenols from meadowsweet (Filipendula ulmaria L.) for incorporation into beverages[J]. Food Chemistry, 2009, 116: 722-729.
[20] 令博, 王捷, 吴洪斌. 葡萄皮渣多酚超声波辅助提取工艺响应面法优化及抗氧化活性研究[J]. 食品科学, 2011, 32(18): 24-29.
[21] PRASAD K N, YANG E, YI C, et al. Effects of high pressure extraction on the extraction yield, total phenolic content and antioxidant activity of longan fruit pericarp[J]. Innovative Food Science and Emerging Technologies, 2009, 10: 155-159.
[22] YANG Li, JIANG Jianguo, LI Weifeng, et al. Optimum extraction process of polyphenols from the bark of Phyllanthus emblica L. based on the response surface methodology[J]. Journal of Separation Science, 2009, 32: 1437-1444.
[23] URSO M L, CLARKSON P M. Oxidative stress, exercise and antioxidant supplementation[J]. Toxicology, 2003, 189: 41-45.
[24] 陈树俊, 冯斌, 刘诚. 山西老陈醋多酚提取物抗氧化活性研究[J]. 食品科学, 2012, 33(1): 31-34.
[25] 李姣娟, 黄克瀛, 龚建良, 等. 油茶叶乙醇提取物清除DPPH自由基作用的研究[J]. 林产化学与工业, 2008, 28(2): 82-86.
Optimization of Ultrasound-Assisted Extraction of Polyphenols from Banana Peel and Their Antioxidant Capacity
CHEN Chen, HU Wen-zhong*, TIAN Pei-yuan, JIANG Ai-li
(Research Center of Engineering and Technology for Rapid Detection of Foodborne Microorganisms and Control, Key Laboratory of Biochemical Engineering, The State Ethnic Affairs Commission, Ministry of Education, College of Life Science, Dalian Nationalities University, Dalian 116600, China)
Response surface methodology (RSM) was employed to optimize liquid-to-material ratio, ethanol concentration, ultrasound radiation time and temperature to obtain a high yield of polyphenols from banana peel by an ultrasonic-assisted extraction technique. The antioxidant activities of polyphenols extracted from banana peel were evaluated by in vitro assays. The results showed that the RSM model developed was able to describe the relationship between the factors (extraction parameters) and the response variable (polyphenol yield). The optimized conditions were determined as follows: solventto-solid ratio, 9:1 (mL/g); ethanol concentration, 54%; temperature, 53 ℃; and ultrasound radiation time, 43 min. Under these conditions, the polyphenol yield obtained was 2.931%. The resulting extract exhibited significant 2,2-diphenyl-1-picrylhydrazyl (DPPH), superoxide anion and hydroxyl radical scavenging activities, and the concentrations for 50% inhibition (IC50) were 0.422 8, 0.255 2 and 0.243 9 mg/mL, respectively.
banana peel; polyphenol; ultrasound assisted extraction; response surface methodology; antioxidant activity
TS201.1
A
1002-6630(2014)02-0012-06
10.7506/spkx1002-6630-201402003
2013-01-10
“十二五”国家科技支撑计划项目(2012BAD38B05);国家自然科学基金面上项目(31172009);大连市科技计划项目(2012E13SF106);大连民族学院博士启动基金项目(0701-110014)
陈晨(1986—),女,讲师,博士,研究方向为食品质量与安全。E-mail:chenchen@dlnu.edu.cn
*通信作者:胡文忠(1959—),男,教授,博士,研究方向为采后生物学与技术。E-mail:hwz@dlnu.edu.cn

