高速逆流色谱分离纯化苦荞中芦丁、槲皮素
朱 琳,任 清*,徐笑颖
(北京工商大学食品学院,食品添加剂与配料北京高校工程研究中心,北京 10004 8)
高速逆流色谱分离纯化苦荞中芦丁、槲皮素
朱 琳,任 清*,徐笑颖
(北京工商大学食品学院,食品添加剂与配料北京高校工程研究中心,北京 10004 8)
利用乙醇溶液提取苦荞麸皮中总黄酮,将得到的苦荞黄酮粗提物用DA-201大孔树脂进行初步纯化。以得到的黄酮初步纯化产物为原料,应用高速逆流色谱对其中的芦丁和槲皮素进行分离、纯化。所用两相溶剂体系为乙酸乙酯-正丁醇(4∶1∶5,V/V),上相为固定相,下相为流动相,流速2 mL/min,转速850 r/min,检测波长254 nm。所得产物经高效液相色谱检测,结果表明得到芦丁纯度为99%,槲皮素纯度为94%。表明该法分离制备苦荞麸皮中芦丁、槲皮素简便,所得产物纯度高。
苦荞;芦丁;槲皮素;高速逆流色谱
荞麦又名乌麦、花麦或三角麦,有甜荞和苦荞两个可食品种。俄罗斯是荞麦种植第一大国,我国第二,但我国的苦荞种植面积和产量均居世界第一位[1]。荞麦营养丰富[2-3],其中生物类黄酮是苦荞最为重要的生物活性物质之一,赋予苦荞多种生理功能,主要有抗氧化[4]、抑菌[5]、降血糖[6]、降血脂、抗肿瘤等多种药理活性。苦荞麸皮是苦荞麦片和苦荞制粉生产过程中的副产品,研究表明苦荞麦麸皮中总黄酮含量可达6%~7%[7],主要成分有槲皮素、山柰酚和芦丁等,而其中芦丁含量高达70%~90%[8]。从苦荞麦中提取黄酮类化合物作为保健食品或药品的原料具有较好的前景。
高速逆流色谱(high-speed counter-current chromatography,HSCCC)是一种液-液分配色谱技术。HSCCC不用任何固体载体或支撑体作为固定相,避免了样品的不可逆性吸附和样品组分的化学变性等,使样品的完全回收成为可能,同时还具有应用范围广、仪器操作简单、分离量大等优点[9],因而近年来在天然产物领域得到了较为广泛的关注和应用[10]。而将HSCCC应用于分离苦荞麸皮中的黄酮类物质在国内外鲜见报道。本实验以苦荞籽粒为原料,研究苦荞麸皮总黄酮的提取及分离纯化工艺,运用HSCCC分离苦荞麸皮中的黄酮类物质,以期得到分离苦荞麸皮中黄酮的快速简便的方法。
1 材料与方法
1.1 材料与试剂
苦荞籽粒 山西农业科学院农产品加工研究所。
芦丁对照品(98%) 百灵威科技有限公司;槲皮素对照品(98%) 上海同田生物技术股份有限公司;DA-201大孔树脂 江苏苏青水处理工程集团有限公司;乙腈、甲醇(色谱纯) 美国Fisher公司;亚硝酸钠、硝酸铝等均为分析纯。
1.2 仪器与设备
T6新世界紫外-可见光分光光度计 北京普析通用仪器有限公司;RE-52AA旋转蒸发器 上海亚荣生化仪器厂;2-4 LSC真空冷冻干燥机 德国 Christ公司;1100高效液相色谱系统(配有DAD检测器) 美国Agilent公司;Ultimate XB-C18(4.6 mm×250 mm,5 μm)色谱柱月旭材料科技(上海)有限公司;TBE-300A半制备型高速逆流色谱仪(柱体积280 mL;配有S-1007型微机单缸泵;TBD-23UV Detector紫外检测器;N2000双通道色谱工作站) 浙江大学智达信息工程有限公司。
1.3 方法
1.3.1 苦荞预处理及总黄酮的提取
1.3.1.1 苦荞预处理工艺路线
苦荞籽粒→洗净干燥→粉碎机粉碎→过100目筛(除去淀粉)→过40目筛得到苦荞麸皮。
1.3.1.2 溶液的制备
对照品溶液[11]:准确称取真空干燥至恒质量的芦丁对照品0.010 0 g,用体积分数30%乙醇水浴微热溶解,并完全转入100 mL容量瓶中,用30%乙醇定容,制成0.100 0 mg/mL的芦丁标准溶液。
样品溶液[12]:准确称取过40目筛的苦荞麸皮10.000 g,按料液比1∶10加入体积分数60%乙醇溶液,在80 ℃水浴中搅拌提取,提取2次,每次提取2 h。将提取液减压抽滤,得到待测样品溶液。将样品溶液真空浓缩,冷冻干燥,得到苦荞黄酮粗提物。
1.3.1.3 芦丁标准曲线的绘制[13]
精密吸取0.00、1.00、2.00、3.00、4.00、5.00 mL上述芦丁标准溶液,分别 置于6支10 mL刻度试管中,加30%乙醇至5 mL,加5% NaNO2溶液0.30 mL,摇匀后放置5 min,加10% Al(NO3)3溶液0.30 mL,摇匀后放置6 min,加4% NaOH溶液2.00 mL,再用30%乙醇稀释至刻度,摇匀后放置10 min,置l cm比色皿中在510 nm波长处测定吸光度,以吸光度为纵坐标,以芦丁质量浓度(mg/mL)为横坐标得标准曲线y=0.150 2x+0.002 4,R2=0.999 9,表明芦丁标准曲线的线性好。
1.3.1.4 样品总黄酮含量及粗提物纯度的测定
将黄酮样品溶液稀释适当的倍数,取3 mL稀释溶液加2 mL 30%乙醇,处理方法同1.3.1.3节,根据吸光度从标准曲线回归方程求出苦荞中总黄酮的含量,为4.30%。称取一定量的黄酮粗提物,用30%乙醇溶解,用相同方法得出其中总黄酮的量并计算纯度,为40.2%。
1.3.2 苦荞麸皮黄酮的初步纯化
1.3.2.1 DA-201大孔树脂预处理[14]
取一定量的树脂,用95%的乙醇浸泡24 h,然后用乙醇洗涤,直到洗出液中加适量蒸馏水无白色浑浊现象,再用蒸馏水洗至无醇。依次用4% NaOH溶液、5% HCl溶液浸泡2~4 h,分别用蒸馏水洗至中性,将预处理好的DA-201树脂湿法装入20 mm×300 mm玻璃层析柱中。
1.3.2.2 DA-201大孔树脂纯化工艺[15]
将提取液真空(60 ℃,0.09 MPa)浓缩,加水制成0.75 mg/mL的黄酮溶液100 mL,以2 mL/min流速通过DA-201树脂柱,用蒸馏水洗至无色,再用150 mL 70%的乙醇以2 mL/min洗脱并收集洗脱液,真空浓缩,冷冻干燥,制得初步纯化苦养麸皮黄酮,并测定其纯度。
1.3.3 苦荞麸皮黄酮的纯化物的高效液相色谱(high performance liquid chromatography,HPLC)分析
1.3.3.1 HPLC色谱条件
色谱柱:Ultimate XB-C18(4.6 mm×250 mm,5 μm);波长:375 nm;流动相A:0.05%(V/V)冰醋酸溶液;流动相B:乙腈;流速:0.8 mL/min;进样量:20 øL;梯度洗脱:0~8 min、18% B,8~18 min、18%~28% B,18~28 min、28% B,28~35 min、28%~100% B,35~40 min、100% B,40~45 min、18% B。
1.3.3.2 芦丁、槲皮素标准曲线制作及样品测定
混合对照品溶液制备[16]:分别精密称取对照品芦丁100 mg、槲皮素2.5 mg于10 mL容量瓶中,用甲醇定容,再将溶液稀释10倍,配成质量浓度分别为1.00 mg/mL和0.025 mg/mL的混合对照品贮备液。
样品溶液制备:精密称取纯化的样品10 mg于10 mL容量瓶中,用甲醇定容,配成质量浓度1 mg/mL的样品溶液。
标准曲线制作:将混合对照品溶液分别进样10、15、20、25、30 øL,以对照品的质量(mg)为横坐标,峰面积为纵坐标绘制标准曲线。
样品溶液的测定:取样品溶液进样20 øL,按上述HPLC方法进行测定,记录峰面积,根据标准曲线回归方程计算样品中芦丁和槲皮素的含量。
1.3.4 苦荞麸皮黄酮的HSCCC纯化
1.3.4.1 溶剂体系的选择[17]
溶剂体系的选择对分离效果至关重要。研究表明,一个好的溶剂系统应满足下列要求:固定相要有较高的保留率;两相溶剂系统的分层时间小于30 s;分配系数K应尽量符合0.5<K<2[18]。
参照Ito溶剂体系选择方法[19],对比氯仿-甲醇-水体系,本实验选用毒性较小的乙酸乙酯-正丁醇-水体系,所选用的3种溶剂的配比分别为:2∶3∶5、3∶2∶5、4∶1∶5、5∶0∶5以及正己烷-乙酸乙酯-甲醇-水1∶5∶1∶5、2∶5∶2∶5、3∶5∶3∶5,利用HPLC分别测定在不通过溶剂体系中芦丁和槲皮素的分配系数。
分配系数的测定方法[20]:取约4 mg苦荞黄酮纯化物于10 mL玻璃试管中,加入预先达到平衡的两相溶剂系统的上相和下相各4 mL于此试管中,超声振荡混匀,使黄酮纯化物充分溶解。待达到分配平衡后,分别取上相和下相各1 mL,水浴蒸干后用1 mL色谱纯甲醇溶解,经HPLC检测后得到上相中化合物的峰面积A1和下相中化合物的峰面积A2,则分配系数K=A1/A2。
1.3.4.2 HSCCC分离苦荞麸皮黄酮中芦丁、槲皮素
在分液漏斗中按比例配制两相溶剂系统,充分振摇后静置,使用前分取上下相,超声脱气后泵入逆流色谱仪。先将HSCCC分离管中充满上相,调整主机转速为850 r/min,再以2 mL/min流速泵入下相,待流动相从柱出口流出,表明两相在分离管中建立了动态平衡。取初步纯化黄酮样品80 mg溶于8 mL流动相中,由进样阀进样,流出液用紫外检测器在254 nm波长处进行检测,同时记录色谱图,根据色谱图接收各流分[21]。
1.3.4.3 HPLC检验纯度
按1.3.3.1节的HPLC条件,对收集到的各流分中芦丁、槲皮素含量进行测定,对照标准曲线回归方程得到经HSCCC纯化后的芦丁与槲皮素的纯度。
2 结果与分析
2.1 HPLC分析芦丁、槲皮素对照品标准曲线绘制

图1 芦丁、槲皮素混合标品HPLC图谱Fig.1 HPLC profiles of mixed standards of rutin and quercetin
由图1可知,芦丁保留时间为15.023 min,槲皮素保留时间为33.476 min。按照1.3.3.2节方法,绘制得芦丁标准曲线:y=1×106x-27 935,R2=0.999 9;槲皮素标准曲线:y=1×106x+56 786,R2=0.999 5。
2.2 大孔树脂初步纯化的黄酮中芦丁、槲皮素含量的HPLC测定
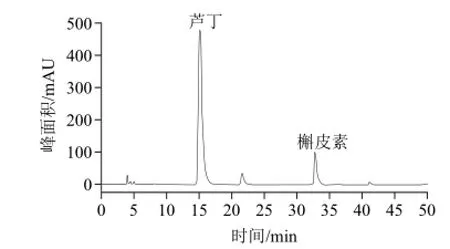
图2 大孔树脂纯化物的HPLC图谱Fig.2 HPLC profiles of the products purified by macroporous resin chromatography
利用吸光度法得,经大孔树脂纯化所制得的样品中总黄酮含量为88.4%。对经大孔树脂初步纯化的样品进行HPLC分析,得出样品中芦丁、槲皮素含量分别为80.5%与3.01%。
2.3 HSCCC分配系数的测定

表1 不同溶剂体系中芦丁、槲皮素的分配系数Table1 Partition coefficients of rutin and quercetin in solvent systems with different proportions
组分在HSCCC达到良好的分离,需满足分配系数0.5<K<2,且组分的分配系数有较大的差距,从表1可以看出,乙酸乙酯-正丁醇-水(4∶1∶5)的芦丁分配系数在0.5~2,但槲皮素分配系数较大,会出现出峰时间较长,峰形变宽,本实验采用反推洗脱模式,在芦丁出峰结束后,将槲皮素组分反推出来,可缩短分离时间。而正己烷-乙酸乙酯-甲醇-水(3∶5∶3∶5)体系中芦丁分配系数较小,槲皮素分配系数较为合适,会造成芦丁出峰时间过早,不易分离,但有利于芦丁、槲皮素的一次分离,所以本实验选用乙酸乙酯-正丁醇-水(4∶1∶5)与正己烷-乙酸乙酯-甲醇-水(3∶5∶3∶5)体系进行HSCCC分离纯化,并分别检验其纯度。
2.4 初步纯化苦荞黄酮的HSCCC分离
按1.3.4.2节的方法对经大孔树脂纯化的苦荞黄酮进行HSCCC分离纯化,溶剂体系选用乙酸乙酯-正丁醇-水(4∶1∶5)与正己烷-乙酸乙酯-甲醇-水(3∶5∶3∶5),固定相保留率分别为50%、66.7%。洗脱时间分别为4、5 h。在乙酸乙酯-正丁醇-水(4∶1∶5)体系的180 min时采用反推模式,主机调为反转,将流动相换成固定相。两体系的高速逆流图谱如图3、4所示。

图3 乙酸乙酯-正丁醇--水(4∶1∶5)体系高速逆流色谱图Fig.3 HSCCC profiles of flavonoids in ethyl acetate-n-butyl alcoholwater (4:1:5, V/V)

图4 正己烷-乙酸乙酯-甲醇--水(3∶5∶3∶5)体系高速逆流色谱图Fig.4 HSCCC profiles of flavonoids in n-hexane-ethyl acetatecarbinol -water (3:5:3:5, V/V)
收集图3中的Ⅰ、Ⅱ、Ⅲ、Ⅳ、Ⅴ各组分以及图4中的1、2、3、4组分按1.3.3.1节的HPLC条件进行分析,结果如图5所示。

图5 乙酸乙酯-正丁醇--水44∶1∶5体系组分Ⅱ(A)和Ⅳ(B)HPLLCC色谱图Fig.5 HPLC profile of flavonoid componentⅡin ethyl acetate-nbutyl alcohol-water (4:1:5, V/V) and that of component Ⅳ in the same solvent mixture
图5 为乙酸乙酯-正丁醇-水(4∶1∶5)体系中组分Ⅱ和组分Ⅴ的HPLC图谱。对照保留时间可知组分Ⅱ为芦丁,组分Ⅴ为槲皮素,质量分别为53.6、1.9 mg。通过标准曲线回归方程得到芦丁和槲皮素纯度分别达99%和94%,且分离时间较短,仅为4 h。而在正己烷-乙酸乙酯-甲醇-水(3∶5∶3∶5)体系中,由于芦丁分配系数<<1,出峰时间太短,与其他组分没有得到很好的分离,得到纯度较低,但是槲皮素纯度较高,综合考虑选用乙酸乙酯-正丁醇-水(4∶1∶5)体系进行苦荞黄酮中芦丁和槲皮素的分离。
3 结 论
本实验采用乙醇提取方法,以较优的提取条件:料液比1∶10、乙醇体积分数60%、温度80 ℃、搅拌提取、时间2 h、提取两次,测得苦荞麸皮中总黄酮含量为4.30%,粗提物纯度为40.2%。选用DA-201大孔树脂对提取得到的黄酮粗提物进行了初步纯化,得到纯化产物纯度为88.4%。运用HPLC外标法对苦荞麸皮初步纯化产物中的芦丁、槲皮素进行了定量测定,得出芦丁、槲皮素含量分别为80.5%与3.01%。以经初步纯化的苦荞麸皮黄酮为原料,进行了高速逆流的分离纯化,选用两相溶剂体系:乙酸乙酯-正丁醇-水(4∶1∶5),上相为固定相,下相为流动相,进样速率2 mL/min,转速850 r/min。于140 min收集到芦丁,在180 min时进行反推,于220 min时收集到槲皮素。经高效液相测定芦丁、槲皮素纯度分别为99%、94%。表明本研究采用的提取分离方法可以简便、有效的分离苦荞麸皮中的芦丁、槲皮素,为今后进一步的功效研究奠定了一定的基础。
[1] 林汝法, 周小理, 任贵兴, 等. 中国荞麦的生产与贸易、营养与食品[J]. 食品科学, 2005, 26(1): 259-263.
[2] KIM S L, KIM S K, PARK C H. Introduction and nutritional evaluation of buckwheat sprouts as a new vegetable[J]. Food Research International ,2004, 37: 319-327.
[3] BONAFACCIA G, MAROCCHINI M, KREFT I. Composition and technological properties of the flour and bran from common and tartary buckwheat[J]. Food Chemistry, 2003, 80: 9-15.
[4] 许效群, 刘志芳, 霍乃蕊, 等. 苦荞糠皮总黄酮的抗氧化活性及免疫调节活性[J]. 中国食品学报, 2012, 12(6): 42-47.
[5] 周小理, 成少宁, 周一鸣, 等. 苦荞芽中黄酮类化合物的抑菌作用研究[J]. 食品工业, 2010(2): 12-14.
[6] 吴秀华. 苦荞黄酮微胶囊的制备及其血糖调节功效的研究[D]. 长春: 吉林农业大学, 2008.
[7] 林汝法. 中国荞麦[M]. 北京: 中国农业出版社, 1994: 130.
[8] NIDHI G, SUNIL K S, JAI C R, et al. Expression of flavonoid biosynthesis genes vis-à-vis rutin content variation in different growth stages of Fagopyrum species[J]. Journal of Plant Physiology, 2011, 168: 2117-2123.
[9] JIANG Yue, LU Haitao, CHEN Feng. Preparative purification of glycyrrhizin extracted from the root of liquorice using high-speed counter-current chromatography[J]. Journal of Chromatography A, 2004, 1033(1): 183-196.
[10] 孙印石, 刘政波, 王建华, 等. 高速逆流色谱分离制备陈皮中的黄酮类化合物[J]. 色谱, 2009, 27(2): 244-247.
[11] 欧阳平. 苦荞麦中类黄酮的提取[D]. 太原: 中国日用化学工业研究院, 2004.
[12] 王斯慧, 白银花, 黄琬凌, 等. 苦荞黄酮对α-葡萄糖苷酶的抑制作用研究[J]. 食品科技, 2012, 37(2): 24-31.
[13] 宋薇薇. 石榴皮总黄酮的提取及抗 氧化活性和抑菌作用研究[D]. 成都: 西华大学, 2008.
[14] 甄云鹏. 苦荞壳中黄酮类化合物提取、纯化与其组分分离、测定[D]. 重庆: 西南大学, 2007.
[15] 白宝兰, 曹柏营, 郑鸿雁, 等. 苦荞叶黄酮的提取及精制[J]. 食品科学, 2008, 29(9): 181-185.
[16] 黄兴富, 黎其万, 刘宏程, 等. 高效液相色谱法同时测定苦荞中芦丁、槲皮素和山柰酚的含量[J]. 中成药, 2011, 33(2): 345-347.
[17] 盛达成, 肖文军, 邵元元. 高速逆流色谱分离纯化荷叶黄酮槲皮素[J].食品工业科技, 2011(4): 312-319.
[18] CAO Xueli, WANG Qiaoe, LI Yan, et al. Isolation and purification of series bioactive components from Hypericum perforatum L. by counter-current chromatography[J]. Journal of Chromatography B, 2011, 879: 480-488.
[19] 曹学丽. 高速逆流色谱分离技术及应用[M]. 北京: 化学工业出版社, 2005: 71.
[20] 彭爱一, 曲学伟, 李慧, 等. 高速逆流色谱分离纯化九里香中的黄酮类化合物[J]. 色谱, 2010, 28(4): 383-387.
[21] 赵淑杰, 韩梅, 韩忠明, 等. 高速逆流色谱分离与鉴定鹿药中黄酮类化合物[J]. 分析化学研究简报, 2009, 37(9): 1354-1358.
Isolation and Preparation of Flavones from the Bran of Tartary Buckwheat Using High Speed Counter Current Chromatography
ZHU Lin, REN Qing*, XU Xiao-yin g
(Beijing Higher Institution Engineering Research Center of Food Additives and Ingredients, School of Food and Chemical Engi neering, Beijing Technology and Business University, Be ijing 100048, China)
The bran of tartary buckwheat was extracted with 60% ethanol. A DA-201 macroporous resin column was applied in the purification of flavonoids from the extract. High speed counter current chromatography (HSCCC) method was used for preparative isolation and purification of rutin and quercetin from the preliminarily purified extracts. A two-phase solvent system composed of ethyl acetate, n-butyl alcohol and water (4:1:5, V/V) was used at a flow rate of 2.0 mL/min for HSCCC separ ation at a rotation speed of 850 r/min and the pooled eluates were detected at 25 4 nm. The purity of rutin and quercetin obtained was 99% and 94%, respectively, as detected by high performance liquid chromatography (HPLC). These results indicate that this method is convenient and effective and can be used to extract and purify rutin and quercetin from tartary buckwheat bran.
tartary buckwheat; rutin; quercetin; high speed counter current chromatography (HSCCC)
TS207.3
A
1002-6630(2014)02-0047-04
10.7506/spkx1002-6630-201402009
2013-05-17
国家现代农业产业技术体系建设专项(CARS-08-D-3)
朱琳(1988—),女,硕士研究生,研究方向为食品生物技术。E-mail:happy.sure@hotmail.com
*通信作者:任清(1969—),男,副教授,博士,研究方向为生物活性成分的分离提取及功能。E-mail:renqing@th.btbu.edu.cn

